腹腔鏡右半結腸切除術治療結腸癌與傳統術式的療效比較
王海波,陳樹偉,劉延軍,武文龍,李風臣
結腸癌是消化道十分常見的惡性腫瘤之一,現以手術治療為主。然而,常規開腹結腸癌根治手術中存在失血量多、機體創傷大,不利于術后康復等問題,致使其整體應用受限[1]。近年來,隨著微創技術的不斷成熟,腹腔鏡也已成為外科手術的新方向。腹腔鏡右半結腸切除術具有創傷輕微、失血量少、利于恢復等優勢,但部分研究認為此術式操作難度較高,加之術中需要觸及許多組織器官與血管,易導致出血[2,3]。 為了確保結腸癌患者的就醫質量,該研究選取了筆者所在醫院49例結腸癌患者,對其應用了腹腔鏡右半結腸切除術治療,并與49例行傳統開放式手術患者進行比較,現報告如下。
1 資料與方法
1.1一般資料2018年2月—2019年2月筆者所在醫院行擇期手術的結腸癌患者作為研究對象,共計98例,以隨機數字表法將其劃分為兩組,其中對照組與研究組患者各49例。對照組:男27例,女22例;年齡 48~75 歲,平均(55.4±4.8)歲;病程 2~6 個月,平均(4.0±0.5)個月;癌癥分型為中分化癌10例,高分化癌8例,低分化癌31例;病灶位置在回盲腸10例,升結腸9例,櫻花結腸25例,結腸肝曲5例;Dukes分期為A期12例,B期29例,C期8例。研究組:男 28 例,女 21 例;年齡 46~74 歲,平均(55.8±3.5)歲;病程 2~6 個月,平均(4.2±0.8)個月;癌癥分型為中分化癌11例,高分化癌8例,低分化癌30例;病灶位置在回盲腸12例,升結腸10例,櫻花結腸23例,結腸肝曲4例;Dukes分期為A期14例,B期27例,C期8例。納入標準:經病理組織活檢證實為結腸癌;病灶直徑未超過5 cm;可以耐受根治性手術;該次研究內容已取得所有患者及其家屬的知情同意。排除標準:伴有其他惡性腫瘤;已發生遠處轉移的晚期患者;有腹部手術史;伴有腸梗阻;嚴重代謝性疾病與其他臟器功能障礙;預計生存期不超過6個月;凝血功能障礙。上述一般情況比較中,兩組結腸癌患者無統計學差異(P>0.05)。
1.2方法(1)對照組接受傳統開腹右半結腸切除術治療,患者行氣管插管全身麻醉,取仰臥體位,從腹部正中開放一個15~20 cm的切口,逐層切開后對病灶部位、病灶直徑等情況予以探查。經腸系膜左側靜脈,切斷右半結腸血管與系膜,待胃結腸韌帶切除后,繼續游離橫結腸肝曲,對胃網膜右側淋巴與血管給予結扎處理,將右側腹膜切開。在Toldt間隙游離右半結腸與相關系膜,選擇病灶兩側>10 cm處行右半結腸切除,完整取出病灶送至病理科檢查。切除后的斷端給予側吻合,并間斷縫合,最后將結腸系膜關閉。取適量生理鹽水不斷沖洗腹腔,若未見活動性出血便可進行引流管留置,縫合腹腔。(2)研究組患者行腹腔鏡右半結腸切除術,麻醉及體位與對照組相同,在其臍正中5 cm處開放一個12 mm的切口作為觀察孔,置入Trocar。建立氣腹,并將壓力調控在13~15 mmHg。在患者鎖骨左側中線肋緣上方開放一個12 mm的切口,作為主操作孔,置入Trocar與器械。副操作孔為反麥氏點,并在其所對應的右側部位開放兩個切口,作為助手操作的入口。患者左側為操作醫師站位,雙腿間與右側為助手站位,若有需要可根據手術需要調整站位。置入腹腔鏡設備后先對病灶部位、大小,以及轉移情況予以探查,制定具體的手術方案。選擇腸系膜上靜脈與回結腸動靜脈后腹膜投影夾角部位作為操作點,將其切開,切至腸系膜靜脈根部。之后在左側腸系膜上靜脈切斷回結腸動靜脈,進入Toldt間隙,貫通此間隙至肝結腸韌帶,根部結扎處選取為胃網膜右血管、右結腸血管與結腸中動脈右支,全面處理根部淋巴結。于胃血管弓下方,切開胃結腸韌帶與肝結腸韌帶,開放右側側腹膜,整塊游離右半結腸。選擇腹正中開放一個6 cm的切口,其他操作與開腹操作相同,吻合橫結腸與回腸。
1.3觀察指標(1)評價兩組結腸癌患者術中情況與術后恢復情況,其中術中情況包括手術時間、術中失血量、清掃淋巴結的數量;術后恢復情況包括患者首次排氣與住院時間。(2)評價兩組術后所發生的并發癥情況,觀察指標包括肺部感染、小腸梗阻、吻合口漏、切口感染。
1.4統計學分析所有數據用SPSS 20.0軟件予以處理,計量資料與計數資料分別以(x±s)、(n,%)表示,組間比較分別行t與χ2檢驗,取P<0.05為差異具有統計學意義。
2 結果
2.1兩組患者術中與術后情況比較在術中失血量、術后首次排氣與住院時間比較中,研究組指標較對照組更短(P<0.05),在手術時間與清掃淋巴結的數量比較中,兩組差異無統計學意義(P>0.05)。見表1。
2.2兩組患者術后并發癥比較術后并發癥研究組患者的發生率為2.04%,較對照組16.33%更低(χ2=4.404,P<0.05)。 見表 2。
3 討論
結腸癌是危害人們健康與生命安全的嚴重疾病,其病因尚未完全闡明,普遍認為脂肪與纖維素攝入量不足有關,特別是存在結腸息肉的患者,可以顯著增加結腸癌的發生率[4]。同時,遺傳因素也能夠導致結腸癌的出現。結腸癌早期無明顯的癥狀表現,隨著病情的進展可進一步發生腹脹、消化不良等消化系統癥狀,并伴有乏力、貧血、下肢水腫、消瘦等[5]。

表1 兩組患者術中與術后情況比較(x±s)
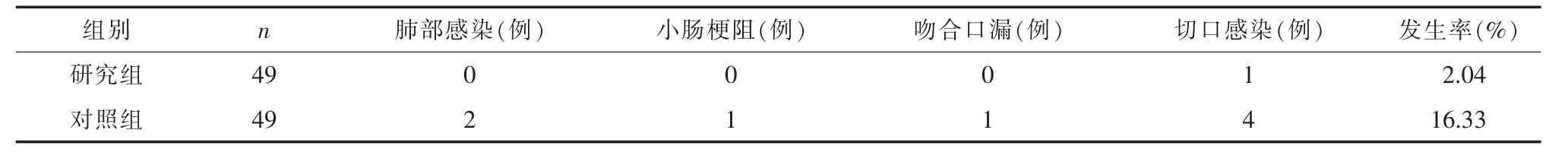
表2 兩組患者術后并發癥比較
目前,結腸癌患者主要采取手術方案治療。右半結腸切除術是結腸癌患者常見的治療手段之一,但部分研究發現,由于右半結腸解剖部位較為復雜,手術時受空間局限性的影響,術中需要觸及重要組織與血管,增加了手術操作難度[7]。近年來,隨著微創技術的不斷成熟,腹腔鏡也已成為了外科手術的新方向。腹腔鏡右半結腸切除術可以清晰地顯示出術野,利于淋巴結清掃,特別是根部淋巴結清掃,所以具有創傷小、出血量少等優勢[8]。同時,現階段腹腔鏡右半結腸切除術主要采用中間入路,將結腸系膜血管離斷,結腸固定裝置離斷,并游離結腸,以便在解剖腸膜上靜脈的同時將結腸系膜切開,到達手術操作的外科平面,這樣不僅縮小了操作難度,且創傷更為輕微,顯著降低了并發癥概率[9]。學者張有錢[10]對58例結腸癌患者施以腹腔鏡右半結腸切除術治療,并與開腹右半結腸切除術組對比,結果顯示在術中失血量、術后首次排氣與住院時間比較中,研究組指標較對照組更短(P<0.05),且術后并發癥發生率1.72%,低于開腹組12.07%。該文研究結果與此結果相近,研究組術中失血量、排氣時間與住院時間均短于對照組(P<0.05)。可見,腹腔鏡在微創器械的輔助下實施手術,對傳統開放式結腸癌根治術未進行本質改變,僅利用腔鏡操作替代傳統開腹操作,減少了術中出血量,以及對患者機體的損傷,更利于術后恢復。在手術時間與清掃淋巴結的數量比較中,兩組無明顯差異(P>0.05)。兩組患者淋巴結清掃數量無明顯差異,說明兩組在腫瘤清除方面的效果相當,手術時間則與術者操作技術有關。此外,在術后并發癥比較中,研究組患者的發生率為2.04%,較對照組16.33%更低(P<0.05)。腹腔鏡右半結腸切除術符合微創技術要求,術中可以充分暴露出神經組織,有效減少了腹下神經損傷;術中利用超聲刀、腹腔鏡等技術切除腸系膜、腹膜及韌帶后,能夠及時給予止血處理,所以進一步預防了術后并發癥風險。
總之,腹腔鏡右半結腸切除術不僅具有理想的臨床治療效果,且微創優勢明顯,進一步保障了患者的預后質量,值得臨床推廣。

