麥粒灸對雙轉基因AD 小鼠GFAP 與Aβ1-42斑塊共定位的影響
樊振宇,包燁華,張永生,楚佳梅
(1.浙江醫院,杭州 310016;2.杭州市中醫院,杭州 310007;3.浙江中醫藥大學,杭州 310053)
阿爾茨海默病(Alzheimer’s disease, AD),是一種以認知記憶障礙為特征的進行性中樞神經系統退行性疾病。其主要病理特征為細胞外β-淀粉樣蛋白(β-amyloid protein, Aβ)沉積形成的老年斑(senile plaque, SP)、Tau 蛋白異常聚集形成的神經元纖維纏結、突觸減少和神經元丟失以及腦萎縮[1]。老年斑主要是由 Aβ沉積形成,細胞內神經元纖維纏結主要是微管相關蛋白 tau 的過度磷酸化導致[2]。多數學者認為Aβ沉積形成的老年斑是AD 病理發展的核心機制[3]。可溶性 Aβ過度表達,其生成和清除失衡,從而加劇神經原纖維的纏結、炎性反應和細胞死亡,是導致AD 的直接因素[4]。星形膠質細胞是中樞神經系統內膠質細胞的重要組成部分,通過與腦內其他細胞接觸和連接,具有營養和支持神經元、調節神經遞質釋放、離子緩沖、信號轉導、能量代謝、血流控制等功能[5-6]。Aβ沉積亦會激活星形膠質細胞,在神經膠質細胞中,星形膠質細胞數目最多,散布最廣,擔負著神經膠質細胞的大部分功能,激活的星形膠質細胞對神經系統既有保護作用又有毒性作用。且激活的星形膠質細胞可以釋放多種炎癥因子來調節AD 的病情發展。許多報道稱在AD 腦組織的 Aβ沉積周圍含有的星形膠質細胞數量極多,神經膠質纖維酸性蛋白(glial fibrillary acidic protein, GFAP)是星形膠質細胞內的中間絲蛋白,是其特異性標記物。保護星形膠質細胞的正常功能,使其發揮對神經系統的保護作用,將成為AD 治療的新方向。
迄今為止,治療AD 并沒有特效藥物和良好的治療方法。因此,應該在還未發病或發病早期對AD 進行干預,阻止或延緩 Aβ異常沉積產生神經毒性作用所激發的一系列AD 病理過程。隨著科學的發展,醫學發展也開始著重于以疾病預防為主,符合中醫學“治未病”思想。艾灸作為我國傳統治療方法,近年來在防治阿爾茨海默病方面體現出了較好的療效,實驗研究表明,艾灸不僅具有遠紅外線輻射的功能,而且具有近紅外線輻射的功能,一般遠紅外線能直接作用于人體較為淺表的部位,而近紅外線能滲入人體較為深層的組織,且能通過毛細血管網將熱能傳遞到更廣泛更深層的部位,從而進一步調整人體的免疫功能。麥粒灸屬于艾灸療法中的一種,具有患者易于接受、熱力深透、操作方便、療效顯著的特點。用麥粒灸療法時,艾炷與小鼠皮膚接觸更為緊密,艾灸刺激的強度、滲透度比其他艾灸療法更為顯著,麥粒灸作為本研究的特色治療方法,其治療效果更出色。目前大多數的針灸臨床研究偏向于對AD的后期治療,在后期治療效果不理想的情況下,早期對該病的防治顯得極為重要。本實驗的目標在于通過觀察AD 小鼠腦內Aβ沉積與GFAP 的病理學改變來研究麥粒灸治療AD 的作用及機制,從而為臨床麥粒灸法治療AD 提供理論依據,為進一步研究AD 發病機制奠定基礎。
1 材料與方法
1.1 模型制備
由中科院上海生命科學院生化所景乃禾研究員惠贈飼養于動物實驗研究中心。B6SJL-Tg(APPSwFlLon,PSEN1*M146L*L286V)6799Vas/J 品系雙轉基因AD 小鼠雜合體種鼠4 只,配種鼠由中科院上海實驗動物中心/上海斯萊克實驗動物有限公司提供[SCXK(滬)2007-0005],已經由所在SPF 級實驗動物中心繁殖并形成建立了規范的飼養條件,由 SPF 級轉基因實驗動物中心提供飼養條件,繁衍所產生后代。出生的子鼠在 3~4周后剪尾鑒定。本研究中動物實驗嚴格遵循保護原則、動物福利原則、倫理原則和綜合性科學評估原則。
1.2 主要試劑與儀器
瓊脂糖凝膠和溴乙錠(上海生工生物工程有限公司提供)、10%水合氯醛(02030,上海化學試劑有限公司)、PBS 磷酸鹽緩沖液(ZLI-9062,北京中杉金橋生物技術有限公司)、驢血清封閉液(sigma 分裝)抗熒光淬滅封閉液(P0128,碧云天生物技術研究所)、Anti-beta Amyloid 1-42 antibody(Ab10148,abcam 公司)、Anti-GFAP antibody(Ab53554,abcam 公司)、AF488 Donkey Anti-Rabbit IgG(H+L)(DW-DAR4881, abcam公司)、Cy3 Conjugated Donkey Anti-Goat IgG (H+L)(DW-A0502, abcam 公司)、PTC-200 PCR 擴增儀(Biorad 公司)、EPS 601 水平電泳儀(GE 公司)、臺式冷凍離心機(Thermo 公司)、倒置熒光顯微鏡 IX71(Olympus 公司)、冰凍切片機(Thermo Fisher 公司)。
1.3 PCR 法鑒定APP/PS1 轉基因小鼠基因表型
1.3.1 提取基因組DNA
所生子代小鼠 3~4 周齡時,剪取小鼠鼠尾約0.5 cm 放入1.5 mL 離心管內,每管中加入0.5 mL 裂解液,以 12000 r/min、56℃轉動 2 h 以上或過夜,離心 20 min,取上清,加入等體積異丙醇混勻,放置30 min,12000 r/min 離心 10 min,沉淀 DNA。瓊脂糖凝膠電泳檢測DNA 片段,制備2%瓊脂糖凝膠加溴化乙錠 5 μL,加入擴增后 DNA10 μL,120 V、30 min 電泳,觀察PCR 產物長度。
1.3.2 引物設計
以Primer5.0 軟件設計小鼠Tg(APP)、Tg(PS1)序列引物,如表1。

表1 小鼠Tg(APP)、Tg(PS1)序列引物
1.3.3 PCR 擴增
按照Takara 公司產品說明書,根據定量體系摸索的實驗研究條件,確定最佳反應體系,以目的DNA 為模板進行 PCR 擴增反應,采用相同的數據記錄標準進行數據記錄。具體方法如下。
1.3.3.1 配制PCR 反應液
按照下列組分配制 PCR 反應液(反應液配制在冰上進行)。
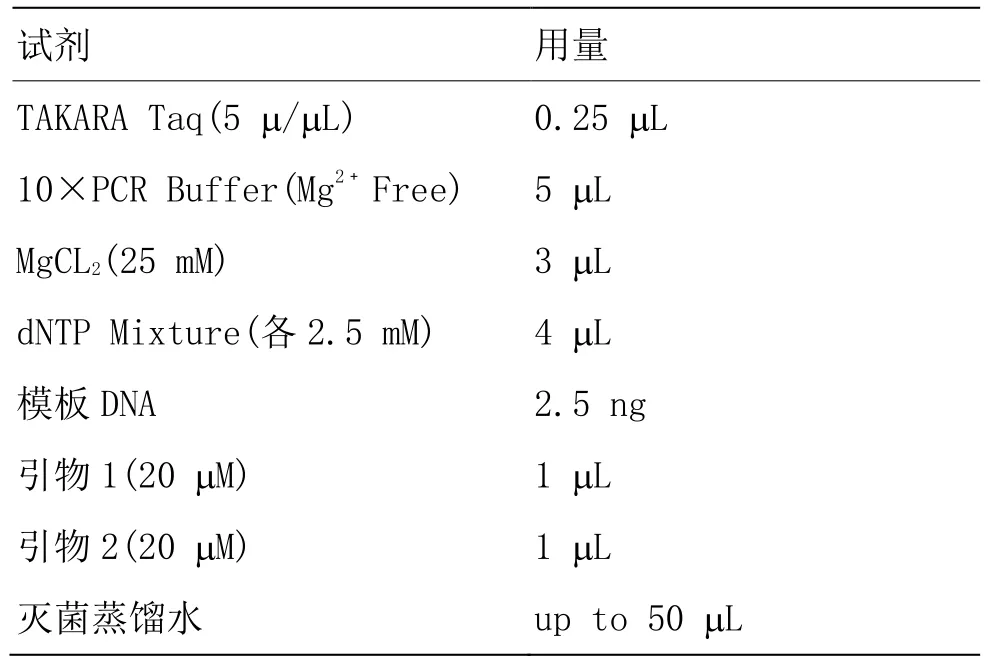
表2 PCR 反應液配制
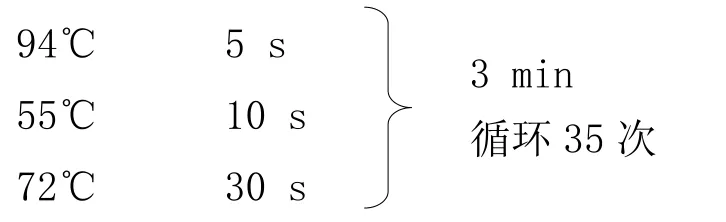
1.3.3.2 反應程序
以 Tg(APP)Tg(PS1)DNA 為模板,進行 PCR 反應,反應條件如下:
1.3.3.3 瓊脂糖凝膠電泳
制備 2%瓊脂糖凝膠加 EB 5 μL,加入擴增后DNA10 μL,120 V、30 min 電泳,觀察 PCR 產物長度。
1.4 動物分組
PCR 檢測結束后APP/PS1 雙轉基因鑒定結果為陽性的小鼠40 只(1.5 月齡)按隨機數字表法隨機分為模型組20 只和治療組20 只。同齡同背景的C57BL6J 陰性純合子野生型小鼠20 只(1.5 月齡)為正常組。飼養期間給予動物標準顆粒飼養及自由飲水。溫度 22±1℃,相對濕度 50%~70%,換風次數 15~20 次/h,光照150~200 Lx,12 h 明暗交替,噪音<50 dB,設有溫度、濕度、光照、壓力梯度等自動控制和顯示系統,飲用水及飼料均高溫蒸汽滅菌,喂養期間可自由飲水和進食。
1.5 干預方法
小鼠穴位定位參照中國針灸學會實驗針灸分會制定的《動物針灸穴位圖譜》及比較解剖學方法,取心俞(第5 胸椎下兩旁肋間)、腎俞(第2 腰椎下兩旁)穴。治療前,3 組小鼠均剃除穴位區域毛發。采取人工固定小鼠,治療組 AD 小鼠穴位區涂少量凡士林(可粘住艾炷即可),以麥粒大小艾炷(5 mm×8 mm)艾灸雙側心俞、腎俞,當艾炷燃燒至 3/5(以小鼠的耐受度為限),即去除,每次灸1 壯,若有皮膚燙傷,涂濕潤燒傷膏少許。正常組和模型組給予抓取、固定及放置未燃燒的艾炷等刺激,小鼠治療時間均為每日1 次,連續治療 10 d,中間休息2 d,再繼續下一次治療,總共治療5.5 個月(全部治療結束后小鼠為7 月齡)。
1.6 樣本取材處理
1.6.1 灌注固定
將實驗動物小鼠麻醉、取腦。用10%水合氯醛(一般 0.1 mL/10 g)腹腔注射麻醉小鼠成功后,將其仰臥伸展四肢固定于平臺上,開胸暴露并游離出心臟和肝臟。將輸液器針頭從心尖部位穿入左心室,并用止血鉗固定于左心室,然后將右心耳剪口以使血液和灌注液流出。快速灌注0.9%生理鹽水50 mL 左右至肝臟完全變白,右心室流出澄清液體后,改灌 4%多聚甲醛固定液,先快速再緩慢灌注60 mL 左右,若觀察到小鼠尾巴翹起或四肢抽搐,表明多聚甲醛進入體循環,即完成固定。灌注固定后斷頭,完整取出小鼠腦,投入4%多聚甲醛溶液中固定。
1.6.2 脫水
將固定好的標本投入 10%蔗糖進行脫水處理。待標本于10%蔗糖溶液中下沉至容器底部后,換至30%蔗糖溶液,4℃過夜。
1.6.3 包埋與冷凍
脫水后的標本用OCT 膠充分包埋,編寫樣本序號,液氮速凍,放置-80℃冰箱貯藏。
1.6.4 冰凍切片
每只小鼠腦組織在恒冷箱冰凍切片機切片,于視交叉前、后連續冠狀切片,片厚約20 μm。剩余暫未實驗切片繼續放置于-80℃冰箱貯藏。
1.7 指標檢測
采用免疫熒光雙標實驗檢測皮層及海馬 Aβ1-42與GFAP 的共表達。①腦組織進行冰凍切片,片厚約20 μm,貼片法,37℃,1 h。②PBS 洗4 次,一次10 min,取出玻片,用紙小心擦去多余水分,但不能使組織干燥。用組化油筆將待染組織圈好。③滴加封閉液 37℃孵育30 min。④同時加入一抗兔來源(Aβ1-421:1000)、山羊來源(GFAP1:1000),置于濕盒,37℃孵育2 h 后轉入4℃過夜。⑤次日拿出濕盒,37℃復溫1 h,棄一抗,PBS洗4 次,一次10 min。⑥滴加二抗Cy3 紅色熒光標記的驢抗兔(1:150)、AF488 綠色熒光標記的驢抗山羊(1:500),37℃避光 2 h。⑦棄二抗,PBS 洗 4 次,一次10 min,避光。⑧晾干后,滴加抗熒光猝滅封片液,用處理干凈的蓋玻片封片。⑨激光共聚焦顯微鏡下觀察、拍片,在免疫熒光染色切片的海馬區和額葉皮層各取6 個視野(20×),應用圖像分析軟件測量每個視野內Aβ1-42與GFAP 共表達指標的陽性細胞率。
1.8 統計學方法
采用SPSS17.0 對數據進行統計分析。符合正態分布的計量資料均以均數±標準差表示。組間兩兩比較,方差齊時采用LSD檢驗,方差不齊采用Dunnett’s T3檢驗。以P<0.05 為差異具有統計學意義。
2 結果
2.1 APP/PS1 轉基因小鼠基因型的鑒定結果
本實驗所用的 APP/PS1 雙轉基因小鼠表型穩定,PCR 法鑒定小鼠基因型。詳見圖1。
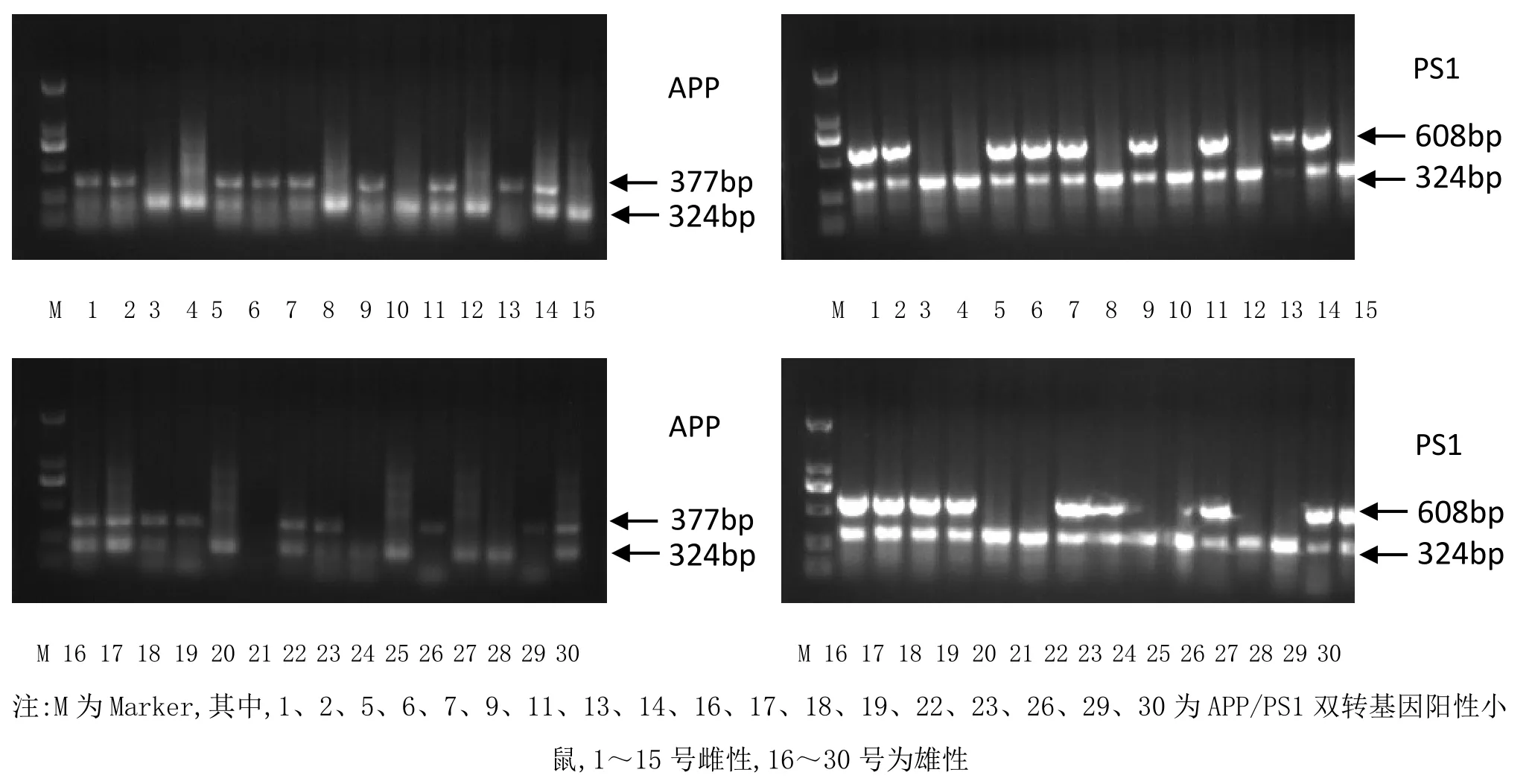
圖1 PCR 法鑒定APP/PS1 轉基因小鼠的凝膠電泳分析
2.2 艾灸治療對早期AD 小鼠腦內Aβ1-42及GFAP 共表達的影響
熒光顯微鏡下,小鼠大腦GFAP 免疫陽性細胞廣泛分布,GFAP 免疫陽性細胞胞體膨脹、肥大,突起較多,呈樹枝狀,且突起增厚、濃染,數個陽性細胞可聚集成團,為活化的星形膠質細胞。淀粉樣斑塊沉淀呈紅色熒光。GFAP 與 Aβ1-42淀粉樣蛋白免疫熒光雙標染色結果顯示,小鼠大腦皮層和海馬內活化的綠色星形膠質細胞GFAP 成簇狀圍繞在紅色Aβ斑塊周圍,胞體膨脹、肥大;突起較多,呈樹枝狀,有的突起伸入到紅色斑塊內。
實驗觀察發現,模型組小鼠腦內 GFAP、Aβ1-42的陽性細胞表達率較對應的正常組明顯增多,但是經過麥粒灸治療后的AD 小鼠腦內GFAP、Aβ1-42的陽性細胞表達率比模型組顯著減少,提示了早期麥粒灸療法治療AD 有顯著治療效果,可以抑制AD 小鼠星形膠質細胞的炎癥反應,抑制Aβ異常聚集。詳見表3。
表3 各組小鼠腦內Aβ1-42及GFAP 共表達的比較 (±s,%)
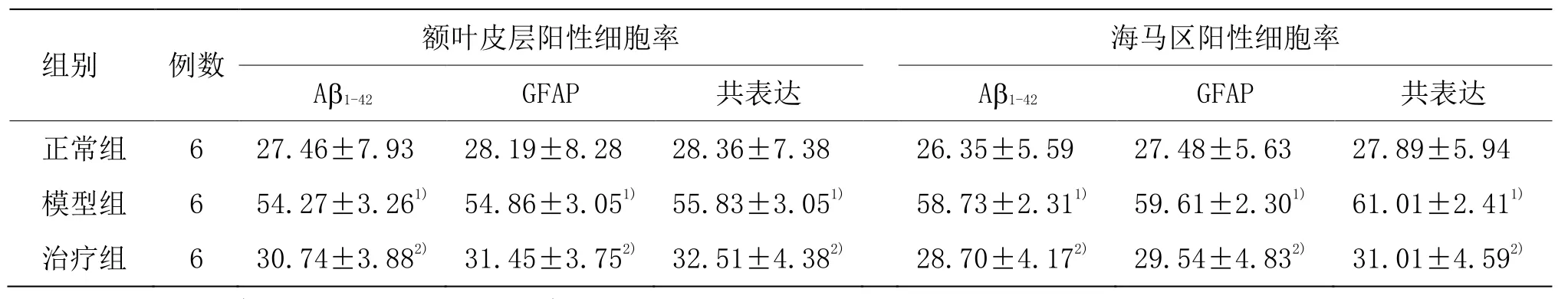
表3 各組小鼠腦內Aβ1-42及GFAP 共表達的比較 (±s,%)
注:與正常組比較1)P<0.01;與模型組比較2)P<0.01
組別 例數 額葉皮層陽性細胞率 海馬區陽性細胞率Aβ1-42 GFAP 共表達 Aβ1-42 GFAP 共表達正常組 6 27.46±7.93 28.19±8.28 28.36±7.38 26.35±5.59 27.48±5.63 27.89±5.94模型組 6 54.27±3.261) 54.86±3.051) 55.83±3.051) 58.73±2.311) 59.61±2.301) 61.01±2.411)治療組 6 30.74±3.882) 31.45±3.752) 32.51±4.382) 28.70±4.172) 29.54±4.832) 31.01±4.592)
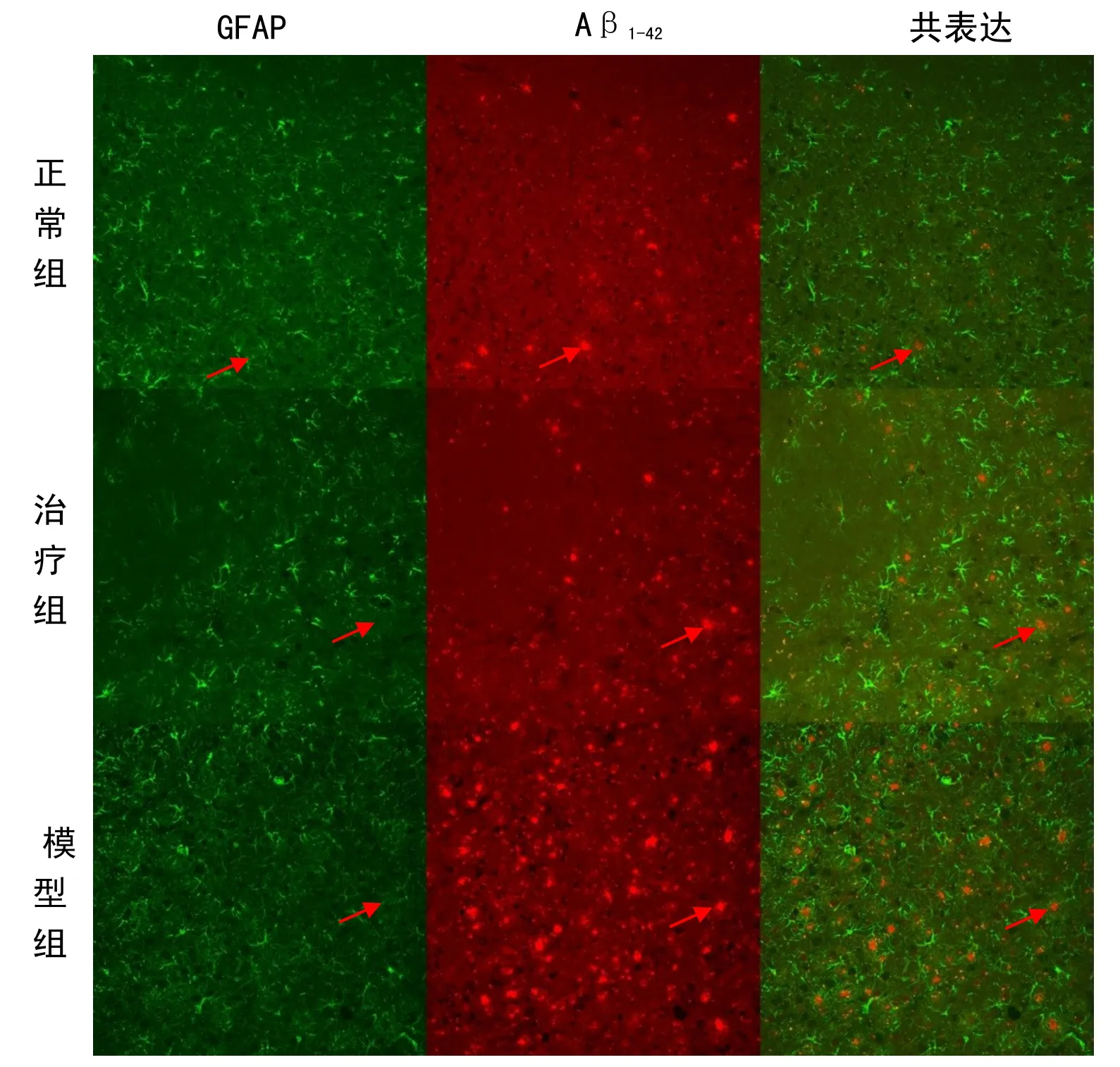
圖2 額葉皮層區Aβ1-42及GFAP 共表達(×20)
3 討論
β-淀粉樣蛋白(Aβ)具有很強的自聚性,極易形成極難消融的沉淀并逐漸沉積于腦中[7]。Aβ沉積亦會激活星形膠質細胞,在神經膠質細胞中,星形膠質細胞數目最多,散布最廣,擔負著神經膠質細胞的大部分功能,星形膠質細胞的功能發生變化將影響其對神經元的保護作用。許多研究稱在AD 腦組織中的淀粉樣斑塊周圍含有的星形膠質細胞及小膠質細胞的數量極其多,且伴有不同程度的形態改變,如星形膠質細胞胞體肥大、變性及萎縮等[8],激活的星形膠質細胞對神經系統有雙重作用,既有保護作用又有毒性作用[9]。許多研究表明神經炎癥在AD 病變發展過程中起著很重要的作用,激活的星形膠質細胞可以釋放多種炎癥因子來調節AD 的病情發展[10-11]。
Aβ主要是由其前體蛋白(amyloid precursorprotein, APP)經過β-分泌酶、γ-分泌酶裂解形成,根據肽段的長度不同,在體內以多種形式存在,Aβ是細胞的固有成分,在正常人腦脊髓液中可溶性Aβ和AD 中出現的濃度相同,這說明 Aβ是一種自然而非病理性的產物[12]。Aβ是腦內主要的興奮性和抑制性神經遞質,包括 Aβ1-40、Aβ1-42、Aβ1-43三種,而在腦內發揮神經毒性作用的主要是 Aβ1-40和 Aβ1-42兩種[13-14]。除了介導正常的突觸傳遞外,還參與突觸的可塑性[15]、學習和記憶[16]、神經發育[17]以及神經毒性[18]等諸多生理病理功能。其中 Aβ1-40是主要成分,Aβ1-42聚集性最強,有更強的神經細胞毒性。Aβ1-42已被證實具有較高的聚集傾向,同時被認為是老年斑中最主要的淀粉樣物質[19],過渡態的Aβ1-42寡聚物或纖維會導致線粒體功能阻滯,神經細胞的凋亡,神經回路障礙,尤其與突觸和神經元的損失相關,最后引起癡呆癥[20]。Aβ1-42聚集是引起Aβ1-42毒性蛋白的主要原因,Aβ1-42毒性蛋白是引起AD 發病的主要原因,所以,抑制Aβ1-42的聚集可以有效防止AD 的發生[21]。
膠質纖維酸性蛋白(GFAP)是星形膠質細胞內的中間絲蛋白,是公認的星形膠質細胞的標志蛋白,GFAP表達上調的程度代表星形膠質細胞增生活躍程度,在腦損傷的炎癥中會出現以GFAP 為特征的纖維化。通過研究 GFAP 的表達強或弱可反映在正常及病理條件下星形膠質細胞的功能狀態[22]。星形膠質細胞通過形態和功能的改變由靜息狀態轉化為激活、增生狀態時,可以造成中樞神經系統功能的損傷,這一激活的過程以 GFAP 表達水平的增多為主要表現[23]。國外學者Landfield PW 等[24]發現老年記憶損害的大鼠海馬內的星形細胞肥大,并認為GFAP 與老年學習記憶能力減退之間有一定的關聯性。
AD 患者腦內伴有明顯膠質細胞反應,斑塊周圍出現大量星形膠質細胞,激活星形膠質細胞在老年斑的形成中起到重要作用。激活的星形膠質細胞具有吞噬功能,可吞噬并降解 Aβ,有研究發現 Aβ可促進星形膠質細胞釋放細胞因子,如 IL-1β、IL-6、IFN-γ、IL-13、IL-17、IP-10 等,這些物質對神經元有毒性作用,而星形膠質細胞的激活又能夠誘導 Aβ神經毒性的產生,使神經元凋亡并壞死。蔡志友等[25]所做實驗的直線相關分析表明Aβ1-42與GFAP 表達呈顯著正相關。星形膠質細胞的增強激活會增加炎癥介質的分泌,使得 Aβ1-42產物增加,而 Aβ1-42產物增多則進一步激活星形膠質細胞釋放炎癥因子而增加 Aβ1-42產物的生成,從而發生級聯放大作用。所以筆者認為Aβ1-42與GFAP 的表達有一定的關聯性。
古人云:“藥之不及,針之不到,必須灸之。”《名醫別錄》:“艾味苦,微溫,無毒,主灸百病。”艾屬菊科多年生草本植物,其氣味芳香、易燃,艾灸可通過艾葉辛溫之性,激發人體經絡之氣,溫陽補虛,以達到補益人體正氣,防病保健“治未病”的目的[26]。艾灸是中醫傳統治療方法,具有防病保健的作用,在疾病的早期干預治療方面具有其特定的優勢。《扁鵲心書》:“保命之法,灼艾第一。”《類經圖翼》:“神闕行隔鹽灸,艾灸至三五百壯,不惟疾愈,亦且延年。”《外臺秘要》:“三里養先后天之氣,灸三里可使元氣不衰,故稱長壽之灸。”近年來,艾灸在延緩衰老方面的研究取得了較大突破,大量研究表明艾灸具有延緩衰老的作用。吳巧鳳等[27]對學習記憶能力減退的SD 老年大鼠進行艾灸治療,發現艾灸具有促進學習記憶能力減退的老年大鼠海馬神經發生的作用。陳興華等[28]觀察艾灸五臟背俞穴對模型大鼠海馬神經元形態結構的影響,提示艾灸治療可抑制大鼠海馬神經元凋亡,對大鼠的腦損傷也具有一定的保護作用。喬秀蘭等[29]發現艾灸能夠抑制快速老化小鼠皮層神經干細胞向成熟星形膠質細胞和少突膠質細胞分化。
由此可見,艾灸療法相對其他療法來說具有一定的優勢,是治療與學習記憶相關疾病的良好治療方式。但是到目前為止關于麥粒灸療法治療 AD 的機制的研究很少,所以本研究在雙轉基因小鼠1.5 月齡時,腦內剛開始發生Aβ聚集的AD 病理過程早期介入麥粒灸治療,通過艾灸治療后,與模型組比較,治療組小鼠額葉皮層和海馬區Aβ1-42的表達明顯減少。研究結果表明,早期麥粒灸療法對治療AD 有顯著治療效果,可以抑制AD 小鼠星形膠質細胞的炎癥反應,抑制 Aβ異常聚集,從而延緩AD 病理過程進展,達到“既病防變”的目的。

