氧化鎂蒸氨反應的動力學和機理研究
丁 珂 ,孫曉君 ,李會杰 ,黃娜娜 ,仇 龍 ,劉云義 ,2,李 雪 ,2
(1.沈陽化工大學化學工程學院,遼寧省化工應用重點實驗室,遼寧沈陽110142;2.遼寧精細化工協同創新中心)
氫氧化鎂是一種重要的無機化學材料,在高分子材料的阻燃、廢水廢氣的處理等方面具有廣泛的用途[1-3]。同時,中國具有豐富的鎂系資源,物理粉碎法和直接水化法是制備氫氧化鎂的常見方法,然而當菱鎂礦品位較低時,這2種方法制備得到的氫氧化鎂均不符合行業標準[4-6]。因此對于低品位的鎂礦資源一般在750~1100℃下煅燒,得到輕燒粉(主要成分為MgO),將輕燒粉和銨鹽等物質反應,制備得到鎂鹽溶液,再和沉淀劑反應制備氫氧化鎂產品[7-9]。氧化鎂水化“溶解-沉淀”機理得到廣泛認同[10-15]。但對輕燒粉/氧化鎂和銨鹽反應過程及其機理鮮有報道。
本文以輕燒粉為原料,和氯化銨進行蒸氨反應,探討了鎂離子濃度與反應時間和溫度的關系,并對反應所得濾渣做了分析。以氫氧化鎂(純度>99%)煅燒制備的氧化鎂為原料,探究了氧化鎂水化反應動力學和蒸氨反應機理,以期為相關蒸氨實驗和工藝提供理論和數據參考。
1 實驗
1.1 實驗原料與儀器
輕燒粉,氫氧化鎂 (純度>99%),四口燒瓶,KBF1200X型馬弗爐,DF-101S型集熱式恒溫攪拌水浴鍋。
1.2 實驗方法
取一定比例輕燒粉和氯化銨固體,在500 mL體系中攪拌混合均勻,用恒溫油浴鍋控制反應溫度。將反應液進行過濾、洗滌、干燥,反應所得濾液中鎂離子濃度用乙二胺四乙酸(EDTA,0.05 mol/L)標準溶液滴定。濾渣置于馬弗爐中在900℃下煅燒2 h,測定濾渣的質量變化率(%)。
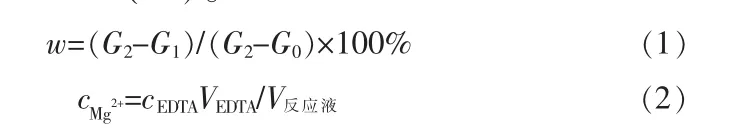
式中:G2-G1和G2-G0分別為煅燒前后樣品質量。
取一定量實驗室自制氫氧化鎂(純度>99%)在600、700、800℃下煅燒4 h,使氫氧化鎂完全轉化為氧化鎂。
1.3 分析測試儀器
采用D8型X射線衍射儀(XRD)測定樣品的晶體結構,Cu靶,Kα射線,管電壓為40 kV,管電流為40 mA;步長為 0.05(°)/s,掃描范圍為 10~80°。
反應后所得濾渣使用WSB-2型白度計測定白度。樣品測試前,在樣品表面進行離子濺射噴金,以增加其導電性能,再將樣品直接固定在導電膠帶上。采用JSM-6360 LV型掃描電鏡,測定樣品的表面形貌。
2 實驗結果與討論
2.1 輕燒粉蒸氨反應
輕燒粉與NH4Cl物質的量比為1∶2,在不同反應溫度、反應時間DE條件下做蒸氨反應。測定所得溶液中 Mg2+、NH4+的濃度,結果見圖 1~2。 由圖 1~2 可知,隨著蒸氨反應的進行,溶液中鎂離子濃度不斷增加。常壓條件下,蒸氨反應溫度越高,越有利于蒸氨反應的進行。當反應120 min,70~90℃時,溶液中鎂離子濃度約為0.37 mol/L;100℃時鎂離子濃度為0.834mol/L。100℃時,當蒸氨反應進行到20 min時,鎂離子濃度迅速達到了0.5374mol/L,此時活性氧化鎂浸出率為51.67%;隨著反應的繼續,鎂離子的浸出率顯著提高;反應時間為200 min后,鎂離子的濃度為0.9818 mol/L,活性氧化鎂浸出率為94.41%;當反應時間為240 min,Mg2+的濃度為0.9843 mol/L,活性氧化鎂浸出率為94.64%,由此可見反應時間為200min時,繼續延長反應時間對輕燒粉中Mg2+的浸出率影響不大。這可能是因為反應初始溶液中的Mg2+濃度低和NH4+濃度高,促使反應不斷向Mg2+濃度增高和NH4+濃度降低的方向進行,當反應200 min時,溶液中的Mg2+和NH4+濃度達到動態平衡,活性氧化鎂浸出率變化不大。
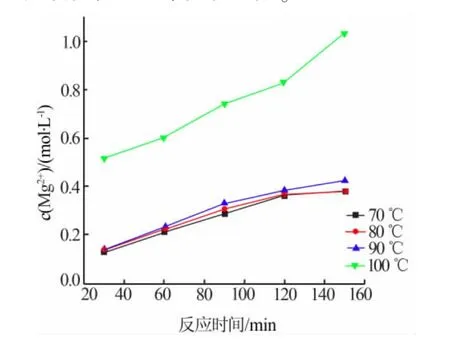
圖1 反應溫度和時間對Mg2+濃度的影響

圖2 輕燒粉蒸氨反應數據圖
圖3為輕燒氧化鎂反應所得濾渣照片。由圖3可見,輕燒粉和氯化銨蒸氨反應后所得濾渣在900℃下煅燒2 h,得到圖3c樣品;輕燒粉和稀鹽酸反應后所得濾渣如圖3d所示。分別對這2組樣品做XRD表征,結果見圖4。
由圖3可知,輕燒粉的白度為83.5,蒸氨所得濾渣的白度為85.5;濾渣在900℃下煅燒得到的樣品白度為82.2;輕燒粉與鹽酸反應所得濾渣白度為36.7。這是因為在蒸氨反應過程中輕燒粉中的氧化鎂反應生成鎂離子,反應剩余物氫氧化鎂的密度逐漸減小,雜質含量相對少,導致白度下降。由圖4可知,殘渣的主要組分為Mg2SiO4。

圖3 輕燒氧化鎂反應所得濾渣照片

圖4 輕燒氧化鎂反應所得濾渣的XRD譜圖
對于蒸氨反應而言,反應剩余物中不存在氧化鎂,而存在氫氧化鎂。即氧化鎂和氯化銨反應過程中未生成Mg2+的氧化鎂,反應生成了氫氧化鎂。
2.2 氧化鎂水化反應
取600、700、800℃下煅燒氫氧化鎂(純度>98%)得到的氧化鎂 20 g,與 500 mL水分別在 20、40、60℃下進行水化反應。結果見圖5。

圖5 氧化鎂水化反應數據圖
采用試差法將圖5a~5c的實驗結果代入各級反應速率方程。由試差法可得:氧化鎂水化數據{t,w}分別作-ln(1-w)~t圖得到其線性關系圖和速率方程(圖5d~5f),速率常數通過回歸直線的斜率得到,其水化動力學方程:

式中,w為氧化鎂水化率,%;k為反應速率常數,t為水化反應時間。
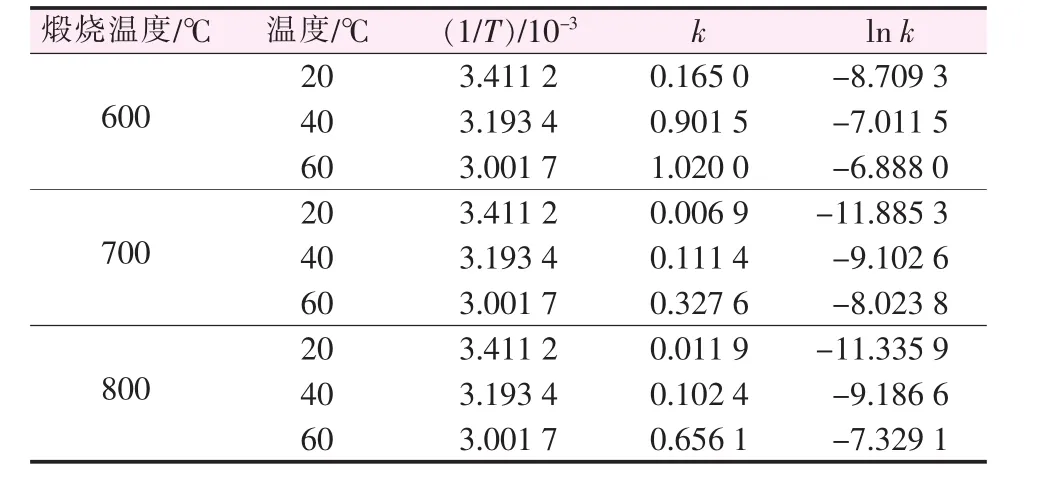
表1 氧化鎂水化速率常數
將表 1 所得數據{1/T ,ln k},做 ln k~1/T 圖(圖5d~5f),依據 Arrhenius方程的不定積分公式:

通過擬合得到直線的斜率,可以求出不同煅燒溫度所得氧化鎂的水化反應活化能。結果見表2。由表2可知,不同煅燒溫度制備的氧化鎂的反應活化能不同,隨著煅燒溫度的升高氧化鎂水化反應活化能升高;輕燒粉蒸氨反應中,升高蒸氨反應溫度,有利于氧化鎂的水化和提高反應速率。同時,根據Bebson關于化學反應和擴散控速的活化能判斷依據:E擴散<25.12 kJ/mol<E化學[8],由表 2 可知,氧化鎂水化反應屬于化學反應控速機理。

表2 氧化鎂水化反應活化能
2.3 氧化鎂蒸氨反應
以氫氧化鎂600℃煅燒制備的氧化鎂為原料,對改變反應時間所得蒸氨反應剩余物做了表征。結果見圖6。由圖6可知,隨著蒸氨反應的進行,六方片狀晶體結構遭到破壞變成微小顆粒狀晶體。這是因為氧化鎂蒸氨反應遵循氧化鎂水化反應機理中的“溶解”機理。同時,由圖6f的XRD表征可得,當蒸氨反應進行30 min時,溶液中氧化鎂全部被水化成氫氧化鎂。

圖6 氧化鎂蒸氨反應表征
不同煅燒溫度制備的氧化鎂,按 n(MgO)∶n(NH4Cl)=1∶2.2 配置成 500 mL 溶液在 100℃下進行蒸氨反應,結果見圖7。由圖7可知,不同煅燒溫度制備的氧化鎂進行蒸氨反應時,0~30 min生成鎂離子的速率有明顯差異;30 min之后溶液中鎂離子生成速率大致相同。
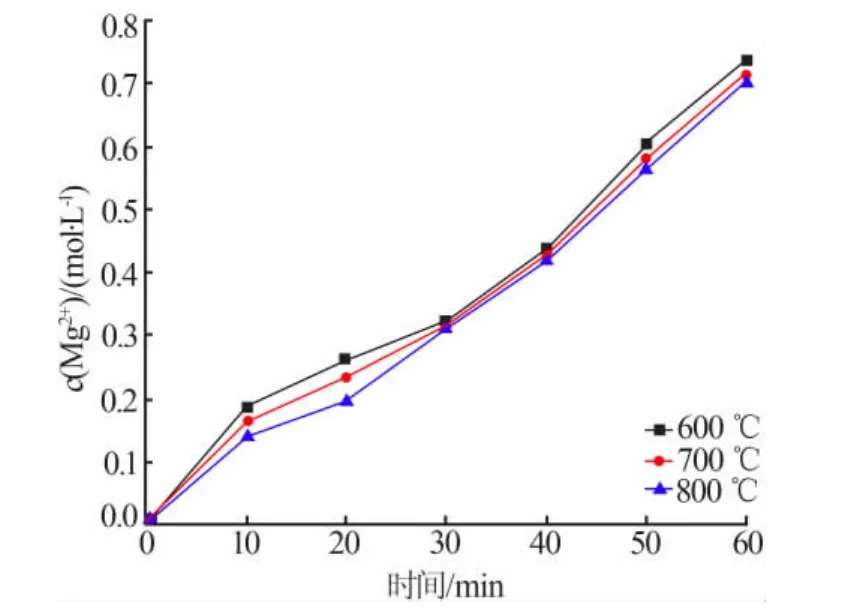
圖7 氧化鎂蒸氨反應速率圖
將氧化鎂和氫氧化鎂按相同的物質的量比和氯化銨做蒸氨反應,再將氧化鎂和氫氧化鎂按照一定物質的量比混合后和氯化銨做蒸氨反應,結果見圖8。由圖8可知,在蒸氨反應0~20 min時,氫氧化鎂的鎂離子浸出速率明顯高于氧化鎂的浸出速率。20~90 min兩者的鎂離子濃度差值逐漸減小,90 min后鎂離子增長速率基本一致。這與氧化鎂蒸氨反應中氧化鎂的水化趨勢相符。

圖8 氧化鎂和氫氧化鎂蒸氨速率圖
綜上所述可以得出,氧化鎂和氯化銨進行反應可分為2個階段:第一階段,其蒸氨速率較氫氧化鎂慢,主要是由于大部分氧化鎂在銨鹽溶液中進行水化反應生成氫氧化鎂[15],同時,溶液中的少量氧化鎂和反應生成的氫氧化鎂同時做蒸氨反應:

當30 min之后,氧化鎂被完全水化成氫氧化鎂,蒸氨反應進入第二階段:整個反應體系變為氫氧化鎂蒸氨體系:
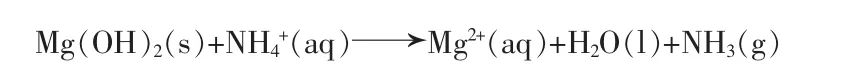
同時,氨氣在水中的溶解度隨溫度的升高降低明顯,范天博等[16]根據實驗數據關聯得到氨氣在水中的溶解度公式:

根據公式可以計算,當蒸氨反應溫度為100℃時,氨氣在水中溶解度<0.5%。即蒸氨反應溫度越高越有利于氧化鎂的水化,同時有利于氨氣的揮發,促使整個蒸氨體系正向進行。
3 結論
1)輕燒粉蒸氨反應中,溫度對鎂離子濃度影響大。當反應2 h時,70~90℃溶液中鎂離子濃度約為0.37 mol/L,100℃時濃度為0.834 mol/L。蒸氨所得濾渣通過XRD分析可知,部分氧化鎂變成氫氧化鎂存在于殘渣中。
2)對不同煅燒溫度制備的氧化鎂進行水化反應動力學分析可知:氧化鎂水化反應符合一級反應動力學;隨著煅燒溫度的升高,氧化鎂水化反應活化能逐漸增加。當煅燒溫度為600℃時,反應活化能為64.7899 kJ/mol;當煅燒溫度為800℃時,反應活化能為81.3506 kJ/mol;水化反應屬于化學反應控速機理。
3)不同煅燒溫度的氧化鎂進行蒸氨反應,在反應前期(0~30 min),溶液中 Mg2+濃度差異較大;蒸氨反應速率隨體系中氫氧化鎂含量的增加而升高。氧化鎂蒸氨體系可分為2個階段:第一階段,大量氧化鎂在銨鹽體系中進行水化反應生成氫氧化鎂,同時部分氧化鎂和氫氧化鎂進行蒸氨反應生成鎂離子;第二階段,整個體系完全變成氫氧化鎂蒸氨體系。

