同種異體脂肪干細胞復合脫鈣骨基質在橈骨臨界骨缺損兔模型中的價值
閆 海, 費燕梅
(江蘇省南通瑞慈醫院, 揚州大學第四臨床醫學院 骨科, 江蘇 南通, 226001)
骨缺損可繼發于創傷、感染等,引起患者關節功能障礙,而骨缺損的修復是臨床上的重點和難點問題[1-3]。傳統的治療方法包括骨移植(自體骨移植或異體骨移植)和非骨性材料移植等,但存在并發癥多、效果不理想等問題。自體骨移植效果尚可,但增加了患者創傷,而異體骨移植供骨有限,且存在免疫排斥反應。脂肪干細胞在一定條件下可分化為成骨細胞,其成骨能力較強,可以作為種子細胞的重要來源[4-7]。
1 資料與方法
1.1 實驗動物和分組
納入18只健康的成年雄性新西蘭大白兔,切取雙上肢橈骨干中段部分骨質,制備雙側上肢橈骨臨界骨缺損模型。將18只兔子隨機分為對照組、實驗組1和實驗組2。3組體質量依次為(3.26±0.23)、(3.22±0.21)和(3.28±0.26) kg, 差異無統計學意義(P>0.05)。實驗動物均由安徽醫科大學實驗動物中心提供。
1.2 模型制作
3%戊巴比妥經耳緣靜脈注射(1 mL/kg), 麻醉后固定于手術臺,無菌條件下雙上肢做約3 cm的縱形切口,分離肌間隙,充分暴露橈骨,剝離骨膜,鋸條切取長25 mm的橈骨形成橈骨缺損模型。術畢由同一飼養員分籠飼養。
1.3 脂肪干細胞提取
取實驗兔腹股溝皮下脂肪組織,充分剪碎后加入0.075%Ⅰ型膠原酶37℃水浴箱震動30 min, 2 600轉/min離心去除上清和漂浮脂肪,加入DMEM生長液,接種于25 cm2的培養瓶中,培養箱內培養, 48 h更換培養液1次。細胞覆蓋90%瓶底時,胰蛋白酶消化、傳代,取第3代脂肪干細胞,貼壁完全后在原DMEM的基礎上,將維生素C、β-甘油磷酸鈉、地塞米松加入,誘導成骨,成骨誘導因子為1 mg/L的骨形態發生蛋白2。見圖1。

1.4 脫鈣骨基質制作
取兔髂骨,剔除軟組織、骨膜和一側骨皮質(一側為松質骨,對側為皮質骨的骨塊),沖洗骨髓和血跡,多次蒸餾水漂洗,晾干, 1∶1氯仿甲醇溶液室溫下浸泡脫脂2次(每6 h 1次),風干, 0.6 mol/L HCl、4 ℃脫鈣, 6 h更換液體1次(50 mL/g), 風干骨塊,檢查脫鈣情況(不堅硬且有彈性),蒸餾水沖洗至中性, 1∶1氯仿甲醇溶液脫脂1次, 37 ℃恒溫箱下干燥后-20 ℃冰箱保存。使用前將其剪成4 mm×4 mm×2 mm的小方塊,體積分數75%的乙醇浸泡30 min, 過夜晾干后紫外線照射30 min, DMEM預濕24 h。
1.5 脂肪干細胞與脫鈣骨基質復合培養
制成脂肪干細胞濃度為4×108個/L的懸液,取預濕支架,無菌紗布吸干, 30 μL均勻接種于脫鈣骨基質的松質鼓面,培養箱中培養,支架周圍加入培養基, 2 d更換1次培養基, 1周后觀察細胞黏附和生長情況。
1.6 DIO熒光標記觀測細胞在材料表面的增殖以及細胞在三維材料上的增殖曲線
將第3代脂肪干細胞(rADSCs)預先用3,3-Dioctadecylox-acarbocyanine-perchlorate(DIO)熒光染料標記,接種于材料上并在誘導培養液中共培養。將無血清LG-DMEM培養液以1∶250的比例稀釋DIO染液(1 mmol/L), 將稀釋后的染液重懸第3代rADSCs, 調整細胞濃度為1×106cells/mL, 混勻后在CO2培養箱中孵育20 min, 1 000轉/min離心10 min, 去上清液,以新鮮生長培養液重懸細胞;調整細胞密度為3×105cells/mL, 接種于脫鈣骨材料表面(同一批次),于細胞培養箱中培養4 h后,加入生長培養液;第2天更換成骨誘導液培養,分別于接種3、7 d后采用熒光顯微鏡與共聚焦顯微鏡觀察細胞在三維支架上的生長情況,見圖2。


圖2 激光共聚焦顯微鏡觀察DIO標記的細胞接種至脫鈣骨支架材料上成骨誘導3、7 d的表現(放大倍數40倍)
將第3代rADSCs以3×105cells/mL密度接種于脫鈣骨材料上(同一批次),培養箱孵育4 h后加入GM, 第2天更換為成骨誘導液。以生長培養液作為對照組。分別于接種1、3、5、7、9、12、15 d后收集材料上的細胞,以Hoechst 33258 DNA定量方法對rADSCs進行細胞計數,對未接種細胞的脫鈣骨材料進行相同的處理,所測值作為空白對照,并從各檢測值中減去。利用測得熒光強度的吸光度(OD)值來反映細胞的生長趨勢,即OD值越大代表細胞生長趨勢越好。見圖3。
1.7 干預方式
對照組未予任何干預,實驗組1在骨缺損部位植入脫鈣骨基質,實驗組2在骨缺損部位植入同種異體脂肪干細胞復合脫鈣骨基質。第8、12周時行X線、病理切片和解剖學檢查,明確骨缺損的修復效果。

1.8 觀察指標
Lane-Sandhu組織學評分標準評分、放射學評價、解剖學形態和兔橈骨標本蘇木精-伊紅染色光鏡下結構。
1.9 統計學分析
采用SPSS 22.0完成數據分析, 3組計量資料比較采用方差分析,兩兩比較采用SNK檢驗。
2 結 果
2.1 實驗動物不良反應和生存情況
對照組1只兔切口部位裂開,縫合后愈合良好,實驗期間無動物意外死亡。18只兔子全部納入結果分析。
2.2 放射學評價
骨缺損修復后, 8、12周時對橈骨行X線檢查,對照組骨缺損修復差; 8周時實驗組1部分修復, 12周時大部分修復,但仍有1只兔子存在小塊骨缺損; 8周時實驗組2大部分修復, 12周時全部修復,實驗組2可見髓腔通暢。見圖4。

2.3 Lane-Sandhu組織學評分評價
8、12周時,實驗組1和實驗組2的Lane-Sandhu組織學評分均高于對照組,實驗組2的Lane-Sandhu組織學評分均高于實驗組1, 差異均有統計學意義(P<0.05)。見表1。
2.4 兔橈骨標本蘇木精-伊紅染色評價
造模12周后對照組骨缺損區多為纖維組織,實驗組1有編織骨形成,但骨小梁紊亂; 實驗組2有板成骨形成,骨小梁排列緊密有序。見圖5。
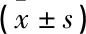
表1 Lane-Sandhu組織學評分評價 分
與對照組比較, *P<0.05; 與實驗組1比較, #P<0.05。
2.5 橈骨缺損的解剖學觀察
12周時對照組、實驗組1均有不同程度的缺損,實驗組2骨形態良好。見圖6。

3 討 論
目前骨缺損修復的手術已經較為成熟,骨的來源成為制約其進一步發展的瓶頸,主要原因是自體骨移植創傷較大,取材受限,尤其是大塊骨缺損,異體骨移植也存在供骨有限的問題,且可能會導致排斥反應。組織工程學的快速發展為突破這一瓶頸提供了基礎。本研究探討同種異體脂肪干細胞聯合脫鈣骨基質對橈骨臨界骨缺損兔模型的價值,結果發現同種異體脂肪干細胞聯合脫鈣骨基質對橈骨臨界骨缺損兔模型具有較好的修復價值,效果比單純使用脫鈣骨基質好。

干細胞是可以自我復制且具備多向分化潛能的原始細胞,是機體形成各種組織中原始細胞。干細胞技術又稱再生醫學,是醫學生物治療中最前沿的技術之一。近年來,脂肪干細胞被發現具有多種分化潛能,如在骨形態發生蛋白的誘導下,脂肪干細胞可以分化為成骨細胞[8-12]。本研究也證實從兔子脂肪細胞中提取的細胞生長能力旺盛,可以分化為成骨細胞,具有干細胞的特性。對于骨缺損患者而言,通過自身的脂肪干細胞構建具有完整生物學結構和功能正常脂肪組織無疑是解決供骨的來源不可回避的問題。脂肪干細胞自被發現以來,就被證實具有向軟骨、成骨、成肌等多向分化潛能[6, 13-18]。本研究通過在兔橈骨骨折部位移植具有向成骨細胞分化傾向的脂肪干細胞,可以促進成骨細胞在骨折部位的大量形成,促進骨折愈合。目前已有學者[19-22]驗證脂肪干細胞用于骨缺損模型的修復,具有促進骨折愈合的過程,支持本研究結果。
本研究將脂肪干細胞和脫鈣骨基質復合,脫鈣骨基質是天然骨移植材料,包括膠原蛋白、非膠原蛋白、生長因子,具有誘導成骨的能力,可以促進新骨形成及骨組織礦化,加速骨愈合,可以單獨或與自體骨、其他生物材料、生長因子聯合有效修復骨損傷,是比較理想的骨組織工程支架材料[23-24], 可以來源于人或動物的股骨干和脛骨干等。本研究將脂肪干細胞和脫鈣骨基質復合,可促進成骨細胞的大量繁殖,在脫鈣骨基質的作用下,成骨細胞的成骨能力可以得到進一步提升,極大地促進了新骨形成及骨組織礦化,加速骨愈合,效果較單純應用脫鈣骨基質好。

