野中野正向調強與固定野逆向調強在全腦放療中的劑量學差異
潘 香, 李 婭, 朱思瑾, 楊 毅
(昆明醫科大學第三附屬醫院, 云南省腫瘤醫院 放射治療科, 云南 昆明, 650118)
20%~40%的腫瘤患者晚期會發生腦轉移,而放射療法是治療腦轉移癌的有效手段,全腦放療仍是控制疾病進展的有效方法之一[1-4]。研究[5]顯示多發性腦轉移癌的基礎治療為全腦放療,全腦放療對減少顱內新病灶的發生有重要意義,能使腦轉移癌患者中位生存期延長3~6個月。目前,臨床常用的手段包括常規二維放療(2D-RT)、三維適形放療(3D-CRT)、調強放療(IMRT)和立體定向放療(SRT)等[6-7]。以往對腦轉移癌的治療研究多集中在靶向治療、手術治療、立體定向放射外科(SRS)治療等方面[8],對于IMRT在全腦放療中的臨床應用卻關注較少。本研究比較野中野正向靜態調強(FIF-IMRT)與固定野逆向優化調強(FFIO-IMRT)在全腦放療中的劑量學指標,評估2種調強治療技術對靶區覆蓋及正常組織保護等效果差異,現報告如下。
1 資料與方法
1.1 一般資料
選取本院2018年10月—2019年6月腦轉移癌行全腦放療的患者20例,其中男12例,女8例; 年齡55~70歲,中位年齡60歲; 肺癌腦轉移10例,乳腺癌腦轉移8例,其他2例。
1.2 體位固定和CT掃描
放療前,所有患者均簽署腫瘤放射治療知情同意書。患者取仰臥位,雙手自然置于體側,根據患者頭大小、頸部長短選擇合適的專用頭枕墊于頭下,面罩熱塑膜固定,激光定位后畫出定位標志線,并在激光線交點處放置鉛點。采用西門子大口徑CT機(Somatom Sensation Open, 直徑82 cm)進行定位掃描,掃描范圍自顱頂至第4頸椎下緣,層厚為3 mm, 圖像數據經網絡傳至Pinnacle39.10 計劃系統。
1.3 靶區及危及器官定義
由同一位醫師在增強CT圖像上逐層勾畫靶區及危及器官。全腦定義為腫瘤臨床靶區(CTV); 計劃靶區(PTV)在CTV基礎上外放3 mm; 危及器官包括晶體、眼球、視神經,脊髓; 處方劑量均為40 Gy, 2 Gy/次,共20次。
1.4 計劃設計
由同一位物理師采用Pinnacle39.10治療計劃系統進行計劃設計, 2種計劃均用美國瓦里安(varian)IX直線加速器的6 MV X射線,等中心均在同一位置。① 野中野正向靜態調強計劃(FIF-IMRT): 選270°、90°為主野,適當調整準直器角度,使雙眼球重疊,在每個主野方向手動添加1~2個小權重的子野來降低高劑量。② 固定野逆向優化調強計劃(FFIO-IMRT): 7野均分(即機架角度為180 °、232 °、283 °、334 °、25 °、77 °、128 °), 通過反復修改優化目標參數來達到臨床要求的劑量分布。
1.5 計劃評估指標
① 靶區的評估指標: 靶區PTV的適形指數(CI)[9-11]。治療體積與計劃靶區體積之比, CI=(Vt, ref/Vt)×(Vt, ref/Vref), 其中Vt, ref為參考等劑量線包繞的靶區體積,Vt為靶區體積,Vref為參考等劑量線所包繞的所有區域體積,參考等劑量線通常取95%的劑量線。CI范圍是0~1, 值越大表示適形度越好。均勻性指數(HI)[12]用于衡量靶區內劑量的均勻程度,均勻性指靶區劑量變化的梯度。HI=(D2%-D98%)/D50%, 其中D2%、D98%、D50%分別表示2%、98%、50%的靶區PTV體積接受的劑量; HI越大表示靶區實際接受的照射劑量超過處方劑量越多,靶區的均勻性越差; HI的值越接近0,表示靶區劑量的均勻性越好。② 危及器官的評估最大劑量(Dmax)。③ 子野個數(ZY)、機器跳數(MU)和照射時間(Time)。
1.6 統計學分析
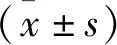
2 結 果
2.1 2種計劃的靶區劑量學比較
2種計劃的劑量體積直方圖(DVH)、等劑量線見圖1、2。對PTV而言, FIF-IMRT和FFI-IMRT計劃都能夠滿足臨床放射治療的要求。2種計劃PTV的V95%、V105%、V110%、D2%、D50%、D98%、CI、HI比較,差異均有統計學意義(P<0.05), 表現為CI在FFIO-IMRT計劃中較好, HI卻是FIF-IMRT略占優勢; FIF-IMRT的V105%、D2%小于FFIO-IMRT計劃,表明FIF-IMRT計劃在控制高量方面具有一定的優勢。見表1。


圖2 FIF-IMRT計劃(1)和FFIO-IMRT(2)的等劑量線對比

表1 2種計劃的靶區劑量學對比
與FIF-IMRT比較, *P<0.05。
2.2 2種計劃的危及器官劑量學比較
2種計劃危及器官的DVH見圖3。對于危及器官而言, FIF-IMRT和FFI-IMRT計劃都能夠滿足臨床的要求,但FIF-IMRT計劃的左、右晶體,左、右眼球,左、右視神經以及脊髓的Dmax均小于FFIO-IMRT計劃,除左、右視神經外,其他差異均有統計學意義(P<0.05)。見表2。


表2 2種計劃的危及器官劑量學對比
與FIF-IMRT比較, *P<0.05。
2.3 2種計劃的機器參數比較
在機器參數方面, FIF-IMRT計劃的子野數、機器跳數、治療時間、計劃設計時間小于、短于FFIO-IMRT計劃,差異均有統計學意義(P<0.05)。見表3。

表3 2種計劃的機器參數對比
與FIF-IMRT比較, *P<0.05。
3 討 論
放療在腦轉移瘤中占有極其重要的地位。理想的放療技術應按照腫瘤形狀給靶區很高的致死劑量,而靶區周圍的正常組織不受到照射[13]。IMRT對于腫瘤靶區有更準確、更均勻、更高的劑量分布,同時對腫瘤周圍的正常組織和鄰近危及器官有較好的保護作用[14]。固定野逆向優化調強(FFIO-IMRT)是由計算機根據預先給予的一系列約束條件進行射線束的優化計算,直至將優化好的射束通量圖轉化成可供加速器多葉光柵直接執行的子野序列,實際上是由很多子野甚至小野拼接而成的復雜方案。野中野正向靜態調強(FIF-IMRT)則是在左右對穿的3D-CRT基礎上進行改良的一種正向調強的方法,先規定照射野情況,再由物理師對各射野手動分配權重,調節劑量參考點等,最后達到劑量學要求。
鄒喜等[15]通過對腦轉移瘤三維適形放療(3D-CRT)和調強放療(IMRT)計劃對比研究發現, IMRT較3D-CRT 有更好的靶區適形性,但靶區異質性也較大; 相對于3D-CRT, IMRT對于危及器官的保護方面未體現出明顯劑量學優勢。本研究結果亦顯示, FFIO-IMRT有更好的靶區適形度,而均勻性方面卻比FIF-IMRT略差,其原因是FIF-IMRT能夠通過手動添加小權重的子野來遮擋靶區內大部分的高量, FFIO-IMRT為保護晶體等會使中間區域的高量增加。陳杰等[16]對14例全腦照射患者分別采用調強放療技術和常規放療技術,對比劑量學差異顯示,常規計劃的皮膚、腦干、視交叉、左右晶體的Dmax、Dmean均顯著優于調強計劃。本研究結果提示, FIF-IMRT計劃的左右晶體、眼球、視神經的Dmax都低于FFIO-IMRT計劃。由于晶體體積較小, FIF-IMRT在犧牲部分靶區的包繞和適形性保護上是很容易實現, FIF-IMRT只需要用多葉光柵擋住眼球和晶體,即可使晶體受量在4 Gy以下,而FFIO-IMRT布野時照射野不可避免地經過眼晶體,設置優化參數時又要兼顧到靶區劑量均勻等,導致眼晶體受量很難降低(最大劑量都在6.8 Gy左右),故FIIF-IMRT在保護危及器官方面體現出了較明顯的優勢。
Bese等[17]的前瞻性隨機對照試驗表明,放療時間的延長會直接降低腫瘤的局部控制率,尤其是對頭頸部腫瘤或非小細胞肺癌、小細胞肺癌、宮頸癌等增殖較快的腫瘤。本研究結果顯示, FIF-IMRT計劃的子野個數、機器跳數、治療時間、計劃設計時間遠遠小于、短于FFIO-IMRT計劃,減少了由器官運動造成的誤差,對機器損耗也更小,顯著提高機器的使用效率。正是由于FIF-IMRT與FFIO-IMRT的正逆向運算方式計劃制定特點,在MU方面體現得尤為明顯。FFIO-IMRT的子野拼接方式能使射束使用效率大大降低,因此,機器需要更多的出束時間來補償低效的射束利用率以達到需要的劑量要求。
研究[18-20]表明海馬中的神經干細胞是神經認知缺陷發病機制的中心,海馬中的神經干細胞對放射線非常敏感,放療中海馬受到的照射劑量大小直接影響神經干細胞增殖數量、凋亡速度,這些認知副作用可以通過照射中對海馬的保護來減少。隨著綜合治療技術的進步和患者生存率的提高,全腦靶區未來可能需要保護特定部位,這時就要用更好的調強放療技術來滿足臨床的需要。
綜上所述,在全腦放療中,野中野正向靜態調強技術能減少全腦高劑量照射的區域,靶區劑量分布均勻度和適形度也可滿足治療要求; 射野方向只有2個,子野數少,治療時間短,至少節省一半的時間; 子野面積大,由器官運動造成的誤差也會減小; MU跳數少,對機器損耗也更小,顯著提高機器的使用效率,在基層醫院也更容易實施。

