以“不變”應“萬變”
王銳勇
摘要:變化觀念與平衡思想是普通高中化學學科核心素養之一,化學平衡在高中化學教學中占有比較重要的地位,是一個具有較強學科特點和應用廣泛的化學反應原理,并且是高考中的熱點和重點。應用變化的觀點以“不變應萬變”分析化學平衡狀態。
關鍵詞:高中化學學科核心素養;化學平衡狀態;判斷
化學平衡狀態的判斷是高中學生學習中頗為頭疼的問題,如何在教學中培養學生用變化的觀點看待化學平衡,解決學生學習中的難題,這就要求我們化繁為簡,以“不變應萬變”來判斷化學平衡狀態。
在一定條件下,當一個可逆反應的正反應速率與逆反應速率相等時,反應物的濃度與生成物的濃度不再改變,達到一種表面靜止的狀態,即“化學平衡狀態”。
從化學平衡狀態的概念出發,化學平衡狀態有兩個判斷依據:一是速率依據,二是濃度依據。怎樣從濃度依據這個“不變”應“萬變”來判斷化學平衡狀態?
濃度依據可以引申為反應體系中反應物和生成物的(總)物質的量、質量、氣體的(總)體積、氣體的(總)壓強、氣體的密度、混合氣體的平均相對分子質量以及這些相關物理量的百分數,還有體系的溫度和顏色,這些物理量什么情況下保持不變可以用來判斷化學平衡狀態?
一、反應體系體積恒定,以化學反應mA(g)+nB(g)?pC(g) +qD(g)為例:
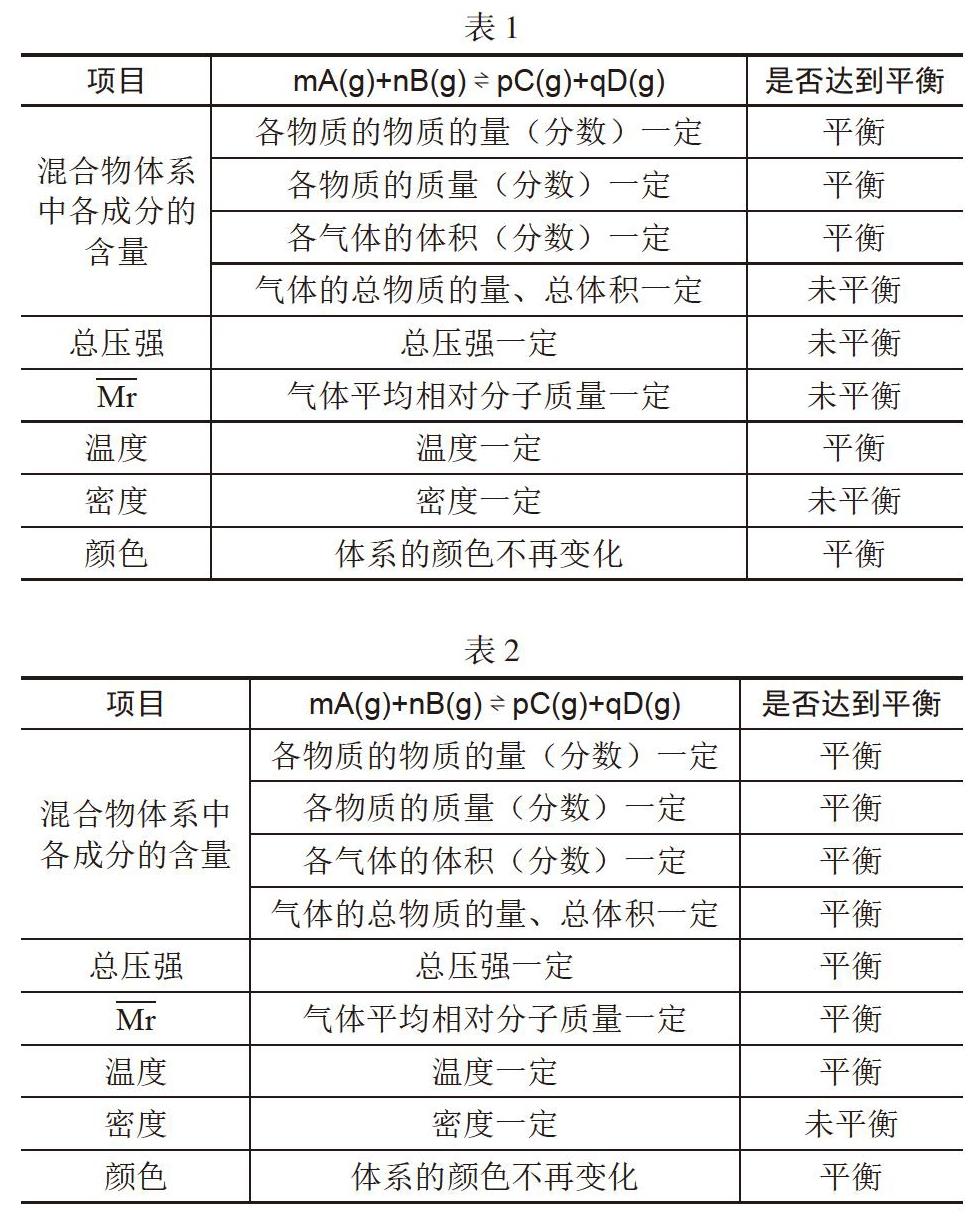
Ⅰ、m+n=p+q,
這類化學反應的特點是反應物均為氣體,反應前后氣體的物質的量之和相等。(見表1)
此類反應中各物質的狀態均為氣體是判斷平衡狀態的關鍵,而氣體的總體積、總壓強、氣體平均相對分子質量都與氣體的物質的量有關,由于反應前后氣體的物質的量之和相等,所以這些物理量均不能用來判斷平衡狀態。
Ⅱ、m+n≠p+q
這類化學反應的特點是反應物均為氣體,反應前后氣體的物質的量之和不相等。(見表2)
此類反應中各物質的狀態均為氣體而且反應前后氣體的物質的量之和不相等,因此氣體的總體積、總壓強、氣體平均相對分子質量這些物理量在未達到化學平衡狀態時是變化的,所以當這些物理量不變是即能用來判斷平衡狀態。
二、反應體系體積恒定,以化學反應mA(s)+ nB(g)? pC(g)+ q D(g)為例:
Ⅰ、n=p+q
這類化學反應的特點是反應物中有一種為固體,其它均為氣體,反應前后氣體的物質的量之和相等。
當體系中各物質的物質的量(分數)、各物質的質量(分數)、各氣體的體積(分數)、溫度等物理量一定及體系的顏色不再變化均可以判斷可逆反應達到化學平衡狀態;
而此類反應的特殊性在于某種物質為固體,其它物質的狀態均為氣體而且反應前后氣體的物質的量之和相等,因此氣體的總體積、總壓強與氣體的物質的量有關的物理量在未達到化學平衡狀態時也是不變的,所以這兩個物理量不能用來判斷平衡狀態;由于體系的體積恒定且反應前后氣體的物質的量之和相等,而決定氣體平均相對分子質量和密度的變量均為氣體的質量,由于未達到平衡時氣體的質量是變化的,所以當這兩個物理量不變即可判斷為平衡狀態。
Ⅱ、n≠p+q
這類化學反應的特點是反應物中有一種為固體,其它均為氣體,反應前后氣體的物質的量之和不相等。
和前一種情況一樣的是當體系中各物質的物質的量(分數)、各物質的質量(分數)、各氣體的體積(分數)、溫度、密度等物理量一定及體系的顏色不再變化均可以判斷可逆反應達到化學平衡狀態;
但是和前一種情況不同的是反應前后氣體的物質的量之和不相等,與氣體的物質的量有關的氣體的總體積和總壓強的這兩個物理量在未達到化學平衡狀態時是變化的,所以這兩個物理量可以用來判斷平衡狀態;在這種情況下決定氣體平均相對分子質量的變量為氣體的質量和氣體的物質的量,在反應未達到平衡時都是變化的,因此當這個物理量不變時也能用來判斷平衡狀態。
綜上所述可以得出以下結論:各物質的物質的量(分數)、各物質的質量(分數)、各氣體的體積(分數)、溫度等物理量不變不管什么情況下都可以判斷化學平衡狀態,而氣體的總物質的量、總體積、總壓強及氣體平均相對分子質量要用于判斷化學平衡狀態則要考慮化學反應的前提條件。
在高中化學教學中,教會學生以變化的觀點分析每一個化學反應,根據變化的條件判斷可逆反應是否達到平衡狀態,特別是用濃度這個依據,讓學生理解“以不變應萬變”的內涵。
參考文獻:
[1]楊文彬主編《資源庫》,外語教學與研究出版社
[2]王祖浩主編《化學必修一》,江蘇鳳凰教育出版社

