基于Ksp的計算解疑及教學處理
河北
沉淀作為一種溶解現象是學生在義務教育階段建立的一個化學基本概念,它生動直觀,能體現化學變化,彰顯學科特色,給學生留下了深刻的印象。高中人教版《必修1》中,又以離子反應的角度,結合微粒觀和電性觀重申“生成沉淀”的意義和作用。《選修4》中,將難溶電解質重新定位,從變化觀念與平衡思想出發,研究它在水中的“變化”,糾正了學生的一些認識偏差,如“沉淀是靜止不變的”、“沉淀不溶于水”等等,特別是Ksp的出現,增強了理論內涵。但是,Ksp這一內容在教材中過于后置,師生習慣將其局限在含義的理解、判斷及簡單計算,很少開發它作為一種常數,將它具有的工具功能整合融入到先期學習內容中,提高問題分析的維度。
為此,教師有必要專門針對一些真實的任務情景,通過分析、求證及數據處理,增強學生對Ksp的應用意識,凸顯其概念的定性分析、定量分析及證據推理作用,進而強化學生對化學反應原理應用模型建構過程的理解。
一、為什么常用調節溶液pH法除去雜質離子Fe3+、Al3+?
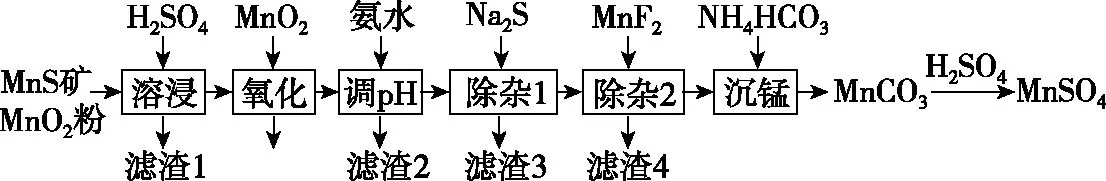
【例1】(2019·全國卷Ⅲ·26節選)高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝如圖所示。回答下列問題:
相關金屬離子[c0(Mn+)=0.1 mol·L-1]形成氫氧化物沉淀的pH范圍如下:
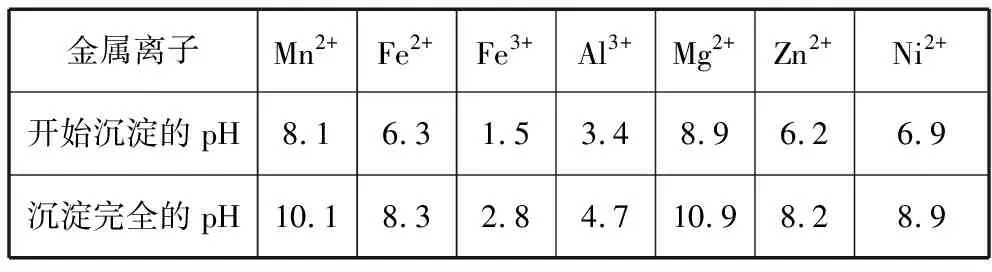
金屬離子Mn2+Fe2+Fe3+Al3+Mg2+Zn2+Ni2+開始沉淀的pH8.16.31.53.48.96.26.9沉淀完全的pH10.18.32.84.710.98.28.9
(2)“氧化”中添加適量的MnO2的作用是___________________。
(3)“調pH”除鐵和鋁,溶液的pH范圍應調節為________~6之間。
(4)“除雜1”的目的是除去Zn2+和Ni2+,“濾渣3”的主要成分是________。
【答案】(2)將Fe2+氧化為Fe3+
(3)4.7
(4)NiS和ZnS
本例題以高純硫酸錳的制備工藝為背景,考查了調節溶液pH法、沉淀法除去雜質離子的化學原理。筆者針對本例題向準高三學生進行問卷調查,其中認為“表格中形成氫氧化物沉淀的pH可由Ksp計算得到”的占24%,“除去Fe2+需將其氧化為Fe3+再調節溶液pH”的占25%,“本例題中除去Zn2+和Ni2+不宜采用調節溶液pH法”的占27%……結果表明學生習慣敘述性知識的記憶,缺乏對化學原理的深層理解,處于面對新問題不會應用的窘境。
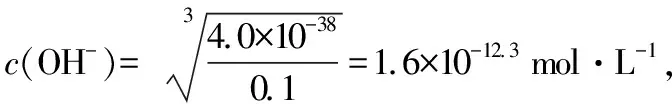
因為Zn2+和Ni2+完全形成氫氧化物沉淀時溶液的pH分別為8.2和8.9,需保留的Mn2+也開始沉淀,因而不能實現有效地分離。由于多數金屬硫化物是最難溶的物質,工業上常使用H2S或Na2S沉淀金屬離子。當使用Na2S沉淀Zn2+和Ni2+時是否會產生MnS的共沉淀,如何控制?當學生提出了這樣的問題時,可以說明他們基于Ksp的應用能力已經有了較大的進步。
二、MnS可溶于鹽酸,但為什么CuS不溶于鹽酸呢?
【例2】(2016·天津卷·3改編)“在同濃度的鹽酸中,MnS可溶而CuS不溶,說明CuS的溶解度比MnS的小”是否正確?
【答案】正確。

上述推理過程,重視理論計算,凸顯了多重平衡規則及應用,有利于提升學生的化學反應原理的分析水平。相反,若教學時僅靠定性陳述和結論,講不通時干脆讓學生死記硬背,缺少必要的推理思維和數據分析,遷移應用能力的形成以及可持續發展就無從談起。


三、食鹽精制過程中,需要幾次過濾?
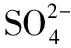
【例3】實驗室常用MnO2與濃鹽酸反應制備Cl2。制備反應會因鹽酸濃度下降而停止。為測定反應殘余液中鹽酸的濃度,探究小組同學提出下列實驗方案:與已知量CaCO3(過量)反應,稱量剩余固體的質量。判斷該方案的實驗結果__________(填“偏大”“偏小”或“準確”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
【答案】偏小

四、教材附錄“部分酸、堿和鹽的溶解性表(室溫)”中Fe2+與為何是“不”而非“—”呢?
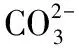

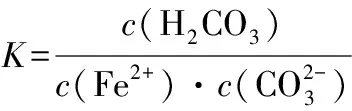

【例4】(2019·全國卷Ⅲ·26節選)(題干見例1)寫出“沉錳”的離子方程式:____________________。
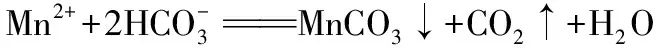
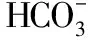
五、Mg(OH)2不溶于水,但為什么使酚酞變色?
在義務教育階段學生形成了Mg(OH)2不溶于水的事實性認知,基于此,在高中人教版《必修1》食鹽精制實驗時,雜質離子Mg2+就是加入NaOH使其完全形成Mg(OH)2沉淀而分離出去的。在《必修2》探究元素金屬性時,將鎂帶加入到滴入酚酞的水中,加熱至水沸騰,發現鎂帶上有大量氣泡、溶液變淺紅色。很多學生心生疑竇:明明Mg(OH)2不溶于水,但為什么它又能使酚酞變紅呢?

【例5】室溫下,Fe(OH)3懸濁液的pH約為________(已知:室溫時,Fe(OH)3的Ksp為4.0×10-38、Kw=1×10-14)。
【答案】7
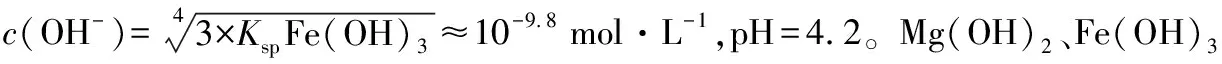
六、使用AgNO3標準溶液滴定溶液中的Cl-時,為什么可用K2CrO4作指示劑?
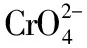
【答案】2.0×10-55.0×10-3
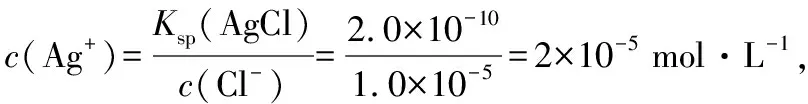
本例題以沉淀滴定為主題,考查共沉淀平衡體系中的離子濃度基于Ksp的簡單計算,表面看似是一種數字游戲,實則不然,計算的背后隱含著沉淀滴定原理和指示劑的選擇要求。教學時教師可搭建問題支架,誘思探究:待測離子和指示劑離子是同時形成沉淀嗎?指示劑是否需要限量?能否使用KI、KBr作指示劑?
若使用KI作指示劑時,由于AgI與AgCl結構相似,且AgI的Ksp遠遠小于AgCl的Ksp,在相同的濃度條件下進行滴定,被測離子和指示劑離子沉淀先后順序錯位而使滴定失敗。至此,沉淀滴定原理在上述分析的過程中就體現完全了。
綜上案例分析,Ksp是反映難溶電解質在水中的溶解能力的重要標尺,它在判斷難溶電解質的溶解平衡的移動方向,深化理解沉淀的形成、溶解與轉化等方面具有廣泛的應用價值。但由于課本的設置和學生的思維,當前的教學現狀是先具體物質性質,后Ksp概念及相關理論,呈現明顯的脫節和割裂。因此,強化Ksp概念與相關化合物性質之間的內在聯系,彌補高一階段被動接受定性結論的教學缺陷,構建難溶電解質的離子反應系統觀是高三復習教學的必然要求。第一,師生樹立一種“Ksp是難溶電解質溶解性的定量表達”的基本觀念。Ksp的應用是用數據說話,是證據推理,有化晦澀為淺顯、化復雜為簡單的教學效果。第二,創設情景,強化運用,整合教學。如復習“復分解反應的條件”時,教師可引導學生思考為什么離子之間生成沉淀就能發生反應呢?這與沉淀的Ksp有關系嗎?學生在老師的啟發下計算離子反應的平衡常數,發現沉淀反應的K是沉淀的Ksp的倒數,由于沉淀的Ksp很小,所以K就很大,離子反應就容易發生,學生們就會恍然大悟,原來早已熟知的結論可以這樣理解,在應用中感受了理論的魅力。第三,學會建構運用Ksp計算推理的思維模型。Ksp的數學表達式是出發點,里面包含著溶解平衡中各離子濃度之間的數量關系,涉及難溶電解質的化學反應,它自發進行的方向和限度可用平衡常數來描述,平衡常數中“埋伏”著難溶電解質的Ksp等常數,遂使問題得以定量分析。第四,加強總結歸納。如:注意不同沉淀的陰陽離子個數比,把握沉淀的先后順序或轉化方向,掌握計算復雜離子反應平衡常數時的“整體代換”技巧,區分完全沉淀和開始沉淀等。
涉及難溶性電解質的問題很多,Ksp的介入和計算推理是分析和解決它們的一個途徑,但并非每個問題都需要Ksp的“較真”,具體問題具體分析才是王道。

