巖藻黃素對H2O2誘導BNL CL.2細胞氧化損傷保護作用研究?
齊 佳, 崔艷君, 王廣策, 唐 娜, 成 敏, 孫恒一, 綦慧敏??, 劉順梅??
(1. 濰坊醫學院,山東 濰坊 261053; 2. 中國科學院海洋研究所,山東 青島 266071)
肝臟疾病的發生與氧化應激具有密切的相關性。ROS(活性氧)是細胞正常代謝活動的產物,主要在線粒體中產生。肝臟細胞內含有豐富的線粒體,代謝活動活躍,更易產生ROS。持續和過量的ROS能引起細胞損傷,會導致肝細胞凋亡[1]及肝纖維化、肝硬化和終末期肝細胞癌的發生。氧化應激也會導致其它疾病及癌癥的發生。
巖藻黃素,英文名為fucoxanthin(FUCO),是存在于褐藻和硅藻等藻類中的色素成分,具有抗癌[2-3]、減肥和降血糖[4-5]等多種生物活性。已有研究表明,類胡蘿卜素能夠作為外源性抗氧化劑重構細胞的氧化應激水平,中和過量的ROS,使細胞和組織免于過量ROS的損傷[6]。作為類胡蘿卜素家族的一員,FUCO已被發現具有較強的抗氧化能力。它能清除1, 1-二苯基-2-苦基苯肼(DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)和超氧自由基,對單態氧具有淬滅活性[7]。FUCO還能減輕H2O2引起的猴腎成纖維細胞的DNA的損傷,抑制細胞凋亡,提高細胞的存活率[8]。
H2O2是一種強氧化劑,是ROS的重要成員之一,易穿透細胞膜,導致DNA損傷和蛋白質的破壞,常被用來建立氧化損傷細胞模型。鑒于肝病發生與氧化應激的密切關系及FUCO具有較強的抗氧化活性,本文利用H2O2誘導小鼠BNL CL.2肝細胞建立氧化損傷細胞模型探討FUCO對細胞的保護作用,以期為FUCO藥用活性研究及肝病治療新藥物的研發提供理論依據。
1 材料
1.1 儀器與試劑
儀器:多功能酶標儀(Molecular devices,SpectraMax M5美國);CO2細胞培養箱(Thermo,311,美國);離心機(Thermo,Labofuge300,美國);超聲波細胞破碎儀(寧波新芝,JY92-ⅡN)。
試劑:巖藻黃素(Sigma);微量還原型谷胱甘肽(GSH)檢測試劑盒(南京建成生物工程研究所);MTT檢測試劑盒、乳酸脫氫酶(LDH)檢測試劑盒、活性氧(ROS)檢測試劑盒及BCA蛋白濃度測定試劑盒(碧云天生物技術研究所);DMEM高糖培養基(索萊寶);胎牛血清(四季青)。
1.2 細胞株
小鼠胚胎肝細胞BNL CL.2:上海酶研生物科技有限公司。
2 方法
2.1 細胞培養
BNL CL.2細胞用含10%胎牛血清和1%青霉素和鏈霉素的DMEM高糖培養基于37 ℃、5% CO2細胞培養箱中培養。
2.2 BNL CL.2細胞氧化損傷模型的建立[9]
以H2O2誘導建立BNL CL.2細胞氧化損傷模型。實驗設空白對照組和H2O2處理組,H2O2組設100、200、400、 600、 800、1 000、 1 200和1 600 μmol/L共8個濃度。每組設3個平行孔。
濃度為1×105個/mL的細胞懸液按100 μL/孔接種于96孔細胞培養板中培養。24 h后,空白對照組換為無血清培養液,H2O2組分別換為含不同濃度H2O2的無血清培養液,各組繼續放置于細胞培養箱中培養24 h后, PBS清洗細胞,按照MTT試劑盒說明書檢測各組的細胞活力,根據細胞活力篩選建立氧化損傷模型的最適H2O2濃度。
2.3 細胞活力測定
實驗設空白對照組(Con)、陽性對照組(VE:維生素E,50 μmol/L VE+ 1 000 μmol/L H2O2)、H2O2模型組(Mod,1 000 μmol/L H2O2)和FUCO組。FUCO組設1、5、10、20 μmol/L 4個濃度,分別用 F1(1 μmol/L FUCO+1 000 μmol/L H2O2)、F5(5 μmol/L FUCO+1 000 μmol/L H2O2)、F10(10 μmol/L FUCO+1 000 μmol/L H2O2)和F20(20 μmol/L FUCO+ 1 000 μmol/L H2O2)表示。每組3個平行孔。
1×105個/mL細胞懸液每孔100 μL接種于96孔細胞培養板中培養24 h后,空白對照組和H2O2模型組換為無血清培養液,VE組換為含50 μmol/L VE的無血清培養液,FUCO組換為含不同濃度FUCO的無血清培養液。上述各組在培養2 h后,除空白對照組外,其余組全部加入終濃度為1 000 μmol/L的H2O2置于細胞培養箱中繼續培養24 h。24 h后用MTT法測量各組細胞的活力。
2.4 細胞乳酸脫氫酶釋放量測定
實驗分組:設空白對照組(Con)、最大酶活性組(Max)、陽性對照組(VE)、H2O2模型組(Mod)和FUCO組(F1、F5、F10、F20)。VE組、Mod組及F1、F5、F10、F20組藥物濃度同2.3。每組設3個平行孔。
濃度為1×105個/mL的細胞懸液按照200 μL/孔 接種于48孔細胞培養板中培養。24 h后,棄掉培養液,PBS清洗一次。Con、Max和Mod組換為無血清培養液,VE組換為含50 μmol/L VE的無血清培養液,F1、F5、F10及F20組換為含相應濃度FUCO的無血清培養液。藥物與細胞預孵育2 h后,除Con和Max組外,其余組全部加入終濃度為1 000 μmol/L 的H2O2。繼續培養24 h后,Max組加入10 μL LDH釋放試劑后繼續于培養箱中培養。1 h后,分別取各孔的細胞培養液于離心管中,400g離心5 min,各取120 μL上清加入96孔培養板中,增設只加藥物的空白背景孔。各孔分別加入60 μL LDH工作液,混勻后于25 ℃避光烘箱孵育30 min。酶標儀490 nm處測定各組吸光度,計算乳酸脫氫酶釋放率。計算公式為:LDH釋放率(%)=(處理樣品吸光度-樣品對照孔吸光度)/(細胞最大酶活性的吸光度-樣品對照孔吸光度)×100%。
2.5 細胞內還原型谷胱甘肽含量測定
實驗分組及各組細胞處理方法同2.3。細胞懸液接種在6孔細胞培養板中培養,重復3次。
細胞處理結束后,胰酶消化細胞制成細胞懸液,PBS清洗細胞,用超聲波細胞破碎儀破碎細胞后取一定量細胞懸液用BCA法測定蛋白濃度。取勻漿上清液100 μL,加入試劑一100 μL混勻后于3 500 g/min離心10 min,取上清液待測。根據試劑盒說明書,按照表1進行反應體系的操作。將反應物混勻后,靜置5 min,在酶標儀405 nm波長下測量各組吸光度,計算GSH含量。計算公式:GSH含量=[(測定孔-空白孔)/(標準孔-空白孔)]×標準管濃度(20 μmol/L)×2÷蛋白濃度。
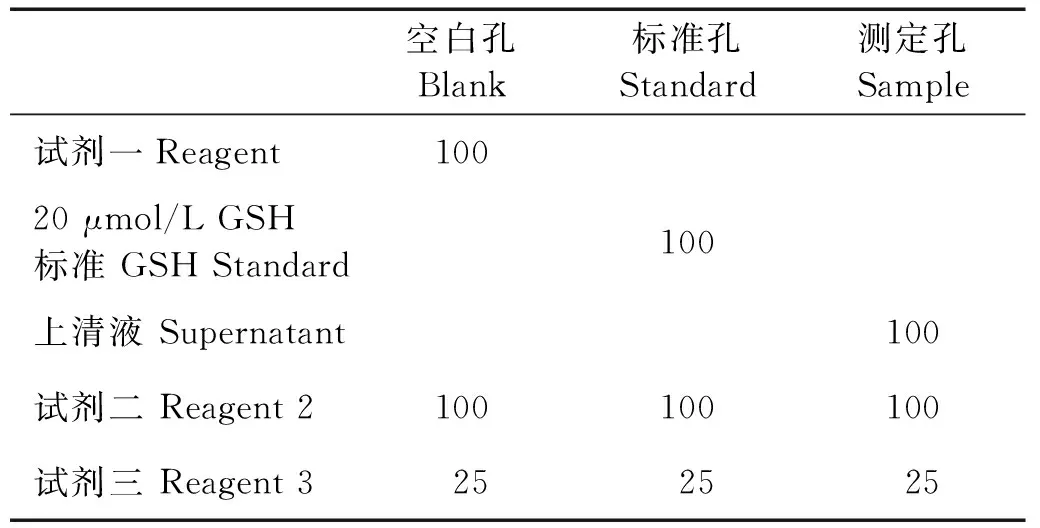
表1 GSH檢測反應體系Table 1 The reaction system for GSH test /μL
2.6 細胞內活性氧含量測定
實驗分組同2.3,每組3個平行孔。
1×106個/mL的細胞懸液接種于48孔細胞培養板中,每孔200 μL。24 h后,Con和Mod組換為無血清培養液,VE組及F1、F5、F10和F20組分別換為含相應藥物及濃度的無血清培養液。細胞于培養箱中繼續培養24 h后,除Con外,其余各組均加入終濃度為1 000 μmol/L的H2O2處理30 min。DCFH-DA(2′,7′-二氯熒光黃雙乙酸鹽)用無血清培養液稀釋使其終濃度為10 μmol/L。細胞經H2O2處理后先去除各孔內的培養液,再加入適當體積上述DCFH-DA培養液,放于培養箱內孵育20 min后用PBS清洗3次,5 min/次,充分去除未進入細胞內的DCFH-DA。使用熒光酶標儀在488 nm激發波長,525 nm發射波長下測量各孔吸光度。
2.7 統計學方法

3 結果與討論
3.1 BNL CL.2細胞氧化損傷模型的建立
不同濃度H2O2處理BNL CL.2細胞24 h后,各組細胞活力見圖1。空白對照組細胞活力設為100%。與對照組相比,100、200、400、 600、 800、1 000、 1 200、1 600 μmol/L H2O2組細胞活力分別下降至(88.90±8.54)%、 (85.67±10.90)%、(83.67±12.64)%、(79.75±13.61)%、(75.60±14.90)%、(65.76±18.19)%、(64.67±15.59)%和(58.21±12.81)%。細胞活力隨著H2O2濃度的增加而下降,且逐漸出現細胞觸角消失、形態變圓、細胞結構不清等現象。
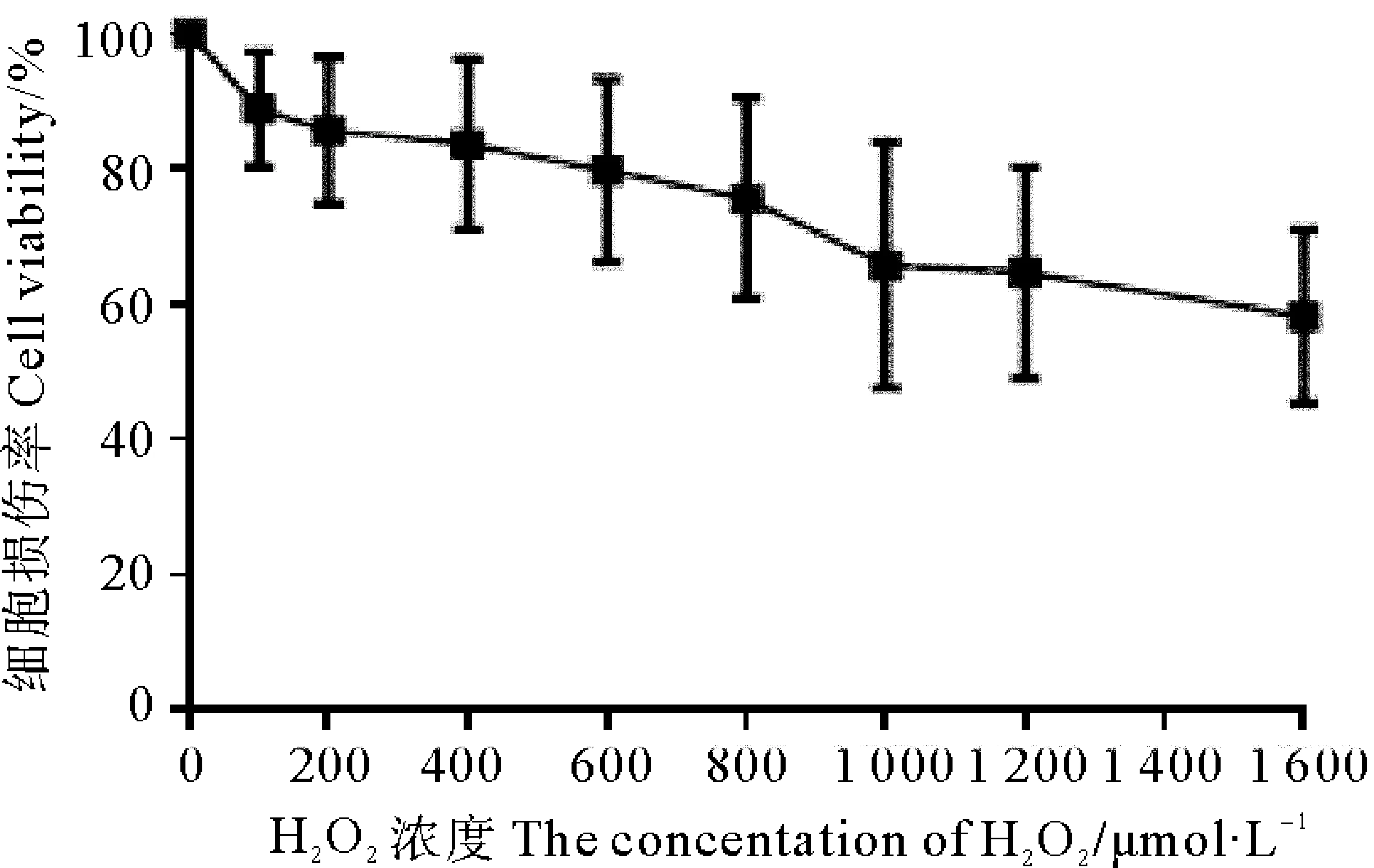
圖1 建立氧化損傷細胞模型H2O2作用濃度篩選 (n=3 )Fig.1 Screening of H2O2 concentration for the establishment of oxidatively damaged cell model (n=3 )
由于H2O2濃度過大,會導致細胞大量凋亡甚至死亡,因此,我們選擇細胞存活率在(65.76±18.19)%之間的1 000 μmol/L H2O2作用24 h來建立氧化損傷模型進行后續研究。該作用濃度與liu等[9]用來誘導BNL CL.2氧化損傷所用的H2O2濃度相同。
3.2 FUCO提高H2O2誘導氧化損傷細胞的活力
實驗結果見圖2。Con組細胞活力設為100%,Mod組的細胞活力下降至(65.76±18.19)% (vs Con,P< 0.01)。而藥物與細胞共培養2 h后經H2O2處理24 h,VE組細胞活力上升至(88.47±10.61)% (vs Mod,P<0.05)。F1、F5及F10組細胞活力均比Mod組增加,但三者與Mod組相比無明顯差異(P> 0.05),F20組的細胞活力明顯高于Mod組(P< 0.05),為(91.54±10.45)%。
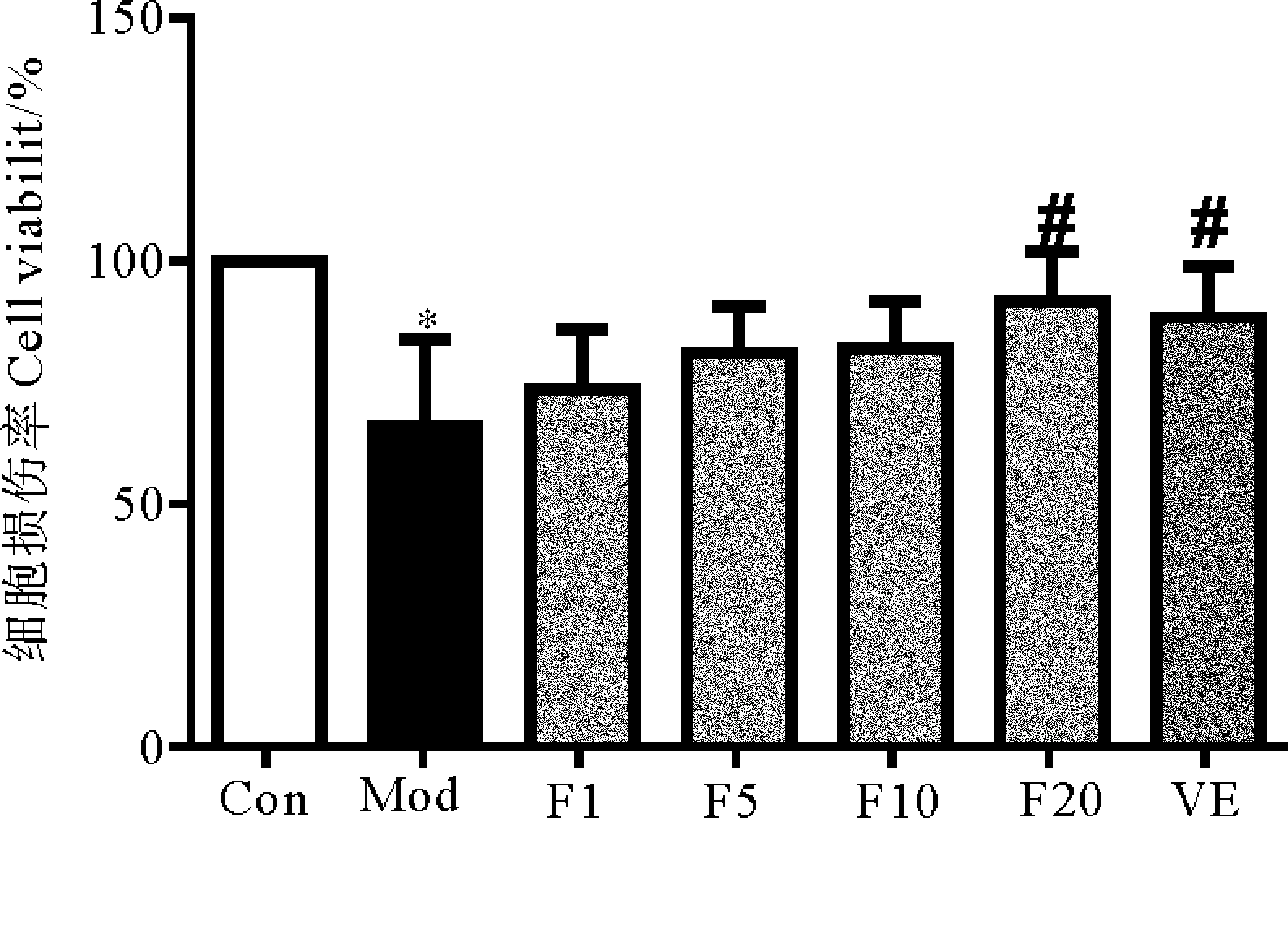
(*: 與空白對照組相比, P<0.05;#: 與模型組相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白對照組Control group;Mod:1 000 μmol/L H2O2 模型組1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2; F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE: 50 μmol/L VE+ 1 000 μmol/L H2O2。)
H2O2可誘發細胞損傷和凋亡,可使細胞活力下降。本實驗研究發現,1~20 μmol/L的FUCO與細胞預孵育2 h可減輕H2O2對細胞造成的氧化損傷,FUCO組的細胞活力均高于H2O2處理組。這與Heo等[8]的實驗結果相似。Heo等用H2O2處理猴腎成纖維細胞,發現5~200 μmol/L的FUCO均可顯著提高H2O2損傷細胞的活力。
3.3 FUCO降低H2O2誘導氧化損傷細胞的乳酸脫氫酶釋放量
將最大酶活性組LDH釋放率設為100%,各組細胞的LDH釋放率見圖3。Con組LDH釋放率為(25.94±5.01)%,Mod組增至(66.66±5.19)%,比Con組明顯提高(P< 0.05)。但藥物與細胞預孵育2 h后再經H2O2處理,VE組和4個FUCO組的LDH釋放率均比Mod組明顯降低(P< 0.05),其中5 μmol/L FUCO組釋放率最低,為(28.48±5.86)%, 對細胞的保護作用優于50 μmol/L 的VE(35.27%±4.96%)。
LDH是活細胞漿內酶,當細胞損傷、細胞膜通透性發生改變時,胞內的LDH會透過細胞膜釋放到細胞外,LDH檢測可作為評價細胞膜破壞程度的重要指標[10]。過量ROS可引起細胞膜脂質、蛋白質等生物分子的破壞,細胞內的LDH就會釋放出來。本研究發現1~20 μmol/L的FUCO能顯著降低模型細胞LDH的釋放水平(P<0.05),表明FUCO可以抵御H2O2對細胞膜的破環作用,保護細胞膜的完整性,減輕H2O2引起的細胞毒性。

(*: 與空白對照組相比, P<0.05;#: 與模型組相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白對照組Control group;Mod:1 000 μmol/L H2O2 模型組1 000 μmol/L H2O2Modle group; F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE:50 μmol/L VE+1 000 μmol/L H2O2。)
3.4 FUCO提高H2O2誘導氧化損傷細胞的還原型谷胱甘肽含量
圖4所示為各組細胞內還原型谷胱甘肽的含量。Con組細胞的GSH設為100%。從圖中可以看出,與Con組相比, Mod組細胞內的GSH含量明顯降低(P<0.05),下降至(72.55±5.00)%。VE和1~20 μmol/L的FUCO均可使細胞內的GSH含量顯著增加(P< 0.01),且FUCO的作用呈現劑量-效應關系,20 μmol/L組GSH含量最高。
GSH是機體最重要的內源性抗氧化劑之一。H2O2刺激細胞后,細胞內的GSH可被H2O2氧化生成 氧化型谷胱甘肽GSSG,從而減少了脂質過氧化物的形成,可使細胞和機體抵御氧化應激的發生和發展。本實驗發現1~20 μmol/L的FUCO可使H2O2誘導損傷的細胞內GSH含量顯著增加。Ha等[11]的小鼠實驗也發現FUCO能通過誘導小鼠體內超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶(GSH-Px)等抗氧化酶的高表達減輕高脂飼料引起的氧化應激。上述結果表明FUCO有可能通過促進細胞和機體的抗氧化酶表達發揮其抗氧化作用。
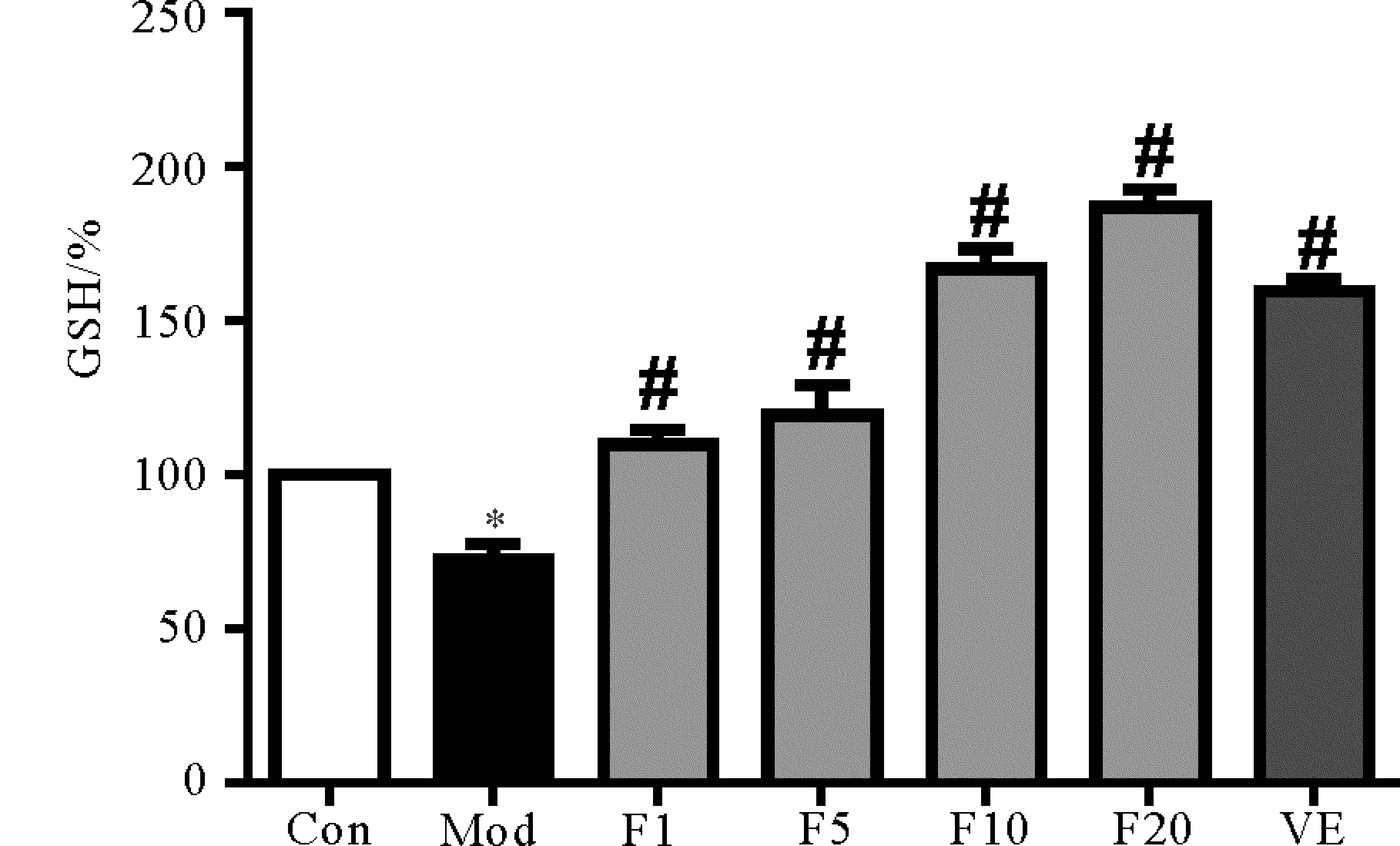
(*: 與空白對照組相比, P<0.05;#: 與模型組相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白對照組Control group;Mod:1 000 μmol/L H2O2 模型組1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE:50 μmol/L VE+ 1 000 μmol/L H2O2。)
3.5 FUCO降低H2O2誘導氧化損傷細胞的活性氧
DCFH-DA是檢測細胞內ROS常用的探針,是一種非熒光性化合物,在細胞內可被ROS催化產生能發熒光的DCF,從而可反映細胞內 ROS 的含量[12]。本實驗用此方法檢測細胞內ROS的結果如圖5所示。Con組細胞內ROS為84.95±8.78,Mod組的ROS與對照組相比明顯增高(P< 0.05),為130.44 ±4.22。藥物與細胞預孵育24 h再經H2O2處理30 min,50 μmol/L VE與1、5及10 μmol/L的FUCO 均可顯著抑制H2O2引發的細胞內ROS升高(vs Mod,P< 0.05),20 μmol/L的FUCO雖然沒能明顯降低ROS含量(P> 0.05),但也表現出了良好的清除ROS活性,20 μmol/L FUCO組細胞的ROS含量低于H2O2模型組。
LDH檢測結果發現1~20 μmol/L FUCO可顯著降低細胞LDH的釋放,但20 μmol/L FUCO對LDH的抑制作用較1、5及10 μmol/L FUCO稍弱。這個結果可能與20 μmol/L FUCO對ROS的清除能力低于1~10 μmol/L FUCO有關。20 μmol/L FUCO對ROS的清除能力差,細胞內存在的ROS就多,對細胞膜的破壞能力強,因此細胞內LDH的釋放就會增多。
盡管20 μmol/L FUCO對ROS的清除能力較差,但20 μmol/L FUCO組細胞內的GSH含量卻較1、5、10 μmol/L FUCO組要高。細胞內的高GSH含量可能與20 μmol/L FUCO組細胞的活力最高有一定關系。
綜合考慮上述實驗結果,FUCO有可能通過多種復雜的調控機制保護細胞免于H2O2造成的氧化損傷,而不是通過單一或簡單的方式應對氧化應激,具體作用機制還有待進一步的研究和探討。
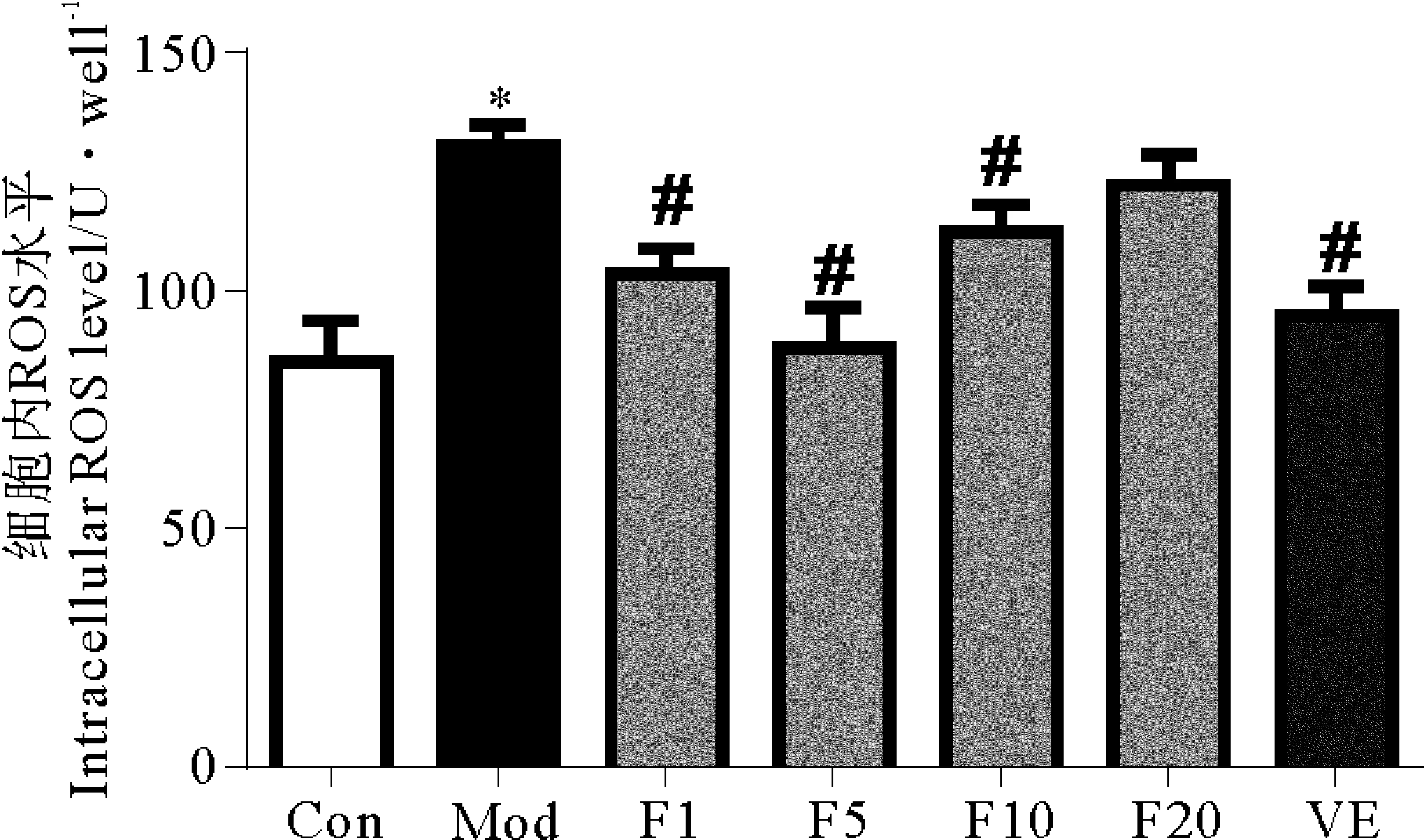
(*: 與空白對照組相比, P<0.05;#: 與模型組相比, P<0.05。*: P<0.05, vs Con;#: P<0.05, vs Mod. Con: 空白對照組Control group;Mod:1 000 μmol/L H2O2 模型組1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2;VE:50 μmol/L VE+1 000 μmol/L H2O2。)
4 結語
本研究發現1~20 μmol/L 的FUCO能夠清除H2O2誘發的胞內ROS,提高細胞GSH含量,降低細胞LDH釋放率,提高細胞活力,具有良好的抗氧化作用。
抗氧化劑發揮抗氧化的作用主要通過2種方式:一是通過直接清除活性氧類物質發揮作用,二是通過誘導抗氧化酶的表達間接發揮作用。綜合考慮本文及他人的研究結果,推測FUCO主要是通過直接清除ROS和誘導抗氧化酶的表達2種方式,通過多條調控路徑來實現其抗氧化作用。

