基于增強CT影像組學模型鑒別腎透明細胞癌與非透明細胞癌
王 平,裴 旭,殷小平,任嘉梁,郭建黨,趙珍珍,趙瑩佳
[1.河北大學附屬醫院CT-MRI室,河北 保定 071000;2.河北大學(醫學院),河北 保定 071000;3.河北省腫瘤放化療機制與研究重點實驗室,河北 保定 071000;4.通用電氣藥業(上海)有限公司,上海 210000]
腎細胞癌(renal cell carcinoma, RCC)占成人惡性腫瘤的2%~3%,致死率較高[1],其病理分型包括腎透明細胞癌(clear cell RCC, ccRCC)和非透明細胞癌(non-clear cell RCC, non-ccRCC),后者又分為嫌色細胞癌(chromophobe renal cell carcinoma, chRCC)、乳頭狀細胞癌(papillary renal cell carcinoma, pRCC)、集合管癌(collecting duct carcinoma, CDC)及未分類癌。RCC的亞型[2-3]及病理分期[4]均會影響臨床治療及預后。腎穿刺活檢是診斷RCC亞型的金標準,但穿刺可能導致癌細胞轉移、腫瘤出血等并發癥,且存在抽樣誤差,故對于RCC活檢一直存在爭議[5-6]。盡管影像學上ccRCC與non-ccRCC表現出不同的強化方式,但臨床誤判率仍較高[7]。聯合應用不同影像學檢查可提高診斷RCC亞型的正確率,但增加患者經濟負擔,且耗時長。影像組學是從醫學圖像中高通量提取定量特征(紋理特征、形狀特征、強度特征及高階特征等信息),轉化為可采集的組學數據,并對這些數據進行分析,從而達到判斷病變性質的目的[8]。本研究探討基于增強CT的影像組學模型鑒別ccRCC與non-ccRCC的價值。
1 資料與方法
1.1 一般資料 回顧性分析2017年1月—2019年9月河北大學附屬醫院收治的179例RCC患者的影像學資料,男93例,女86例,年齡27~88歲,平均(58.4±10.6)歲;腫瘤最大徑2~11 cm,平均(6.48±3.46)cm;術后病理診斷ccRCC 147例,non-ccRCC 32例(pRCC 20例、chRCC 9例、CDC 3例)。納入標準:①病理檢查明確診斷RCC及其分型;②術前3周接受增強CT皮質期掃描。排除標準:①病灶內存在直徑超過4~5 cm的壞死、囊變;②腫瘤已發生轉移;③圖像質量不佳。將患者隨機分為訓練集和測試集。訓練集125例,男64例,女61例,年齡27~87歲,平均(58.4±9.9)歲,64例≤60歲;non-ccRCC 22例(pRCC 15例、chRCC 6例、CDC 1例),ccRCC 103例。測試集54例,男29例,女25例,年齡30~88歲,平均(59.7±9.1)歲;其中non-ccRCC 10例(pRCC 5例、chRCC 3例、CDC 2例),ccRCC 44例。
1.2 儀器與方法 采用GE Discovery HD750 64排CT掃描儀。囑患者禁食6~8 h后,行腎臟平掃及增強掃描。掃描參數:層厚5 mm,螺距0.984:1,掃描視野36 cm×43 cm,矩陣512×512,管電壓100~120 kV,管電流134~409 mA,窗寬250~450 HU,窗位30~50 HU。對比劑為非離子型碘佛醇,經肘靜脈注射,流率3.0~3.5 ml/s,劑量1.0~1.2 ml/kg體質量。皮質期、髓質期、排泄期掃描時間分別為注射對比劑后30~35 s、50~60 s和180 s。
1.3 圖像分割、特征提取與建模 將CT增強圖像(皮質期)導入ITK-SNAP(www.itk-snap.org)軟件,由2名具有8~10年工作經驗的影像學醫師分別獨立勾畫ROI(圖1~3)。ROI勾畫原則:①選取PACS系統上DICOM格式的圖像;②距病灶皮質期邊緣內側0~1 mm;③逐層勾畫,獲得病灶的ROI容積(volume of interest, VOI);④包含小范圍壞死囊變及強化血管;⑤避開腎靜脈內的瘤栓;⑥對于non-ccRCC皮質期,參考髓質期圖像勾畫ROI。
將所有原始圖像文件及勾畫好的ROI文件導入A.K軟件(GE Artificial Intelligence Kit)進行特征提取,包括直方圖特征、形態學特征及二階紋理特征(灰度共生矩陣、游程矩陣等),共生成396個特征;釆用單因素方差分析及秩和檢驗、一般線性模型和前10%互信息(mutual information, MI)3種方法依次進行特征降維,最終選取16個具有統計學意義的特征,即LargeAreaEmphasis、 OneVoxelVolume HaralickCorrelation_angle0_offset7、ClusterProminence_angle135_offset7、ShortRunEmphasis_angle0_offset4、LowGreyLevelRunEmphasis_AllDirection_offset1_SD、HaralickCorrelation_angle135_offset4、LeastAxisLength、LowIntensityLargeAreaEmphasis、最大像素值(MaxIntensity)、直方圖熵(histogramEntropy)、方差(variance)、直方圖能量(histogramEnergy)、平均像素值(MeanValue)、直方圖標準差(stdDeviation)和hara熵(haraEntroy)。分別建立線性邏輯回歸(logistic regression, LR)模型及非線性隨機森林(random forest,RF)模型,保留AUC最大且特異度較高的模型,釆用測試數據進行模型評估。
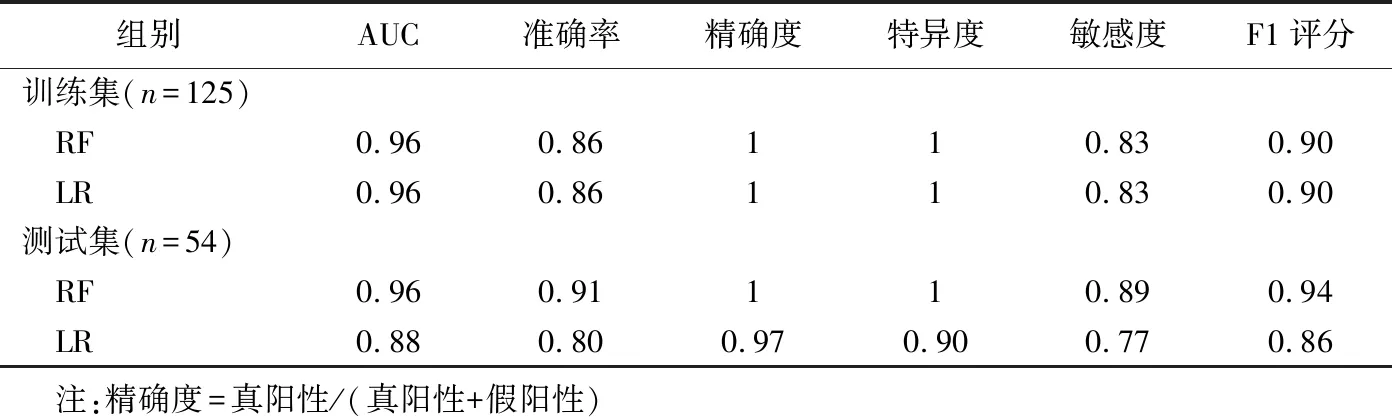
表1 訓練集、測試集中RF、LR模型診斷ccRCC的效能
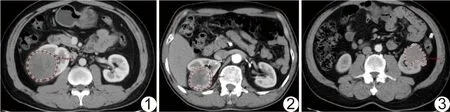
圖1 患者男,59歲,pRCC 皮質期CT增強圖像(虛線為ROI) 圖2 患者女,62歲,ccRCC 皮質期CT增強圖像(虛線為ROI) 圖3 患者男,71歲,chRCC 皮質期CT增強圖像(虛線為ROI)
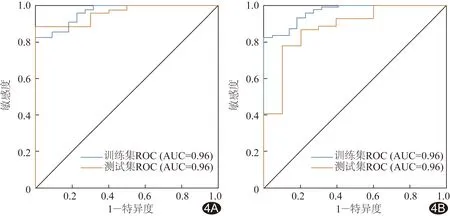
圖4 RF、LR模型診斷ccRCC的ROC曲線 A. RF模型的訓練集和測試集ROC曲線; B. LR模型的訓練集和測試集ROC曲線。
1.4 統計學分析 釆用SPSS 24.0統計分析軟件,以獨立樣本t檢驗比較訓練集和測試集患者年齡,χ2檢驗比較性別和ccRCC在的訓練集和測試集之間的分布。采用ROC曲線評價LR、RF模型鑒別ccRCC與non-ccRCC的效能。P<0.05為差異有統計學意義。
2 結果
訓練集和測試集患者年齡(t=2.13,P=0.05)、性別(χ2=0.41,P=0.05)、ccRCC在的訓練集和測試集之間的分布(χ2=0.02,P=0.90)差異均無統計學意義。
ROC曲線結果顯示,訓練集RF模型診斷ccRCC的AUC為0.96(P<0.05),特異度為1.00,敏感度0.83;LR模型診斷ccRCC的AUC為0.96(P<0.05),特異度為1.00,敏感度為0.83。測試集RF模型診斷ccRCC的AUC為0.96(P<0.05),特異度為1.00,敏感度為0.89;LR診斷ccRCC的AUC為0.88(P<0.05),特異度為0.90,敏感度為0.77。見表1、圖4。
將RF預測模型帶入原始數據中進行預測,結果顯示訓練集中ccRCC真陽性85例,non-ccRCC真陰性22例,測試集中ccRCC真陽性39例,non-ccRCC真陰性10例。將LR預測模型帶入原始數據中進行預測,訓練集中ccRCC真陽性85例,non-ccRCC真陰性22例;測試集中ccRCC真陽性34例,non-ccRCC真陰性9例。
3 討論
RCC是腎臟最常見的惡性腫瘤,約20% RCC患者就診時已發生轉移,早期診斷RCC對于指導臨床治療意義重大[2-3]。盡管多期增強CT可用于鑒別RCC亞型[3],但在臨床工作中仍有很高的誤診率。目前采用影像組學特征鑒別RCC亞型的研究[9]較少,且缺乏研究RCC亞型之間潛在的分子基礎。既往有研究[3,5-6]評估增強CT模式、2D紋理和其他定量參數對RCC亞型的診斷效能,發現其各有不足[10]。放射組學具有可重復性,已逐漸應用于臨床。本研究提取RCC皮質期CT增強圖像特征建立模型,可更直觀地反映腫瘤的整體特征[10],即使選擇一期進行分析,模型對鑒別ccRCC與non-ccRCC的敏感度和特異度仍較高,為傳統CT增強所不及;盡管本組non-ccRCC病例數較少,但兩種模型的特異度均較高,提示模型未過擬合,泛化能力較好。
Zhu等[11]認為低強化是高級別ccRCC的特征。本研究于腎臟腫瘤CT增強皮質期勾畫ROI,利用A.K軟件提取其影像特征(灰度分布、小波特征及紋理特征等),以反映腫瘤內部的異質性[12]。異質性是惡性腫瘤的重要特征,與其惡性生物學行為關聯密切[13],能夠反映相關生長因子變化及腫瘤生長微環境的變化,而這些變化可導致腫瘤局部區域發生細胞增殖或凋亡、內部代謝活躍或抑制、腫瘤血管增加或減少等[14];腫瘤血管生成的異質性可能導致局部有效血流灌注減少,引起該區域缺氧,導致間質靜水壓增高等獨特的腫瘤微環境變化,最終增加腫瘤侵襲和轉移的風險[15-16]。
由于本組non-ccRCC例數較少,可能存在建模偏差,故分別采用線性的LR模型和非線性的RF模型進行建模并對比;ROC曲線結果顯示,測試集RF模型診斷ccRCC的AUC達0.96,LR模型為0.88。LR模型的診斷效能不及RF模型,原因可能在于RCC亞型與特征之間呈非線性關系,而LR模型為線性模型,故診斷效能相對差;RF為非線性,可更加穩定地預測非線性數據。此外,RF模型可處理高維度數據,且毋須進行特征選擇(特征子集隨機),訓練速度快,易采用并行化方法。Li等[17]聯合von Hippel-Lindau(VHL)基因分別建立影像組學模型Boruta、mRMRe,結果顯示測試集在兩種模型中鑒別診斷ccRCC與non-ccRCC的AUC分別為0.969、0.900,與本研究的RF模型(AUC=0.96)相當但高于該組LR模型(AUC=0.88)。
本研究的局限性:樣本量較小,且non-ccRCC樣本量更少;臨床資料中無家族病史,未做組合模型;non-ccRCC樣本僅納入pRCC、chRCC、CDC病例,未涉及其他病理類型non-ccRCC;勾畫ROI時,受部分腫塊邊緣不清晰或部分容積效應的影響,導致準確率降低,且病灶壞死囊變會在一定程度上影響影像組學分析結果。
總之,基于增強CT的影像組學模型可用于鑒別ccRCC與non-ccRCC,其中RF模型的診斷價值更高。

