利用重測序技術開發高粱多態性SSR分子標記
王平 王春語 張麗霞 叢玲 朱振興 陸曉春
(1遼寧省農業科學院 高粱研究所,沈陽 110161;2沈陽農業大學農學院,沈陽 110161)
高粱是世界上重要的糧食作物,是五大作物之一,在人類發展史上扮演了重要角色[1]。隨著分子生物學以及生物信息學的發展,越來越多的重要基因被克隆出來,使得分子育種技術迅速發展。分子育種技術以及基因圖位克隆的深入發展,都離不開分子標記的開發。分子標記技術發展至今,已經經歷過幾代分子標記的歷程,從AFLP,SSR標記發展到今天的SNP標記[2-4]。盡管SNP標記在很多地方已經利用起來,但是SNP標記利用需要用到一些特殊儀器設備,這些設備價格不菲,如利用KASP系統,儀器昂貴[5];或是利用酶切方法開發CAPS標記或是dCAPS標記,酶切的方法成本高,分辨率低,酶切不完全等問題,經常會對實驗造成一些困擾[6]。雖然還有其他檢測SNP的方法,但總體操作相對復雜,核心問題是SNP標記僅有兩種多態型,以上這些因素都限制了SNP的應用。而SSR標記即短序列重復微衛星標記,因其開發價格低廉,使用門檻很低,多態性好而且穩定等原因在現階段的實踐中有很大的運用空間[3]。測序技術的飛躍發展,使得高通量測序成本日益降低,在科研中發揮越來越重要的作用[7-8]。利用高通量測序技術在很多物種中進行了SSR分子標記的開發和應用,大多使用轉錄組測序的數據,如在芝麻、豌豆、蘇丹草及馬尾松等作物中都用到RNA-Seq數據開發SSR標記[9-12]。因轉錄組測序通量、基因時空表達以及僅限基因區域序列等因素影響造成開發的SSR標記產量小,質量不高。盡管美國高粱品種BTX623在2009年就完成了基因組測序[13],也預測了很多SSR標記[14-15],但越來越多的研究表明很多參考基因組僅能代表一部分生態型的多樣性,這也是泛基因組學研究興起的重要原因[16-17]。來源于美國種質的BTX623僅能代表部分生態型品種的序列,而且在國內高粱育種中使用的很多資源與BTX623有較大的差異,造成SSR標記的開發在基因組一些區域的多態性標記開發效率低下,極大限制了高粱SSR分子標記的應用。
為了有效開發多態性SSR標記,本研究利用26個包括不育系和恢復系的材料,然后進行重測序。測序完成后,利用生物信息分析工具開發SSR標記,進行一系列分析后最終開發了兩萬多個SSR標記,并部分驗證了SSR 標記的多態性,這些標記的成功開發,為將來基因定位、克隆、分子育種等實踐提供了重要的分子標記信息。
1 材料與方法
1.1 材料
重測序實驗材料:高粱生產骨干親本:12份恢復系和14份不育系(表1)。所有實驗材料于5月上旬在沈陽實驗基地種植,行長4 m,株距15 cm。
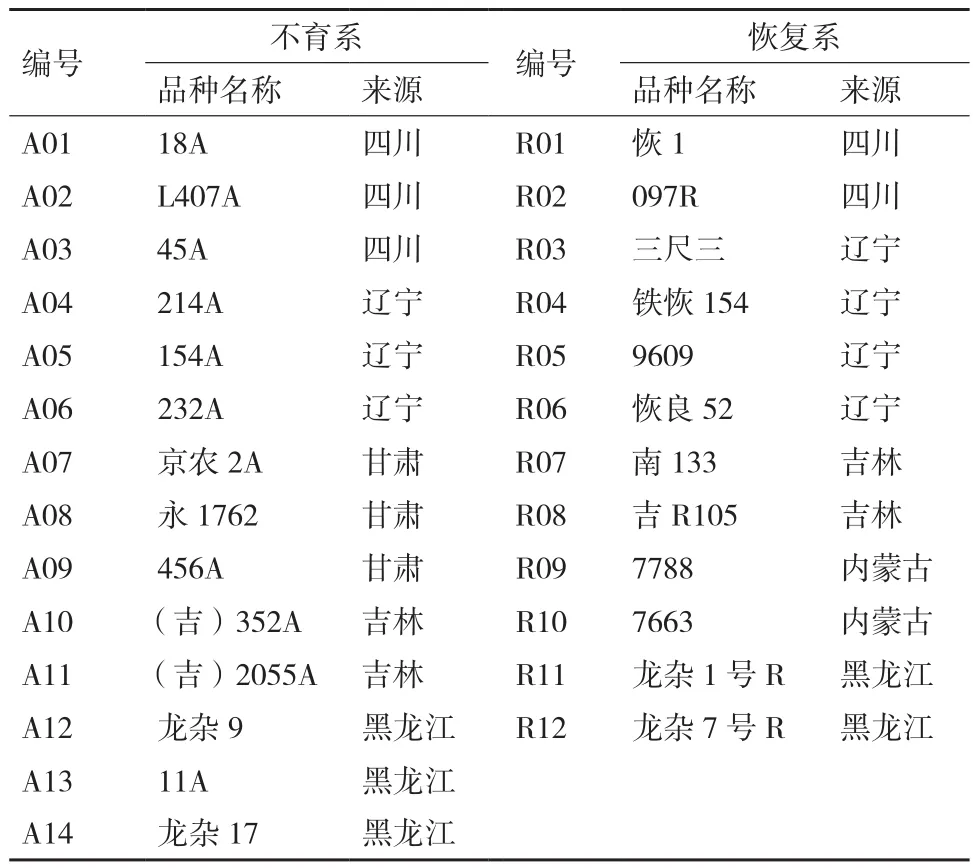
表112份恢復系和14份不育系樣品信息
1.2 方法
1.2.1 分子標記開發過程 生物信息學分析流程如下:對12份恢復系和14份不育系高粱材料進行了10×重測序,然后從兩個途徑同時進行數據分析。利用高通量測序數據中分析變異信息的軟件GATK(Genome Analysis ToolKit)算法分析全基因組indel差異,另一方面利用BTX623參考基因組和簡單重復序列鑒定軟件MISA(MIcroSAtellite identification tool)分析全基因組SSR位點信息,然后綜合比較得到全基因組SSR差異位點信息,而后進行單拷貝基因的分析,綜合SSR差異位點分析,依據SSR標記重復單元堿基數進行分析,然后依據兩端保守序列進行引物的設計開發。引物設計利用Primer 3軟件,遵循引物設計原則設計正反向擴增引物,引物的GC含量在50%-60%之間,長度在18-23 bp左右,退火溫度設在57-63℃之間,以58℃為最佳。設計時避免3'末端堿基為A,以及潛在二級結構的產生。將挑選要進行合成的引物,送往蘇州金唯智公司合成(https://www.genewiz.com.cn)。
1.2.2 DNA提取 實驗材料開始抽穗時剪取葉片1-2 cm到2 mL離心管中,然后加入 600 μL TPS(100 mmol/L Tris-HCl(pH 8.0),10 mmol/L EDTA(pH8.0),1 mol/L KC,高壓濕熱滅菌后使用)提取液;放入一個不銹鋼珠(直徑約5 mm),在組織磨樣機(Tissuelyser Ⅱ,QIAGEN,德國)上研磨,頻率設定為20/s,研磨 1-2 min;利用強力磁鐵取出鋼珠,將離心管放入 65℃水浴中保溫 30 min;12 000r/min 離心 5 min,小心吸出上清液轉移至新的 1.5 mL 離心管,加入等體積的異丙醇,輕輕顛倒混勻,clss= r/min 離心10 min,棄上清。加入 1 mL 70%乙醇洗滌沉淀,12000 r/min 離心 5 min,棄上清,留沉淀,打開管蓋,待沉淀完全干燥后加入 50 μL包含0.2 mg/mL Rnase A(生工生物工程有限公司,上海,中國)的滅菌水或是1×TE buffer溶解沉淀。提取的高粱葉片基因組DNA在0.8%-1.0%瓊脂糖電泳檢測合格后保存于-20℃冰箱備用。
1.2.3 SSR電泳分析 PCR及聚丙烯酰胺凝膠電泳:高粱基因組 DNA 1 μL,F/R-primer(10 μmol/L)0.2μL,2×Taq PCR Master Mix 5 μL(北京艾德萊生物),ddH2O 3.8 μL總體積10 μL;反應在PCR儀上(T100 Thermal cycler,BIO-RAD,美國)進行擴增,PCR擴增程序如下:95℃預變性3 min;94℃ 30 s、X℃30 s、72℃ 25 s,34個循環,最后72℃ 延伸5 min;其中退火溫度X隨引物設計適度調整。PCR產物取2-2.5 μL用6%非變性聚丙烯酰胺凝膠電泳1.5-2.0 h左右(根據差異大小來決定電泳時間)。電泳結束后,關閉電源,從電泳槽中將膠板取下,用鏟子將兩板分開,緩慢將膠取下,并記錄膠的順序編號,經銀染、顯色、水洗等程序獲得擴增條帶,然后在燈箱板上進行膠片的拍攝(EOS 5D,Canon,日本)。
2 結果
2.126份重測序材料多態性SSR標記篩選
利用高粱中26份具有代表性的不育系和恢復系材料,進行重測序序列分析。重測序完成后,進行SSR標記的篩選,為考慮將來SSR分子標記檢測的便利性,本研究制定了比較嚴格的篩選標準。SSR篩選標準如下所示:(1)兩堿基單元重復SSR標記的重復次數需≥6次重復,即這個SSR標記長度必須在12 bp以上;三堿基重復序列SSR重復次數≥5次;四堿基重復序列SSR的重復次數≥4次;五堿基重復序列SSR的重復次數≥3;六堿基重復序列SSR的重復次數≥3次。(2)在所有26個高粱品種中要有多態性,至少是兩種。經過了本研究的標準篩選,共得到24441個多態性SSR,以2或是3個基序重復的SSR為主,兩堿基重復SSR標記11051個;三堿基重復6082個;四堿基重復2600個;五堿基重復2449個;六堿基重復2259個(圖1-A)。對篩選到的SSR標記在26個品種間進行基因型比較,基因型多態類型在2-7種之間,最多能達到7種多態型,大部分的標記僅有兩種,然后多態性數目呈斷崖式下降,以2種多態性的為主,高達68%;其次是3種多態型的占21%;而其它幾種多態型就相對較少分布,7種多態型的標記僅有77個(圖1-B)。
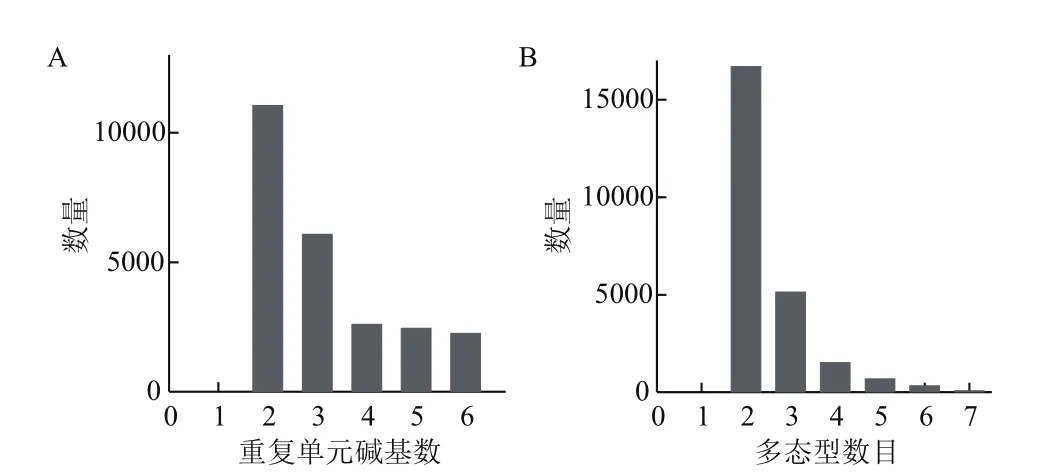
圖1 不同重復單元堿基數的SSR 標記的數量(A)及其在26個品種間的不同多態型標記數量(B)
2.2 單拷貝基因處多態性SSR分子標記的篩選
在分子育種實踐中,功能性標記起到至關重要的作用。功能性標記,主要是位于基因位置上的標記,而一般這樣的基因,幾乎都是單拷貝基因。所以本研究的策略是篩選在單拷貝基因位置的SSR標記。本研究篩選首先是進行單拷貝基因的鑒定,然后分析這些單拷貝基因(包含該基因上下游)序列中所包含的SSR序列,篩選位于單拷貝基因(含上下游2 k)內的多態性SSR標記。相對所有的SSR標記數量,位于基因區標記的SSR數量,僅為總量的1/4左右,總計篩選到6733個標記。2-3個基序重復的SSR標記,僅有2000左右,而4-6重復的SSR標記,約700-800個(圖2-A)。大部分的單拷貝基因上SSR標記在26個品種僅有2種基因型,占了總SSR的69%;其次為3種基因型占總數的20%,4-7種基因型的SSR標記比較少,7種基因型的SSR標記僅為28個(圖2-B)。
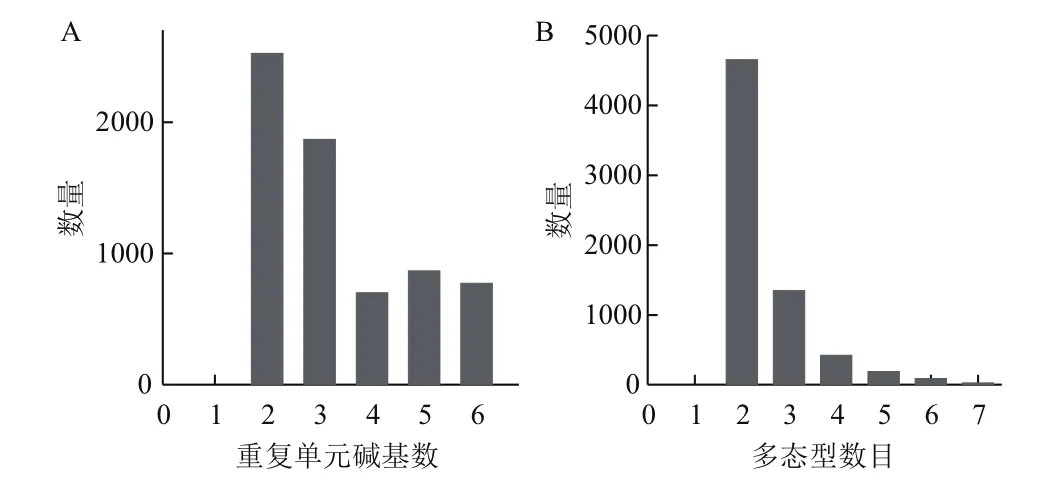
圖2 單拷貝基因處不同重復單元堿基數的SSR標記數量(A)和26個品種間不同多態型標記數量(B)
2.3 單拷貝基因處多態性SSR分子標記在基因上位置分析
通過分析這些SSR標記在基因上的位置,6733個SSR標記中,位于編碼區的僅有820個,UTR區1276個,內含子725個,大多在上下游區域共3932個。如在2個基序重復的SSR中,占有63%,而分布在編碼區多為3堿基或6堿基重復(圖3-A)。這些SSR標記在26個品種間的基因型數,可以看出在基因上下游區域的SSR標記居多,位于基因編碼區的最少,約占所有在編碼區附近的12%。大多數SSR在26個高粱品種有兩種基因型,依次遞減到7種多態型(圖3-B)。
2.4 SSR標記有效性評價
為了檢測開發SSR標記的有效性,本研究在位于編碼區約800個SSR標記引物中,在每條染色體上挑選了5對相對均一覆蓋整條染色體的SSR標記,在10條染色體上進行了引物的挑選、合成,共計50對引物,引物相關信息如表2所示。為了檢驗引物的實用性,利用了參考基因組高粱材料BTX623和雜交種遼糯3號,因為本研究在育種實踐中很多時候利用的是雜交種材料。在50對引物中,兩個材料中僅有一對引物未擴增出產物(Chr6-3兩個親本間無擴增),引物成功率高達98%,另有兩對引物僅能在一個材料中進行擴增;另一個材料顯示無擴增產物(Chr2-3,Chr2-5都是在BTX623中無擴增,在遼糯3中能正常擴增),最終顯示有18對引物在這兩個親本間存在多態性。
為進一步檢驗該批引物的質量,本研究同時挑選了引物Chr1-1,分析其在74份核心種質資源中的多態性豐富程度。該引物在BTX623中擴增的產物的大小,應該是266 bp,擴增產物中較濃的條帶,大小基本符合預期,該條帶即是目標條帶。條帶大小比對分析表明,該標記在74份核心種質資源中至少有8種多態型,標記Chr1-1具有比較高的分辨能力(圖4)。
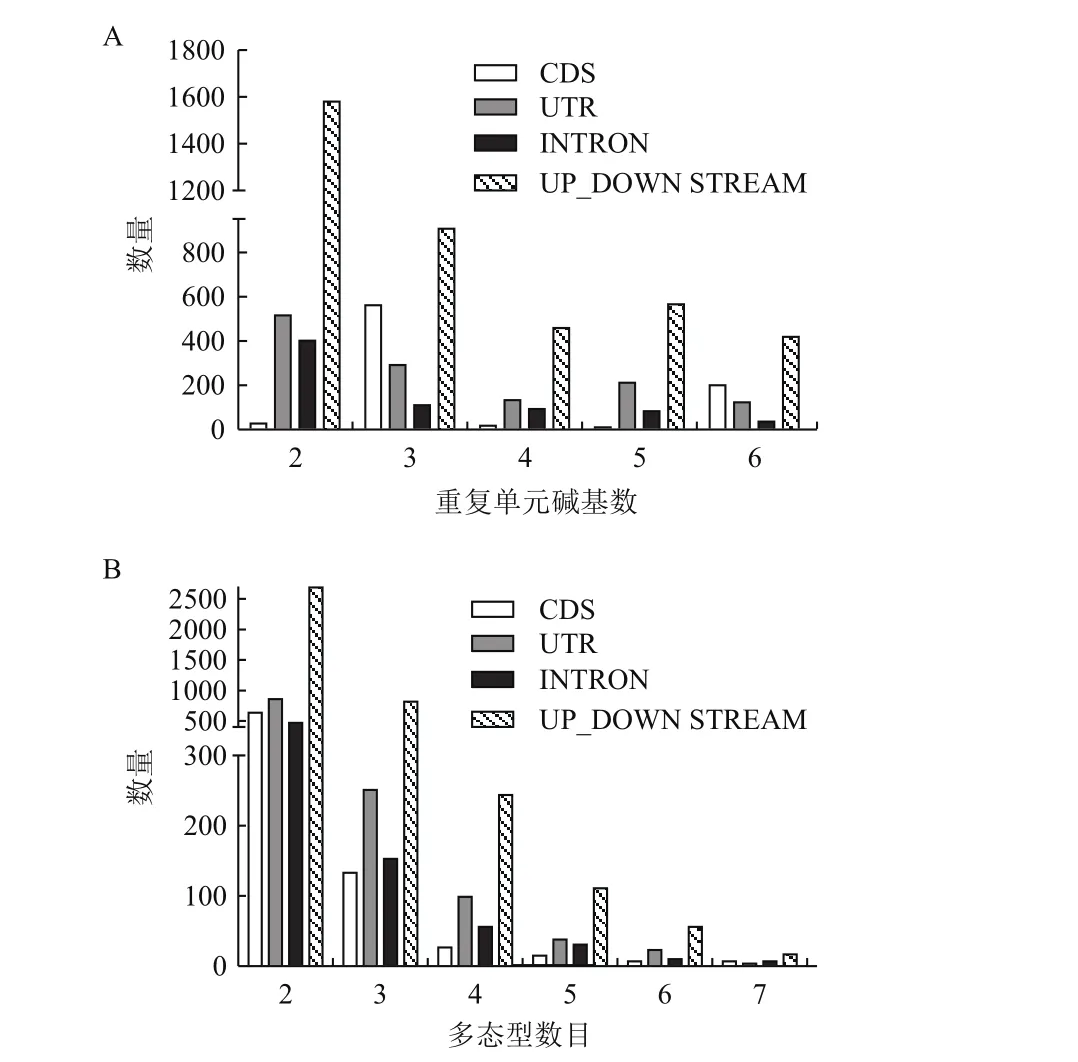
圖3 位于單拷貝基因上不同重復單元堿基數的SSR標記位于基因不同位置的數量(A)及其在26個品種間的多態型數目(B)
3 討論
SSR分子標記因其價廉物美,儀器設備要求不高、多態性好、實踐中可操作性強等特點,一直是分子標記領域的熱門開發方向[3,18-19]。近年來,由于高通量測序技術的發展,成本日益降級,利用高通量測序開發分子標記,越來越高效和便捷。在很多研究中利用轉錄組數據開發SSR標記,由于轉錄組數據本身的缺陷,如測序主要是基因轉錄區段,
很多基因具有時空表達,于是會漏掉很多基因組序列信息,造成開發多態性SSR標記效率并不高[9-12]。
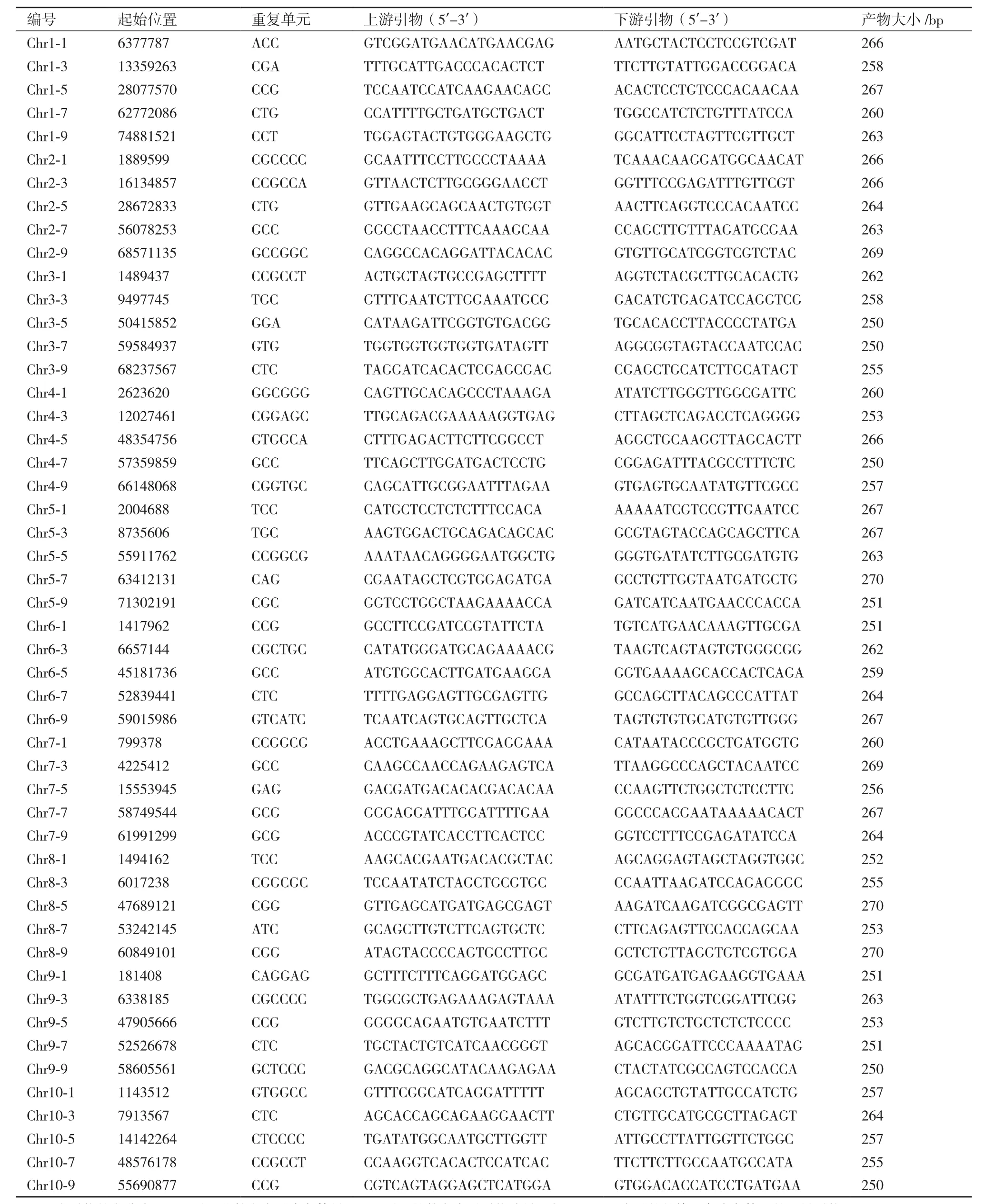
表2 分布于10條染色體上的50對SSR引物信息
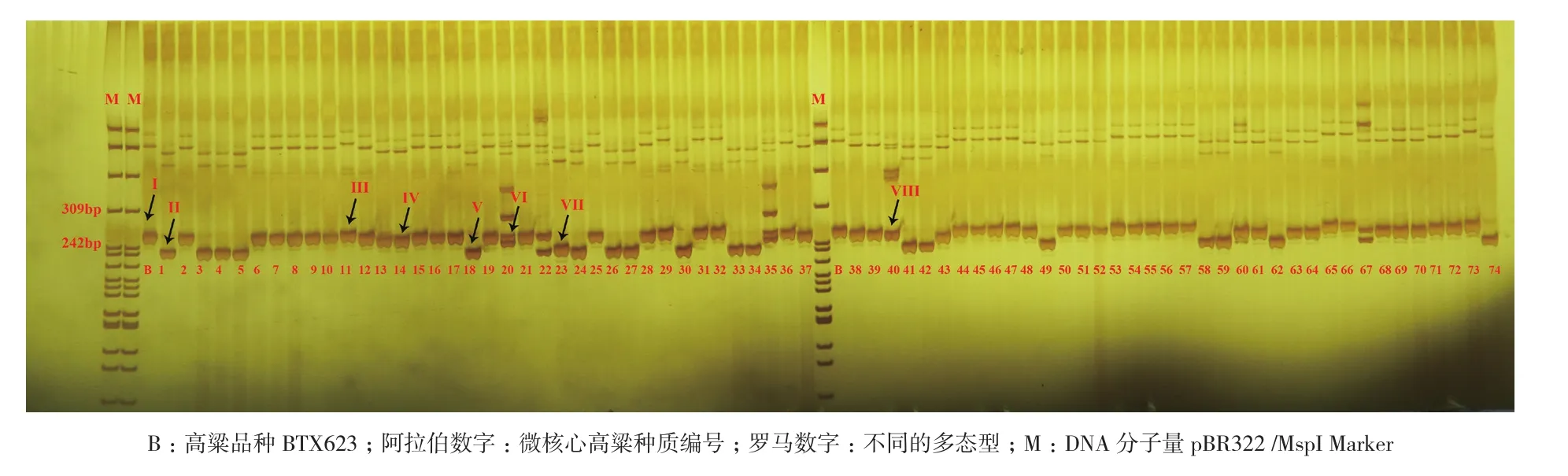
圖4 引物Chr1-1在74份高粱微核心種質資源中多態性分析
在高粱作物中盡管BTX623的基因組序列在2009 年已經完成[13],Yonemaru 等[15]利用該基因組序列開發多態性SSR標記,共獲得5599個非冗余SSR標記,其中(AT/TA)n占所有SSR的26.1%,其次是(AG/TC)n 占20.5%、(AC/TG)n占13.7%和(CG/GC)n占11.8%。其中5012個SSR標記染色體位置是通過e-PCR技術與34008個基因座的預測位置進行比較來確定的。在通過片段分析驗證的970個標記中,67.8%(970個標記中的658個)的標記成功地在高粱品系BTx623中擴增,在11個高粱品系和一個蘇丹草品系的組合中,所有SSR基因座的平均多態性率為45.1%(658個標記中的297個)。BTX623來源于美國,其基因組序列僅能代表部分生態型品種的序列,國內高粱育種中使用的很多資源與BTX623有較大的差異,且遺傳范圍狹窄,造成SSR標記的開發在基因組一些區域的多態性標記開發效率低下,極大限制了高粱SSR分子標記在國內高粱育種上的應用。
為了能開發多態性高的SSR標記,本研究利用實驗室先前進行了26份不育系和恢復系材料重測序,利用這26份材料的重測序數據進行SSR標記的開發,有效提高了多態性標記開發的力度和效率。本研究設計開發的50對SSR引物在兩個親本BTX623和雜交種遼糯3中進行擴增,有49對成功擴增出條帶,其中有兩對引物僅在遼糯3號中能夠擴增,表明很有可能某些基因組區域在BTX623中是缺失的,僅存在國內某些高粱材料中。50對引物在這兩個品種中有多態性的SSR標記為36%,并挑選了SSR標記Chr1-1在74份微核心種質資源中進行分析,初步分析該標記在這些種質資源中有8種多態型之多,表明從開發的SSR標記中容易篩選出多態性好的標記。
本研究開發的SSR分子標記是以26份材料中必須至少有兩種多態型作為篩選標準。在這些入選的SSR標記中,大部分入選的SSR標記都是以2個堿基基序為重復單元的分子標記,3個以上堿基重復的達到6082,26個品種中多態性超過2種的有24441,分布在單拷貝基因上SSR標記占總標記數1/4,分布單拷貝基因編碼區的標記占落在單拷貝基因上的12%。這些標記類型和特點為高粱基因定位、克隆以及分子育種等分子標記的開發提供了可靠的參考數據。
4 結論
利用14個不育系和12個恢復系作為重測序材料,開發了在26份材料中至少含有2種多態型的SSR標記24441個單拷貝基因處的多態性SSR 6733個。隨機挑選均勻覆蓋10條染色體的單拷貝基因處SSR標記50對,利用遼寧高粱雜交種遼糯3號進行測試,其中49對能擴增出產物,成功率高達98%,利用高粱雜交種遼糯3號、BTX623和74份微核心種質資源測試表明,50對SSR標記在2個品種中有18對表現出多態性,挑選了一對引物在74份微核心種質中可見8種多態型。本研究表明利用不育系和恢復系材料進行重測序能有效開發多態性高的SSR標記。

