內皮祖細胞CXC趨化因子受體7對腦缺血再灌注后血管新生的作用
范加維,楊拯,王近吳,范道貴,蔣仕秋,曾江華,易紅梅,戴小珍,劉海榮
1.成都醫學院基礎醫學院,四川成都市 610500;2.成都醫學院生物科學與技術學院,四川成都市 610500;3.成都醫學院第一附屬醫院,四川成都市 610500;4.遂寧市第一人民醫院,四川遂寧市629000
腦卒中是全球導致死亡和殘疾的大血管疾病之一。缺血性腦卒中是最常見的腦卒中類型[1]。干細胞治療已成為治療缺血性損傷的主要策略之一[2]。內皮祖細胞(endothelial progenitor cells,EPCs)是一種形成新生血管的前體細胞,能定向分化為內皮細胞[3-4]。組織缺血或內皮損傷后,EPCs 從骨髓動員到外周循環[5-6],歸巢到血管損傷部位,促進新血管形成和內皮損傷修復[7]。外周血中EPCs數量是內皮功能和心血管疾病風險的標志之一[8-9],在高膽固醇血癥、高血壓、糖尿病患者和吸煙者的外周血中,EPCs 數量明顯減少[9]。心血管疾病患者常伴隨高脂、高糖血癥[10-11],導致外周血EPCs 數量明顯減少。外源性EPCs 移植是治療心腦缺血損傷的重要策略之一。EPCs 移植能縮小腦梗死體積,減輕血管內皮細胞損傷,改善神經功能[12-13]。EPCs 移植也存在許多問題,如移植后EPCs靶向歸巢到缺血組織的能力較差,存活能力低,導致EPCs利用率低,限制了EPCs的臨床應用。
基質細胞衍生因子-1(stromal cell-derived factor-1,SDF-1)也稱CXCL12,是在中樞神經系統廣泛表達的趨化因子[14]。CXCL12 與其受體趨化因子受體(CXCchemokine receptor,CXCR)4、CXCR7相互作用,在腦缺血損傷修復中發揮重要作用[15-17]。Li等[17]發現,CXCL12 基因治療可顯著改善腦缺血所致白質損傷,促進少突膠質祖細胞向小鼠腦缺血部位遷移,并發現CXCL12/CXCR4的作用主要是促進少突膠質祖細胞的增殖和遷移,而CXCL12/CXCR7 的主要作用是促進少突膠質細胞的成熟。我們前期研究發現[7,18],EPCs同時表達CXCR4 和CXCR7 兩種受體,兩種受體的作用不盡相同。糖尿病小鼠骨髓來源的EPCs 中,CXCR7 表達明顯下調;上調CXCR7 表達能明顯改善糖尿病下肢缺血[7]。
難以獲得大量自體EPCs 是EPCs 治療缺血性疾病臨床應用面臨的主要困難之一。人臍帶血和臍帶組織可成為EPCs 來源[19-20];臍帶血和臍帶來源的EPCs 免疫源性較低,異種移植也不會引起免疫排斥反應,能有效改善缺血組織的血管新生[19,21]。我們前期研究發現,CXCR7 在臍帶血來源EPCs 的存活中扮演重要角色,抑制CXCR7 活性將顯著增加EPCs 凋亡。本研究探討上調CXCR7 表達對臍帶血來源EPCs 的存活和血管新生的影響,為臍帶血EPCs 治療缺血性疾病提供更好策略。
1 材料與方法
1.1 材料
1.1.1 主要儀器和設備
細胞培養箱、低溫高速離心機、冰凍切片機:美國THERMO 公司。流式細胞儀:美國BD 公司。酶標儀:美國BIOTEK 公司。化學發光儀、梯度PCR 儀、實時定量PCR (real time-PCR,RT-PCR)儀:美國BIORAD 公司。倒置熒光顯微鏡:日本NIKON 公司。正置熒光顯微鏡:德國LEIKA公司。低速多管自動平衡離心機:安徽中科中佳科學儀器公司。
1.1.2 主要試劑
人淋巴細胞分離液Histopaque 1077、人纖維連接蛋白、氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)、SDF-1、FITC-UEA-1:日本SIGMA 公司。EBM-2:美國LONZA 公司。胎牛血清、胰酶:美國GIBCO公司。血管內皮細胞生長因子受體2(vascular endothelial growth factor receptor 2,VEGFR2)、CD133、CD31抗體:美國CELL SIGNALING TECHNOLOGY 公司。CXCR7:美國ABCAM 公司。Dil-標記的乙酰化低密度脂蛋白(Dil-Ac-LDL):美國BIOMEDICAL TECHNOLOGIES 公司。化學發光底物:美國MILLIPORE 公 司。iScript cDNA Synthesis Kit、SsoAdvanced Universal SYBR Green Supermix:美國BIO-RAD 公司。基質膠:美國BD 公司。兔抗Actin、山羊抗兔IgG:北京博奧森生物技術有限公司。Cy3標記山羊抗兔IgG(H+L)、Alexa Fluor 488標記山羊抗小鼠IgG (H+L)、DAPI、BCA 蛋白濃度測定試劑盒:上海碧云天生物技術有限公司。總RNA 提取試劑盒、高效RIPA 組織細胞快速裂解液:北京索萊寶科技有限公司。Annexin v-FITC/PI 細胞凋亡試劑盒:江蘇凱基生物技術股份有限公司。pLVX-EGFP-3FLAG-Puro載體:上海升博生物技術有限公司。CXCR7、GAPDH 引物:上海生工生物有限公司。水合氯醛:成都市科龍化工試劑廠。氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC):斯百全化學上海有限公司。
1.2 方法
1.2.1 EPCs的分離和培養
采取人臍帶血20 ml,PBS 等體積稀釋;貼壁緩慢加入盛有等體積Histopaque 1077 的上層,室溫2000 r/min 離心20 min 后,管內液體分為4 層;取中間白膜層細胞,PBS 重懸洗滌2 次,1200 r/min 離心10 min。用添加含多種生長因子的SingleQuots 并加入含10%胎牛血清的內皮細胞基礎培養基EGM-2MV 重懸,將細胞接種于預先用人纖維連接蛋白包被的6 孔板中,37 ℃、5% CO2、飽和濕度培養箱內培養。觀察細胞形態并拍照。待細胞長到80%~90%融合,傳代培養[7,22]。
1.2.2 EPCs的鑒定
1.2.2.1 Dil-ac-LDL攝取和FITC-UEA-1結合實驗
取培養14 d 的細胞,吸棄細胞板內培養液,PBS輕輕洗滌3 次,去除未貼壁細胞。每孔加入10 μg/ml Dil-ac-LDL 200 μl,37 ℃、5%CO2、飽和濕度恒溫孵育4 h;吸棄細胞板中液體,用PBS輕輕洗滌3次,每次5 min;預冷的4%多聚甲醛固定10 min;棄固定液,PBS 洗2 次,每次5 min;加入10 μg/ml FITCUEA-1 200 μl,孵育1 h 后,棄液體;PBS 輕輕洗滌3次,每次5 min;50%緩沖甘油封片,熒光顯微鏡下拍照觀察[7]。
1.2.2.2 表面標志物
取培養14 d 細胞,PBS 洗滌,胰酶消化,離心,收集細胞;棄上清,細胞計數,5×104/孔接種至24 孔板。細胞貼壁穩定生長后,PBS洗滌2次,PBS 500 μl中分別加入VEGFR2 和CD133單克隆抗體10 μl,混勻后加入24 孔板中,37 ℃孵育60 min;PBS 洗滌3 次。PBS 500 μl 中分別加入Cy3 和Alexa Fluor 488 熒光二抗5 μl,37 ℃孵育60 min;PBS 洗滌3 次,DAPI 復染;PBS 洗滌3 次,50%緩沖甘油封片,熒光顯微鏡下拍照觀察。
1.2.3 慢病毒載體的構建及轉染
利用基因重組技術,將人源CXCR7 基因克隆到pLVX-EGFP-3FLAG-Puro 載體,構建CXCR7 過表達載體(pLVX-CXCR7-EGFP-3FLAG-Puro);采用慢病毒包裝體系,將三質粒系統(pLVX-CXCR7-EGFP-3FLAG-Puro 1.5 μg、pCMV-dR8.9 0.5 μg、pCMVVSV-G 1 μg)共轉染至293T 細胞中,包裝成慢病毒顆粒。轉染36~48 h 后,收集培養液上清,超速離心法濃縮和純化,檢測病毒滴度。
取第4 代EPCs,5×104/孔接種到24 孔板,次日用于病毒感染。細胞分為正常C 組(不感染病毒)、對照C 組(感染pLVX-EGFP-3FLAG-Puro 病毒)和感染C 組(感染pLVX-CXCR7-EGFP-3FLAG-Puro 病毒)。按照MOI=50 加入相應病毒顆粒孵育24 h,更換新鮮培養基。感染72 h后,倒置熒光顯微鏡觀察GFP表達,將感染率70%以上的細胞用于后續實驗。
1.2.4 CXCR7在EPCs中的表達
1.2.4.1 RT-PCR
轉染72 h 后,收集正常C 組、對照C 組和感染C組EPCs各1×106個,按說明書提取總RNA,采用反轉錄試劑盒合成cDNA,以cDNA 為模版,RT-PCR 檢測各組細胞中CXCR7 mRNA 表達水平(以GAPDH 為內參),目的基因表達水平用2-ΔΔCt表示。
CXCR7 上游引物序列5'-CGC CTC AGA ACG ATG GAT C-3',下游引物序列5'-AAC AAG TAA ACC CGT CCC AGA-3'。GAPDH 上游引物序列5'-CAG GAG GCA TTG CTG ATG AT-3',下游引物序列5'-GAA GGC TGG GGC TCA TTT-3'。
1.2.4.2 Western blotting
轉染72 h后,各組加裂解液抽提蛋白,BCA法蛋白定量。每個樣品取蛋白20 μg,轉膜、封閉,加CXCR7一抗(1∶200)4 ℃孵育過夜;洗膜,加二抗(1∶1000),37 ℃孵育60 min;洗膜,ECL 試劑盒曝光顯色,Image J 軟件分析各條帶灰度值,以β-actin 為內參計算相對灰度。
1.2.5 基質膠成管試驗
將基質膠用不含生長因子的基礎培養基1∶1 稀釋,100 μl/孔包被48 孔板。4×104/孔分別接種對照C組和感染C 組EPC,每種細胞各分3 組:空白組不添加其他試劑,ox-LDL 組加ox-LDL 50 μg/ml,處理組加ox-LDL 50 μg/ml 和SDF-1 50 μg/ml。37 ℃、5%CO2條件下培養6 h,顯微鏡下觀察管樣結構形成并拍照。Image J軟件計算管樣結構長度[7]。
1.2.6 Annexin v-FITC/PI染色
對照C 組和感染C 組EPCs 分別接種于6 孔板中,每孔1×105個細胞。細胞貼壁后,同前法分為3 組。24 h 后,PBS 洗去未貼壁細胞,不含EDTA 0.25%胰蛋白酶消化收集細胞。根據Annexin v-FITC/PI細胞凋亡試劑盒說明書染色,流式細胞儀檢測AnnexinV+/PI-細胞(早期凋亡細胞)[7]。
1.3 腦缺血再灌注損傷模型的制備
成年Sprague-Dawley 大鼠36 只,體質量(220±20)g,由四川省醫學科學院/四川省人民醫院實驗動物研究所提供,許可證號SCXK(川)2013-15。Longa 線栓法制備大鼠右側腦缺血再灌注損傷模型[23]。
1.4 神經功能評分
再灌注24 h 后,采用Longa 評分標準對大鼠進行神經功能評分。0分,無神經損傷癥狀;1分,不能完全伸展對側前爪;2 分,向對側轉圈,損傷側出現Horner綜合征;3分,向對側傾倒;4分,不能自發行走,喪失意識;5 分,死亡。0、4、5 分的大鼠舍棄,并補充大鼠[23-24]。于再灌注后7 d和14 d再次評分。
1.5 細胞移植
再灌注24 h 后,造模成功的大鼠等分為PBS 組(n=12)、對照組(n=12)和移植組(n=12)。對照C 組和感染C 組EPCs 重懸于PBS 溶液中,對照組和移植組大鼠尾靜脈輸注對照C 組和感染C 組EPCs 2×106個,體積1 ml,PBS組輸注等體積PBS。
1.6 腦梗死體積檢測
再灌注后14 d,各組取6 只大鼠麻醉,迅速取出腦組織,-20 ℃速凍,均勻切開,2%TTC 37 ℃染色20 min,Image J計算梗死體積[24]。
1.7 GFP陽性細胞計數
其余6 只大鼠取腦組織包埋于OCT 中,制作冰凍切片。各組取一套切片正置熒光顯微鏡下拍照觀察,計算GFP陽性EPCs數。
1.8 免疫熒光染色
各組另取一套冰凍切片,PBS浸洗3次,4%多聚甲醛固定20 min,PBS 浸洗,山羊血清室溫封閉30 min;加CD31一抗(1∶200) 4 ℃孵育過夜;PBS 浸洗,加熒光標記二抗(1∶500) 37 ℃孵育1 h;PBS 浸洗,含抗熒光淬滅劑的封片液封片,熒光顯微鏡下觀察,計數區域中毛細血管數。
1.9 統計學分析
采用Origin 7.5 完成實驗數據分析和作圖。結果以()表示,各組間比較采用單因素方差分析。顯著性水平α=0.05。
2 結果
2.1 EPCs的分離培養及鑒定
細胞培養3 d,出現典型的克隆集落樣結構;7 d時集落樣結構逐漸消失,大部分細胞鋪展,呈“鋪路石”樣結構(圖1)。
細胞培養14 d 時,與Dil-ac-LDL、FITC-UEA-1孵育,在熒光顯微鏡下觀察可見紅色和綠色熒光(圖2),并表達EPCs 表面標志物VEGFR2 和CD133(圖3)。既能攝取Dil-ac-LDL 又能結合FITC-UEA-1 的棕黃色雙熒光細胞,VEGFR2和CD133雙陽性細胞定義為分化期EPCs。
2.2 EPCs中CXCR7的表達
轉染72 h 后,感染C 組見大量GFP 陽性細胞(圖4),感染率達70%以上;GFP 蛋白主要分布在細胞膜周邊。
Western-blotting 和RT-PCR 均顯示,感染C 組CXCR7 蛋白和mRNA 表達量明顯高于正常C 組和對照C組(P<0.01),后兩組間無顯著性差異(P>0.05)。見表1、表2。

圖1 不同時間EPCs形態變化(倒置顯微鏡,×100)

圖2 Dil-ac-LDL攝取和FITC-UEA-1結合實驗(×200)
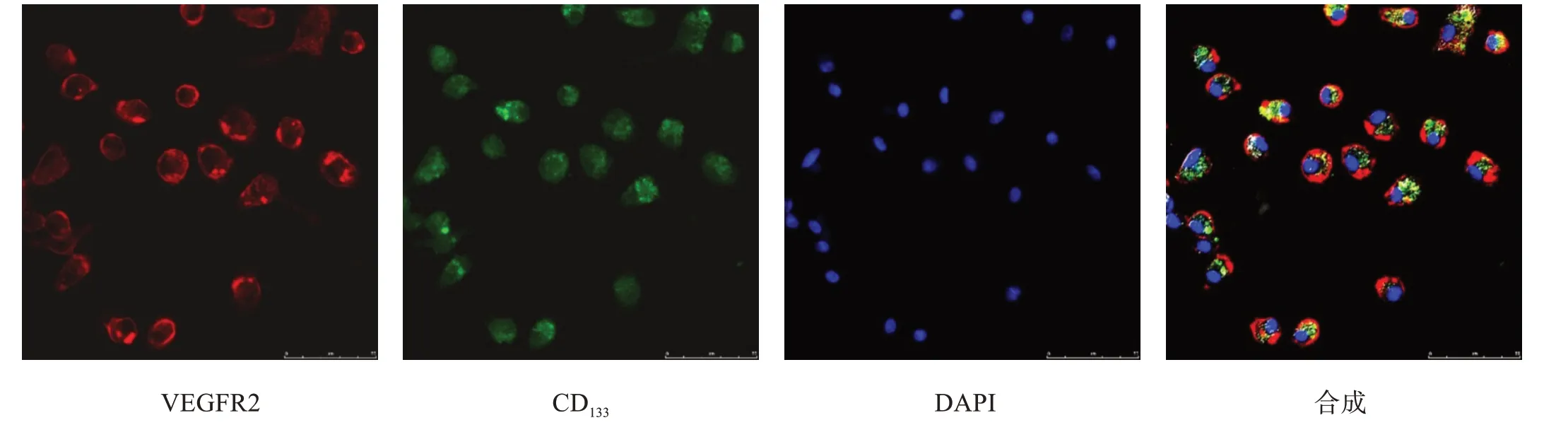
圖3 細胞表面標志物VEGFR2和CD133(免疫熒光染色,×400)

圖4 對照C組和感染C組CXCR7表達(倒置熒光顯微鏡,×100)

表1 各組CXCR7蛋白表達(/β-actin)

表2 各組CXCR7 mRNA的表達(2-ΔΔCt)
2.3 基質膠成管試驗和Annexin v-FITC/PI染色
與各自空白組相比,各組ox-LDL 組管樣結構相對長度均明顯下降(P<0.01);感染-處理組管樣結構相對長度較對照-處理組顯著延長(P<0.001)。見圖5、表3。
與各自空白組相比,各組ox-LDL 組EPCs 凋亡率明顯增加(P<0.01);感染組顯著低于對照組(P<0.001)。見圖6、表4。
2.4 腦缺血后神經功能恢復和微血管新生
再灌注后7 d,移植組大鼠Longa評分低于對照組和PBS 組(P<0.05);再灌注后14 d,對照組Longa 評分低于PBS 組(P<0.05),移植組低于對照組(P<0.05)。見表5。
再灌注后14 d,對照組腦梗死體積低于PBS 組(P<0.05),移植組低于對照組(P<0.05)。見圖7、表6。
移植組GFP陽性細胞數高于對照組(P<0.05),毛細血管數高于對照組(P<0.05)。見圖8、圖9、表7。
3 討論
本研究顯示,EPCs 轉染CXCR7 后,可顯著增強EPCs 在ox-LDL 作用下管樣結構形成能力和抗凋亡能力;移植轉染CXCR7的EPCs,可促進EPCs歸巢至缺血部位,并促進缺血組織微血管新生。這在一定程度上解決了移植后EPCs 靶向歸巢能力差、存活能力低和利用率低的難題,為干細胞治療缺血性疾病提供了新的方法。
EPCs 是一種新生血管形成的前體細胞,能定向分化為內皮細胞,主要存在于骨髓、外周血和臍帶血中,EPCs 介導的血管新生是治療缺血性疾病的重要策略之一[22,25-27]。由于外周血中EPCs 含量較低,骨髓采集量少,臍帶血成為獲取EPCs 的主要來源。前期研究發現[22],移植人臍帶血來源的單核細胞到大鼠心肌組織,未出現移植排斥反應。本研究移植人臍帶血來源的EPCs至大鼠體內,也未出現移植排斥反應。
腦中卒患者常伴有高血脂血癥,導致外源性EPCs 存活能力較低,歸巢到缺血部位能力差。SDF-1通過與其受體CXCR4 和CXCR7 結合,在EPCs 的存活、動員和歸巢中發揮重要作用;在應激狀態下,CXCR7 起主導作用[7]。本研究采用ox-LDL 模擬體內高脂血癥環境,發現上調EPCs 中CXCR7 表達能抑制ox-LDL 對EPCs 的損傷,與我們前期研究結果一致[7]。本研究還顯示,移植轉染CXCR7 的EPC 能改善大鼠神經功能,增加缺血部位EPCs數量和毛細血管密度。
Qiu 等[28]發現,骨髓源性EPCs 移植可以減輕腦缺血再灌注損傷,與EPCs 的抗氧化和抗凋亡能力有關。Bai 等[29]發現,EPCs 治療可增加缺血腦組織中腦源性神經營養因子的分泌,從而改善神經功能。本研究進一步證實,移植EPCs 能改善大鼠腦缺血再灌注后神經功能,移植轉染CXCR7的EPCs效果更顯著。
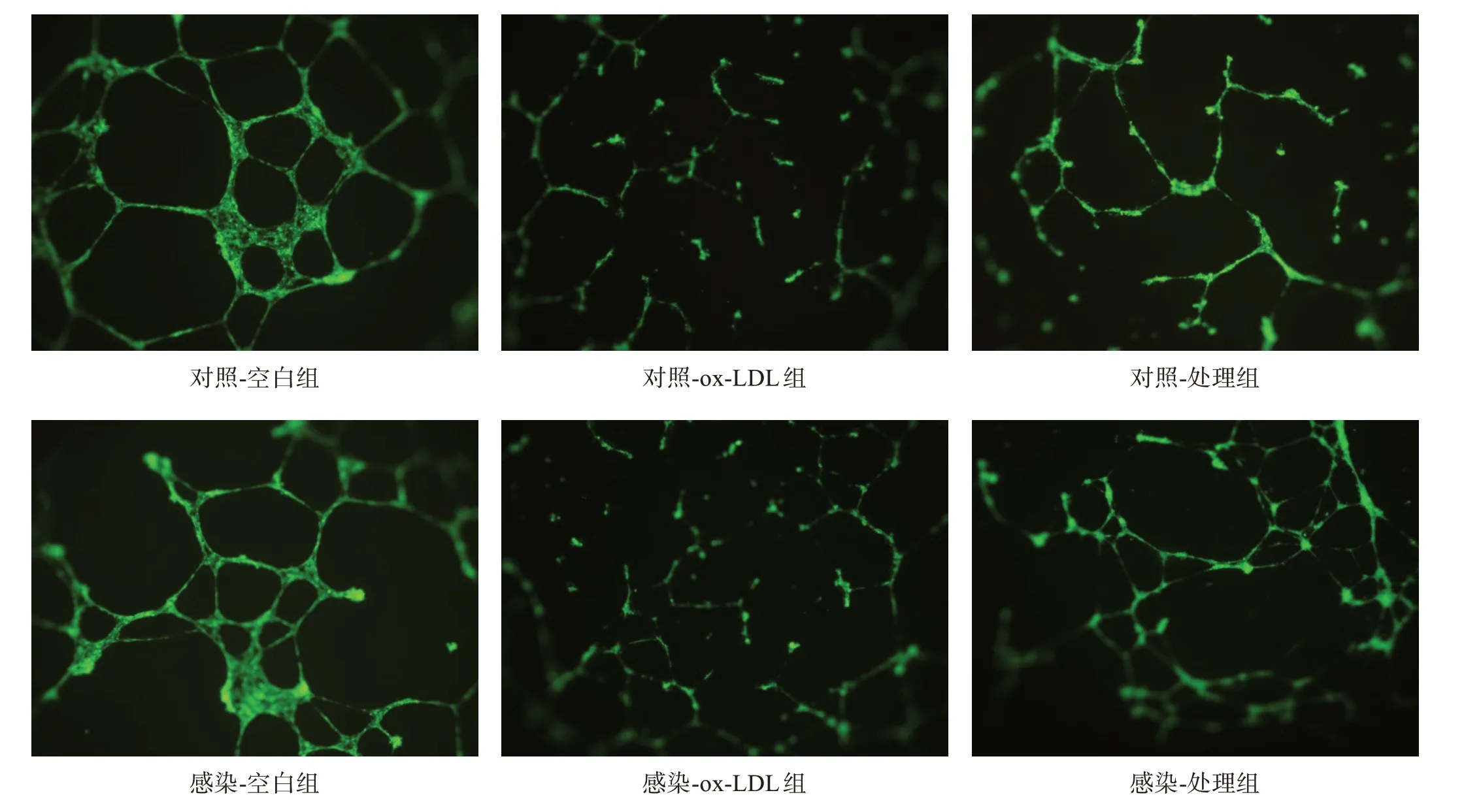
圖5 各組管樣結構形成實驗結果(×100)
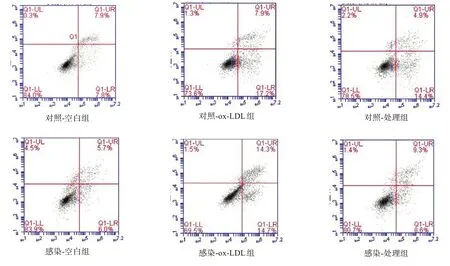
圖6 細胞凋亡流式分析結果
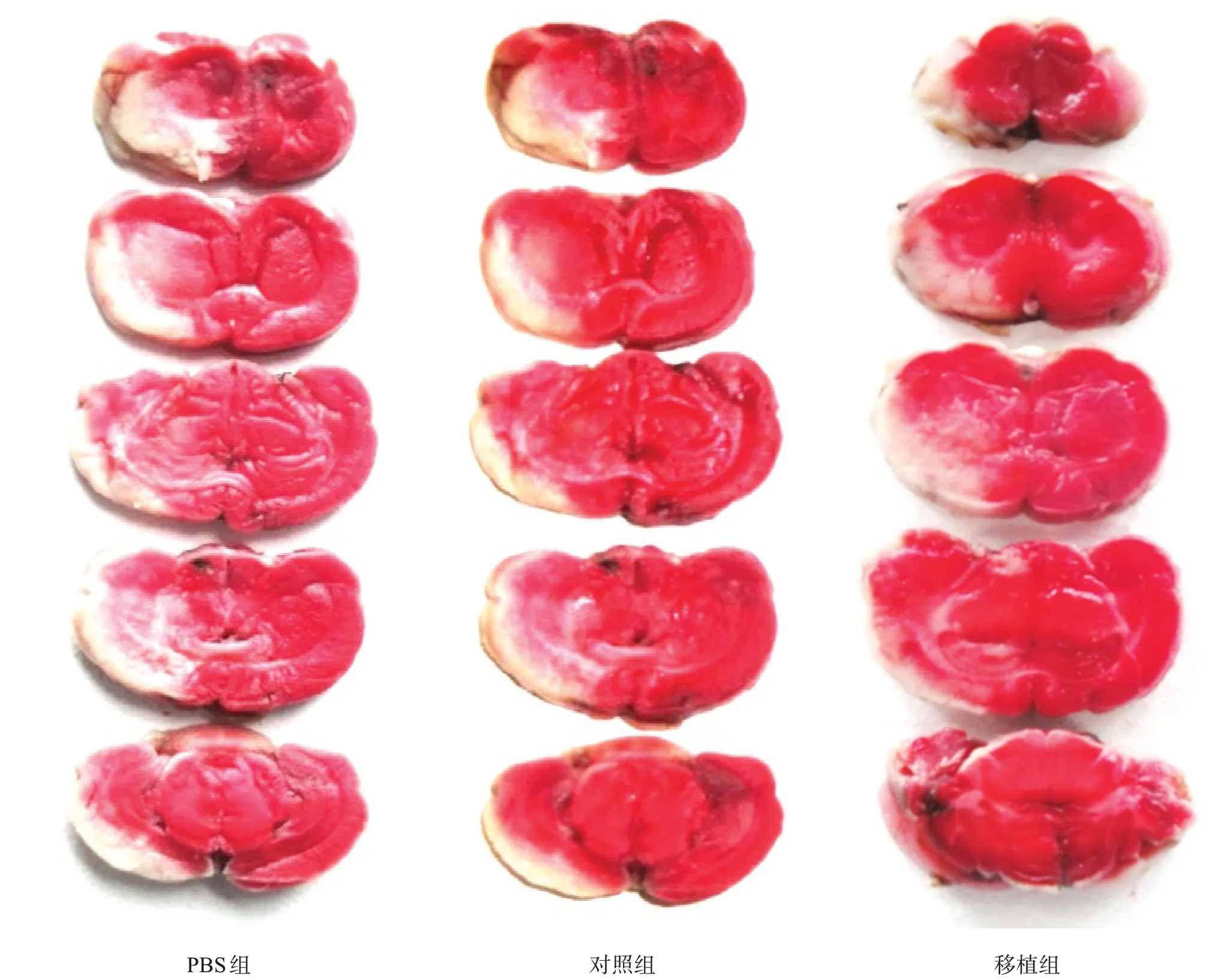
圖7 各組腦梗死灶體積(TTC染色)

表3 各組細胞管樣結構的相對長度(/空白組)
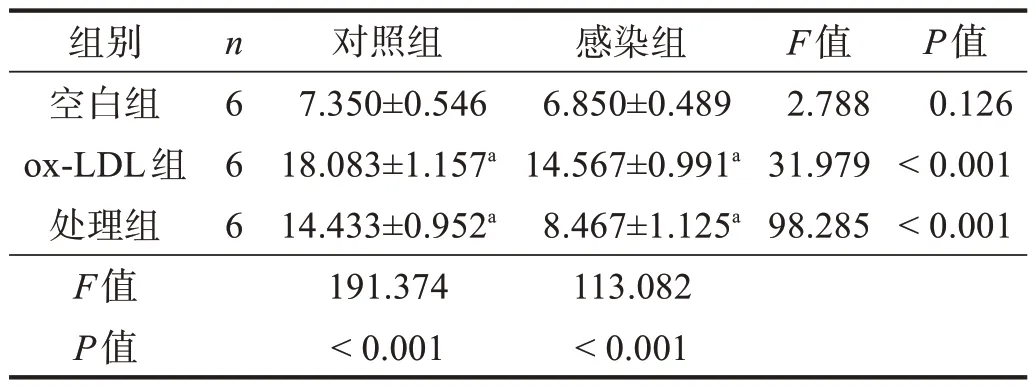
表4 各組細胞凋亡率比較(%)
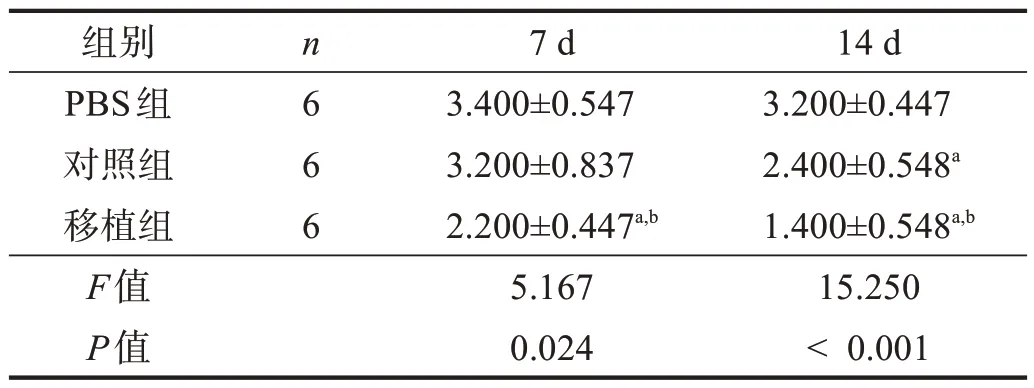
表5 各組Longa評分的比較
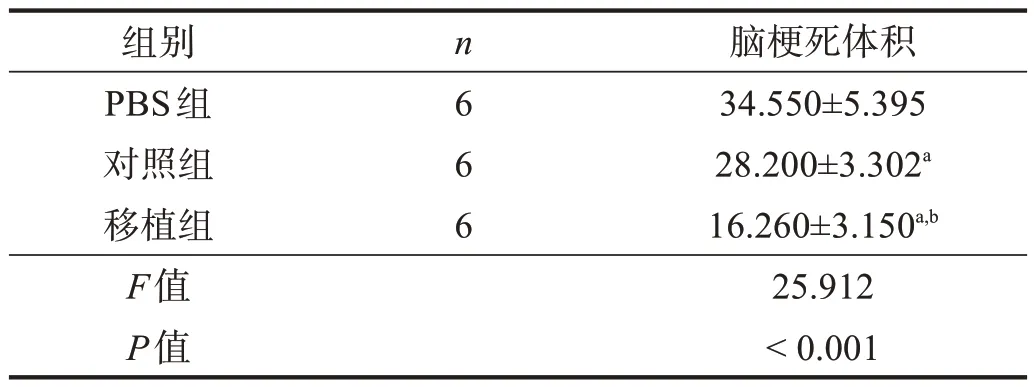
表6 各組腦梗死體積比較(%)

圖8 各組GFP陽性細胞分布(正置熒光顯微鏡,×100)

圖9 各組毛細血管分布(免疫熒光染色,×100)
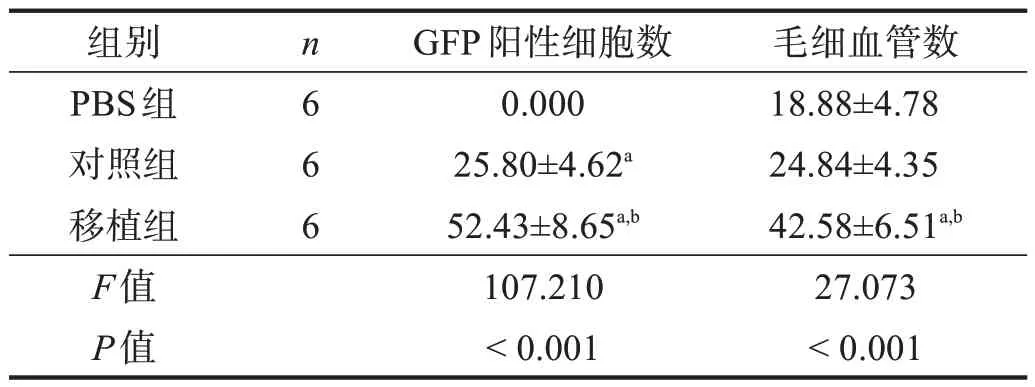
表7 各組GFP陽性和毛細血管數比較
綜上所述,上調SDF-1/CXCR7 信號軸明顯改善EPCs 在高脂環境下的存活能力,還能有效促進其靶向歸巢至缺血組織并促進血管新生,為EPCs 移植治療缺血性疾病的臨床應用提供了新的實驗依據。

