胸腔鏡下肺減容術治療高海拔地區慢性阻塞性肺氣腫肺動脈高壓的臨床研究
梁忠,魏振宏,虎衛東,朱子江,金剛
高原地區空氣干燥,是呼吸道疾病的高發地區,而高原地區氧含量低,又會加重呼吸系統、心血管系統疾病。肺氣腫、肺大泡、肺動脈高壓本身就對呼吸系統和心血管系統造成較大影響。高原地區的低氧血癥和肺動脈高壓患者,其病理生理過程與低海拔地區患者有較大不同,肺減容術面對的問題和困難也有較大差別。國內外研究主要集中在內科藥物治療、胸腔鏡下肺減容術(LVRS)以及肺移植手術[1],而對高原地區LVRS 所面對的更嚴重、復雜的問題,目前研究很少。本研究旨在探討慢性阻塞性肺氣腫肺動脈高壓行LVRS 治療的臨床療效,現報道如下。
1 資料與方法
1.1 納入標準 (1)均符合《慢性阻塞性肺疾病診治指南(2013 年修訂版)》[2]中相關診斷標準;(2)根據美國醫療研究委員會(MRC)修訂的呼吸困難指數分級[3],患者呼吸困難指數為Ⅲ級和Ⅳ級;(3)體檢均為桶狀胸,X 線檢查示肋間增寬、膈肌低平、肺紋理稀疏;(4)高分辨CT 檢查示肺氣腫,均為非均質改變,存在靶區肺組織透亮度高;(5)未合并其他系統嚴重疾病。
1.2 一般資料 選擇2009 年9 月—2016 年12 月甘肅省人民醫院收治的56 例慢性阻塞性肺氣腫肺動脈高壓患者,其中男50 例,女6 例;年齡45~76 歲,平均(55.3±13.2)歲;呼吸困難指數:Ⅳ級35 例,Ⅲ級21 例;均有多年咳嗽、咳痰、喘息病史,部分呼吸困難患者需要吸氧;查體桶狀胸,雙肺呼吸音減弱;胸部增強CT 示肺氣腫分布非均質改變,病變以肺上葉為主,多呈大泡性邊緣型肺氣腫征象;患者術前均行霧化吸入、吸氧、戒煙、術前控制感染等治療;行1 周呼吸功能康復訓練后,大部分患者血氧飽和度及呼吸耐力明顯增強,氣急癥狀改善,但肺功能無明顯改善;約有1/3患者不符合肺功能檢查要求,因此無肺功能參數;患者術前均行心臟彩超檢查,肺動脈高壓最高為92 mm Hg (1 mm Hg=0.133 kPa),肺動脈高壓者請心內科會診,以排除心源性肺動脈高壓,降低心血管并發癥發生率。
1.3 手術方法 本研究患者均符合美國胸科委員會(ATS)標準中的手術指征[4],均行胸腔鏡下LVRS,其中單側LVRS 40 例,雙側LVRS 16 例。
患者行氣管雙腔插管靜脈復合全身麻醉,留置深靜脈插管,行有創動脈壓監測,單側LVRS 者取術側向上臥位,胸部墊高,腋中線第7肋間做1.0 cm切口為觀察孔,腋前線與鎖骨中線之間第3 肋間或第4 肋間做2.0 cm 切口,肩胛下角線處第7 肋間或第8 肋間做2.0 cm 長切口為操作孔;同期雙側LVRS 者取術側向上臥位,手術切口同單側LVRS;術畢變換體位,保持術側引流管通暢,再行另一側手術。胸腔鏡下用腔鏡直線切割縫合器行上葉肺尖倒U 字形肺氣腫肺大泡切除,切除后盡量保持肺原有形狀,松解下肺韌帶,壁層胸膜摩擦,放置胸引管,良好膨肺后關胸。
術后給予鎮痛泵、吸氧、霧化吸入、抗感染等對癥支持治療,同時監測血氣分析、根據痰培養結果調整抗生素,出院時復查心臟彩超。
1.4 臨床效果 觀察患者術后一般情況,比較患者術前、術后2周、術后2個月第1秒用力呼氣末容積(FEV1)、肺動脈壓、每搏輸出量、動脈血氧分壓(PaO2)、動脈血二氧化碳分壓(PaCO2)、登樓試驗。
1.5 生活質量 觀察患者接受治療前后飲食、睡眠、平臥、胸悶氣短、登樓試驗的改善情況(以患者主觀感受肯定或者否定)。
1.6 統計學方法 采用SPSS 19.0 統計軟件進行數據處理,計量資料以表示,不同時間點比較采用單因素方差分析;計數資料以相對數表示。以P<0.05 為差異有統計學意義。
2 結果
2.1 一般情況 40 例行單側LVRS 患者,2 例半年內分期行雙側LVRS 患者,14 例同期行雙側 LVRS 的患者中2 例死亡。術中切除每側肺容積的20%~70%,切除每側肺標本重32.3~86.5 g,平均(47.7±15.2)g;7 例患者于術后入ICU 監護1~3 d,術后7~22 d 出院;術后40 例漏氣(1~8 d),2 例肺感染,2 例呼吸機支持 (7~10 d)。
2.2 臨床效果 3 個時間點FEV1、肺動脈壓、每搏輸出量、PaO2、PaCO2及登樓試驗比較,差異有統計學意義(P<0.05);其中術后2 周、2 個月FEV1、每搏輸出量、PaO2及登樓試驗均高于術前,肺動脈壓、PaCO2低于術前,差異有統計學意義(P<0.05,見表1)。
表1 患者LVRS 前后各檢測指標比較(n=56,Table 1 Comparison of various indices of patients before and after LVRS
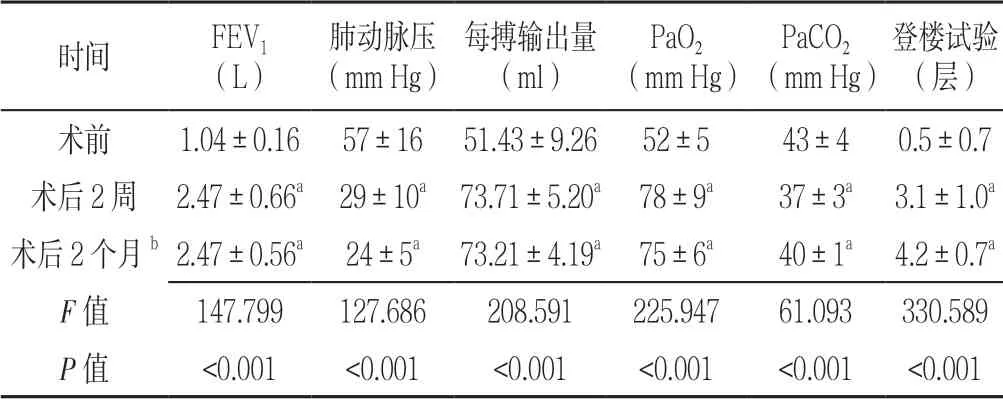
表1 患者LVRS 前后各檢測指標比較(n=56,Table 1 Comparison of various indices of patients before and after LVRS
注:與術前比較,aP<0.05;FEV1=第1 秒用力呼氣末容積,PaO2=動脈血氧分壓,PaCO2=動脈血二氧化碳分壓;1 mm Hg=0.133 kPa;b 為1 例患者死亡
時間 FEV1(L)肺動脈壓(mm Hg)每搏輸出量(ml)PaO2(mm Hg)PaCO2(mm Hg)登樓試驗(層)術前 1.04±0.16 57±16 51.43±9.26 52±5 43±4 0.5±0.7術后2 周 2.47±0.66a 29±10a 73.71±5.20a 78±9a 37±3a 3.1±1.0a術后2 個月b 2.47±0.56a 24±5a 73.21±4.19a 75±6a 40±1a 4.2±0.7a F 值 147.799 127.686 208.591 225.947 61.093 330.589 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 生活質量 患者睡眠、登樓試驗改善率由術后2周的60%左右升高到90%左右及以上,胸悶氣短改善率由術后2 周的75%左右升高到90%左右,詳見表2。
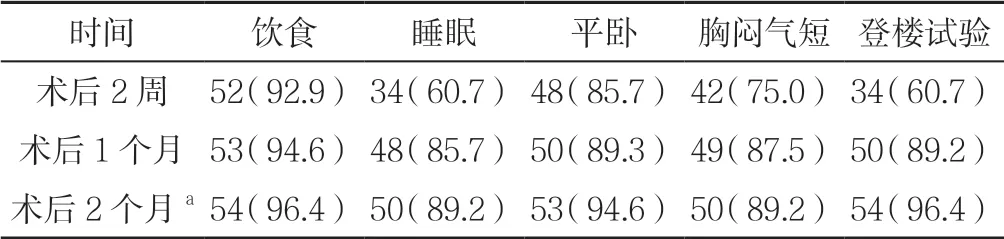
表2 患者術后生存質量改善率〔n=56,n(%)〕Table 2 Improvement rate of patients' postoperative quality of life
3 討論
胸腔鏡下LVRS 目前在國內外以及高原地區和平原地區均有開展,高原地區研究報道文獻極少。主要因患者身體條件差,基礎疾病比較多,肺功能極差,手術復雜,手術并發癥較多,手術風險極大,患者對風險的承受能力不同,以及醫生對手術的評估標準不同,而使這項工作開展的并不廣泛。
本研究證實胸腔鏡下LVRS 患者術前心臟彩超、血氣分析是手術適應證的重要檢查,通常因為通氣血流比值失衡,導致患者氧飽和度低,患者PaO2低及PaCO2高,因為胸腔鏡下LVRS 就是矯正患者通氣血流比值,改善心臟每搏輸出量、射血分數,降低肺動脈高壓,提高 FEV1值,因此血氣分析PaO2低及PaCO2高不能作為手術適應證的否定指標,其只能作為術前患者病情嚴重程度標準。相如果術前患者PaO2高及PaCO2低或者二者皆正常,而患者影像學檢查很重,提示這可能是手術禁忌患者,因為這種患者可能是:有通氣功能無血液循環肺組織對通氣血流比值升高和有血液循環無通氣功能肺組織對通氣血流比值減少,達到平衡造成的虛假現象,是患者肺功能已經接近毀損的表現。如果不能辨識這種情況。盲目手術必然破壞這種動態平衡導致患者死亡。同時,最重要的提示就是肺動脈壓的改善,只有肺動脈壓改善,患者的病情才會緩解。不論是手術近期還是遠期對肺動脈壓的糾正均是手術成功和患者獲益的終極指標,選擇手術標準為預計肺動脈壓糾正明顯,患者影像學檢查為以周圍型為主的不均質型的重度肺氣腫,有明確的手術靶區,存在被壓縮的相對正常肺組織,認真計算切除病變肺后對肺功能的改善;醫生同時掌握手術禁忌證,做好術中精細輕柔操作,術后抗感染及營養支持治療,已達到預期治療效果。
本研究同時證實胸腔鏡下LVRS 患者術后,患者飲食、睡眠、平臥、胸悶氣短、登樓試驗均較術前明顯改善,其主要原因是患者胸膜腔容積較術前增大,患者胸廓呼吸動度、膈肌呼吸幅度較術前均增大。患者由于部分壓迫的肺復張,呼吸面積增加,殘留肺組織小氣道輕度過度擴張,肺通氣量增加,二氧化碳潴留及缺氧明顯改善。同時由于患者胸膜腔容積較術前增大,胸廓呼吸動度、膈肌呼吸幅度較術前均增大,由此患者回心血量增加,每搏輸出量增加,患者全身血流灌注明顯增加,從而改善全身各系統功能、登樓平臥改善情況;神經系統缺血缺氧改善,患者睡眠及內分泌好轉;消化系統血流增加,患者胃腸消化吸收功能改善,飲食量增加;營養狀態好轉,肌肉運動能力增加,患者四肢無力好轉。
甘肅地區海拔1 500~5 000 m,由于空氣氧稀薄、氣候干燥寒冷、冬季長等原因,慢性支氣管炎肺氣腫、肺源性心臟病的發病率分別為平原地區的3 倍和9 倍[5]。由于長期缺氧,正常人的PaO2、血氧飽和度均低于平原地區。世居該地區的人們肺活量增大,處于功能性肺氣腫、肺動脈高壓,血液流變學具有高血色素、高黏滯性、高凝特點[6-7]。高原地區患者出現病理性肺氣腫、肺大泡、肺動脈高壓,會增加肺工作負荷,病理性肺氣腫與功能性肺氣腫達到某一極限時出現失代償期,出現呼吸功能不全。LVRS可減少病理性肺氣腫、肺大泡范圍,增加殘余病理性肺氣腫與功能性肺氣腫工作效率,改善通氣血流比值,從病因上緩解病情,起到改善患者癥狀及生活質量的作用。高原地區患者地處低氧、低氣壓、干燥寒冷環境,經歷低氧慢性影響而獲得了更有效的適應。因此,高原地區患者外周化學感受器(主要是頸動脈體)對低氧刺激的敏感性降低,對低氧的通氣反應出現衰退現象[8],術后早期的肺組織代償性過度通氣不明顯,術后肺功能恢復較平原地區患者緩慢。導致與平原地區患者相比,術后早期的容量通氣明顯降低。再加上長期病理性肺氣腫、肺大泡,患者對缺氧的耐受性較正常平原患者要好,因此患者麻醉前后與圍術期各項生理指標與平原患者不同,生理指標恢復也不同。麻醉前的插管指征及麻醉后拔管指征均與普通患者指征不同。術后護理具體內容與其他胸科術后患者也有所不同。也要注意高原手術較平原手術風險要大,需要醫護人員積累經驗。
肺氣腫、肺心病是高原呼吸內科的常見病、多發病,難治愈,重度或終末期肺氣腫內科治療效果不理想,患者5 年生存率僅為25%左右[9]。胸腔鏡下LVRS 可以短期內解除肺氣腫、肺大泡對心臟及正常肺組織的壓迫,從而改善肺循環阻力和體循環血流灌注。改善術后患者通氣血流比值,降低肺動脈高壓,改善心臟每搏輸出量、射血分數,提高FEV1。這種改善僅是相對于肺氣腫患者肺組織漸進性毀損引起的生理性肺功能、心功能降低而言的[10]。患者術前肺動脈高壓主要是由于肺氣腫肺大泡擠壓引起的肺循環阻力增加,以及肺氣腫、肺大泡對心臟的擠壓,因此肺動脈壓的改善是本組患者所有指標改善的基礎。術前必須進行患者殘余肺組織肺氣腫嚴重程度及呼吸面積評估,評估方法主要是核素肺灌注顯像和核素肺通氣顯像,這種評估主要缺點是缺少無功能肺組織的精確定位及范圍,現在采用低劑量增強胸部CT 來評估無功能肺組織,包括有壓迫正常肺組織、有通氣功能無血液循環肺組織和有血液循環無通氣功能肺組織以及無通氣功能和血液循環的肺組織。同時觀察有無肺動脈壁增厚狹窄等不可逆的組織改變。重點是殘余肺組織和術后解放肺組織能否維持生命,根據以往左全肺和右全肺切除經驗確定殘余肺組織和術后解放肺組織的呼吸面積至少大于50%以上,而且不能以術前殘余肺組織,或者術前肺氣腫、肺大泡的面積作為手術適應證。手術的關鍵點是在目前肺功能的基礎上,手術可以改善肺功能指標的程度[10]。
胸腔鏡下LVRS 能明顯改善高海拔地區患者病情及生活質量,是適合經濟欠發達的內陸高原地區治療肺氣腫肺動脈高壓的治療方法。
作者貢獻:梁忠進行研究設計與實施、資料收集整理、撰寫論文并對文章負責;魏振宏、朱子江、金剛進行研究實施、評估、資料收集;虎衛東進行質量控制及審校。
本文無利益沖突。

