印度醫藥產業創新體系發展的經驗借鑒
李雨釗 王東宇,3 劉躍華*
《我不是藥神》上映以來,“仿制藥”的話題討論占據了各大新聞媒體頭條,印度“神藥”再次闖入了公眾視野。印度制藥行業經過30多年的高速發展,已形成以原料藥和仿制藥為核心優勢的醫藥體系。而印度也躋身制藥強國的領域,其中仿制藥的持續增長。據國外知名市場預測機構 Evaluate Pharma數據統計顯示,2017年全球仿制藥營收排名前15藥企中,5家為印度制藥企業,印度成為了“世界藥房”名副其實的仿制藥大國,并且是全球最大的仿制藥輸出國,生產全球20%的仿制藥出口到世界各地,達到了169億美元(約為1 065億元人民幣)[1]。印度制藥業的迅速崛起及壯大得益于印度政府對仿制藥的大力支持以及對醫藥產業創新投入的高度重視。
本研究通過梳理印度近30年來仿制藥的發展歷程,介紹印度醫藥體系的創新發展規劃和布局,探究印度制藥業迅速崛起并躋身仿制藥大國的原因,旨在為中國仿制藥市場的進一步發展提供參考。
1 印度仿制藥的發展歷程
印度仿制藥的發展大致分為3個階段。第1個階段從20世紀70年代開始,印度規定對食品、藥品只授予工藝專利,不授予產品專利,加強對跨國制藥企業的限制,逐漸建立本土制藥企業優勢;第2個階段是從1994年開始,印度進行經濟自由化改革,簽署了《與貿易有關的知識產權協定》(TRIPS協議),并于 1995年加入WTO,這兩項舉措使印度制藥行業逐步確立了全球范圍的競爭優勢[2]。與此同時,印度利用1995—2005年的10年緩沖期大力拓展仿制藥市場,結合仿制藥行業本身的特點,構建了以質量、價格、速度三邊為一體的,圍繞政策為核心的“印度仿制藥金三角模型”;第3階段從2010年開始,印度恢復對醫藥產品的專利保護制度,同時對印度醫藥制度進行改革,加大研發投入,重點布局生物仿制藥,執行專利制度促進醫藥產業的創新發展。具體發展歷程見表1。
由表1可知,印度雖然在第3階段恢復了醫藥產品的專利保護制度,但是印度政府營造的專利制度環境仍然對本土制藥企業有強烈的保護意識,在一定程度上對跨國制藥公司產生了限制作用。
比如印度政府推出“專利強制許可制度”,規定在一些特定條件下可對藥品專利行使強制許可權,強制許可適用于:公眾對該專利發明的合理需求未得到滿足,或者公眾不能以可支付價格獲取該專利發明,或者該專利發明未在印度領土范圍內使用[3]。2012年3月,印度第一個強制許可案例誕生:對拜耳公司生產的肝癌治療藥物索拉非尼啟動了強制許可[4];2013年 1月,印度對羅氏公司開發的乳腺癌治療藥物赫賽汀(注射用曲妥珠單抗)、百時美施貴寶(BMS)公司開發的抗腫瘤藥物伊沙匹隆和白血病治療藥物達沙替尼進行了強制許可[5]。
除了專利強制許可,跨國制藥公司還面臨被取消或拒絕授予專利的情況:2006年1月,駁回了格列衛的專利申請,拒絕了默克公司哮喘病治療藥物的專利申請,取消了輝瑞公司癌癥治療藥物索坦的專利保護,拒絕授予阿斯利康的癌癥治療藥物易瑞沙專利保護。
2 印度醫藥產業的創新體系
2.1 國家創新體系布局
印度科學和技術部于 1986年建立了生物技術部。印度科技部長啟動了一項計劃,提供稅收優惠和補助金支持生物技術企業初創和擴張,并建立印度生物技術園區協會,計劃 2010年以前支持建立10個生物科技園區。各邦政府為吸引生物科技企業提供優惠,如免征增值稅、提供資金、土地和資源援助。
印度政府于 2010年創建國家創新委員會(NINC),制定了2010—2020年的創新規劃路線圖,并于2013年推出了新的科學、技術和創新政策。
1)支持萬眾創新計劃。印度重點扶持基層創新,并推出包容性創新基金(IIF),預計動員32億美元,支持為解決基層百姓實際問題開展研發的企業。2000年成立印度國家創新基金會,支持在不同創新階段的創新者[6]。
2)加大創新人才培育力度。國家技能發展局(NSDA)通過統籌和協調政府和私營部門,加強科技人力資源開發力度。例如印度工業聯合會(CII)開設技能訓練中心,教授科技人員工業技術,并建立CII-HPCL項目加強地方青年科技人員培訓[6]。
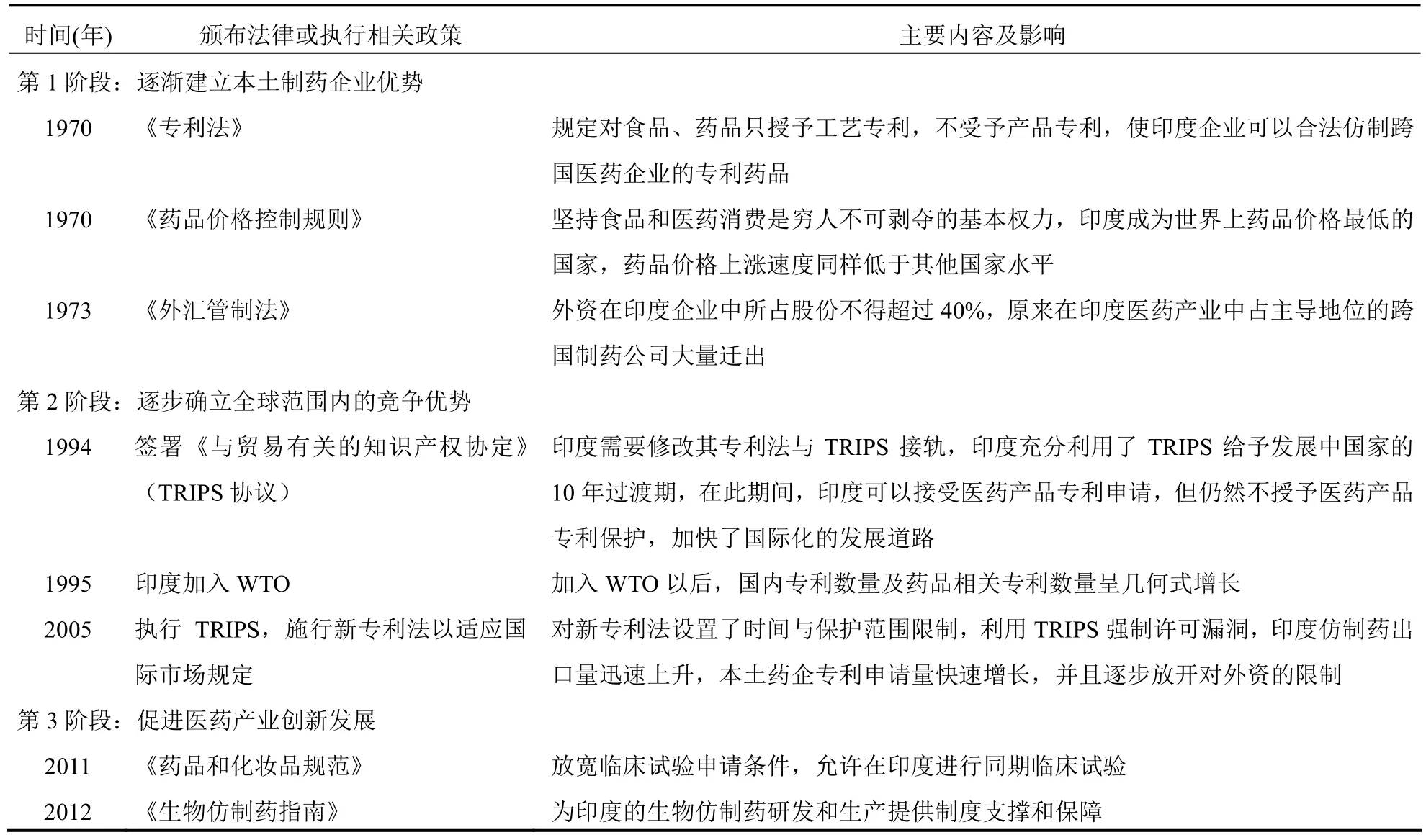
表1 印度仿制藥的發展歷程
2.2 鼓勵創新的核心政策措施
印度科技發展和企業創新活動獲得了政府系統的支持。為了促進創新發展,印度政府大力投入R&D,利用財稅政策和法律法規等,保障創新主體積極性,引導鼓勵企業和科研院所積極開展創新活動。
1)加強戰略規劃引領。印度科技部自 1958年起連續制定多輪科技戰略,為各領域科技發展和創新體系建設提供了系統支撐。2013年,科技部突出了向創新驅動發展模式的轉變,提出了《科學、技術與創新政策2013—2017》,設定了包括醫藥在內的若干重點領域[7]。
2)加大中小企業支持。科學技術部發起小企業創新研究計劃(SBIRI),培育和指導創新的新興技術和企業家。SBIRI的一個顯著特點是特別支持通過概念驗證的前期高風險生物技術研究,以及有創新與科學背景的中小企業后期發展,支持醫療保健、食品和營養、農業的技術商業化。
2.3 醫藥科技創新措施
印度醫藥創新是以仿制藥作為發展起源的創新。政府通過只授予食品和藥品工藝專利,不授予產品專利的方法,刺激了印度廉價仿制藥的研發;通過對臨床研究低利率貸款援助、加大對基礎配套措施的完善和對研究人員的培訓,提高了藥企仿制藥創新能力。
印度政府于20世紀60年代開始鼓勵印度本土企業生產藥品,并在1970年推出專利法,規定對食品、藥品只授予工藝專利,不授予產品專利,允許印度企業逆向制作或復制國外專利藥品,不用支付許可證費用[8]。在這一政策下,本來占有大部分印度市場的跨國公司因失去專利保護逐漸退出,印度企業抓住機會,并利用已掌握的專業知識和低成本制藥技術,逐漸擴大本土的仿制藥市場占有額。同時,印度注重走國際化道路,擴大藥品出口,向海外領域建立子公司并開啟跨國并購模式,借機成為主要的臨床研究外包基地以及合同定制生產及研究基地,使印度的仿制藥逐漸在全球占據市場地位[9]。目前一些規模較大的制藥企業也進軍藥物創新市場。
作為仿制藥大國,印度計劃致力于發展新藥物開發和創新并制定了“醫藥 2020年遠景規劃”,目標在2020年成為世界前5位的醫藥創新基地。政府提供世界一流的基礎設施、具有國際競爭力的制藥研發科學人才和公共或私人領域的風險投資基金支持規劃,同時提出數十億美元的公私合作伙伴關系(PPP)模式,并投入50%公共資金,以充分利用印度的創新能力。政府也采取各種政策措施,其中包括制藥業和研發支出稅收減免,簡化涉及新的藥物分子的發展過程和臨床研究等,以及推出《新千年印度技術領導倡議藥品和醫藥研究計劃》促進印度的制藥研究[8]。
為了進一步推動印度的醫藥創新,印度政府實行如下創新政策,共分為 5個階段:研發階段,前期臨床階段,臨床研究階段,審批階段以及市場階段。在研發階段,印度政府提供一流的配套基礎設施,同時給予財政的大力支持;在前期臨床階段,避免重復研究,提高臨床研究進展效率;在臨床研究階段,添加試點和研究人員,并為臨床研究提供低利率的援助貸款;在最后的市場階段,仍然堅持專利保護制度、扶持本土企業的原則,并且支持非專利仿制藥出口(圖1)。
3 小結
印度醫藥企業的創新是依托仿制藥的發展壯大而進一步發展的。政府通過刪除食品和藥物的成分專利,刺激了印度廉價仿制藥層出不窮,又通過對臨床研究低利率的貸款援助以及基礎配套措施的完善和研究人員的培訓,為各大藥企從仿制藥到創新提供了可能。在印度政府多年持續不斷的研發投入以及國際化耕耘后,印度制藥企業建立起了全球最具競爭力的仿制藥研發生產體系。
印度是名副其實的仿制藥大國。2017年全球7大仿制藥公司中,印度就占了兩席。印度目前是全球仿制藥最大的輸出國,有近3000家仿制藥企業,生產了全球 20%仿制藥,并出口到世界各地。印度仿制藥價格是專利藥的1/10,效果卻不相上下。通過對仿制藥規則的巧妙利用,印度專利法中規定“保護整個生產工藝和過程,但如果工藝和過程發生改變,其相應的產品并不受到原專利的約束”。于是,印度企業采取“反流程工藝”,將西方專利藥物工藝略加改造,或添加一些所謂活性成分,獲得印度稱之為“簡明新藥”的專利,以低價在全球銷售。

圖1 印度醫藥創新政策配套措施
4 討論
印度制藥取得如此矚目的成績,追根溯源是印度政府認識到創新是制藥行業持續發展的不竭動力,并且在專利過渡期內大力發展仿制藥行業,同時結合印度制藥企業適當的海外并購措施,逐步將印度“神藥”推廣至全世界。
中國與印度同為發展中國家,并且都是仿制藥大國。但是中國的大型藥廠卻長期停留在仿制藥品的階段,在制藥領域的研發能力遠落后于印度及其他跨國制藥企業。基于此,中國在堅持自己醫藥發展戰略的同時,應吸收接納印度制藥的一些先進經驗。1)中國應借鑒印度仿制藥“仿中有創”的研藥制藥戰略,積極推進仿制藥的一致性評價,全面提高藥企的生產水平,增強國產仿制藥的競爭力。2)在推進仿制藥一致性評價的同時,政府更要加大研發投入力度,不僅要增加研發資金的投入,還應增加研發人員的投入,加快培養一批具有開創性意識的國際型人才,積極鼓勵海外留學的醫藥人才回國發展。3)在注重專利保護的同時,更要注重醫藥創新發展,創新是藥品核心競爭力所在,我國應在傳統中醫藥等特色領域加大創新研發投入,將中藥做大做強并向國際化邁進,積極參與國際合作。

