基于單中心的早期CRRT治療在嚴重腹腔感染中的前瞻對照研究
吳 媛 王小闖 王 利 黨雙鎖
腹腔感染(intra-abdominal infections,IAI)合并膿毒癥或膿毒性休克是重癥監護病房的常見病,其主要病因為空腔臟器穿孔或破裂,導致消化道內容物或消化液進入腹腔內引起腹膜炎或腹腔膿腫,最終可導致多器官功能障礙綜合征(multiple organ dysfunction syndrome,MODS),病死率高達10%~40%,預后極差[1]。連續性腎臟替代治療(continuous renal replacement therapy,CRRT)又稱連續性血液凈化(continuous blood purification,CBP),早期多應用于腎臟疾病的替代治療,但隨著此項技術的改進和概念更新,CRRT的臨床應用范圍已遠超單純腎臟疾病范疇,成為急危重癥救治領域的重要支持技術[2~4]。隨著CBP治療范圍的擴展,對嚴重腹腔感染患者早期開展CRRT治療的研究成為研究熱點之一。本研究選取筆者醫院重癥醫學科2012年1月~2018年9月收治的124例發生嚴重腹腔感染患者作為研究對象,探討早期CRRT治療對嚴重腹腔感染患者細胞免疫及炎癥因子水平的影響及其臨床價值。
資料與方法
1.一般臨床資料:選取2012年1月~2018年9月在西安交通大學第二附屬醫院重癥醫學科住院治療的124嚴重腹腔感染患者為研究對象,其中男性66例,女性58例;患者年齡43~87歲,平均年齡52.78±7.56歲;基礎疾病:高血壓病23例,糖尿病34例,高血壓合并糖尿病12例,冠心病5例,腫瘤19例,慢性阻塞性肺疾病21例。記錄兩組患者治療前、治療7天時的急性生理與慢性健康評分(APACHEⅡ)、序貫器官衰竭(SOFA)評分、ICU住院天數及28天病死率。
2.病例納入標準及排除標準:所有入選患者均符合腹腔感染的診斷標準[1]:①發熱、腹痛、腹脹或明顯的腹膜炎體征;②腹腔引流液或穿刺液細菌學培養陽性;③影像學檢查或再次手術證實腹腔內感染病變的存在。膿毒癥診斷標準依據美國重癥醫學會(Society of Critical Care Medicine,SCCM)與歐洲重癥醫學會(European Society of Intensive Care Medicine,ESICM)聯合發布膿毒癥管理指南定義及診斷標準[5,6]。排除標準:年齡<14歲;妊娠及哺乳期婦女;合并血液病或前3個月內接受皮質激素或其他免疫抑制劑、免疫調節劑治療者;終末期臟器衰竭,可能成為死亡主因者;HIV檢測陽性者;ICU停留時間<7天者。
3.研究方法:本研究經筆者醫院臨床試驗與倫理學委員會批準,將入選患者采用數字表法隨機分為CRRT治療組65例和常規治療組59例。根據患者病情選擇常規集束化治療措施,包括血培養、腹腔引流液培養、耐藥菌感染評估、1h內啟動抗感染治療、合理的感染灶控制措施、液體復蘇、控制目標血糖、腸內營養支持、腸外營養支持、預防應激性潰瘍和深靜脈血栓形成、抗菌藥物治療、必要時機械通氣、鎮靜與鎮痛治療等。CRRT治療組在常規集束化治療基礎上每日加用CRRT治療,均采取中心靜脈置管,以股靜脈置管為主,其次為頸內靜脈。采用瑞典金寶公司Prisma flex連續性血液凈化裝置,使用AN69 HF空心纖維,材料為甲基丙烯磺酸鈉-丙烯晴共聚物,治療模式為連續性靜脈-靜脈血液濾過(continuous venous-venous hemofiltration,CVVH),每次持續8~24h,每日血液濾過置換液總量24~50L。治療過程中根據患者出凝血時間及有無出血及肝功能情況等選擇枸櫞酸抗凝治療、低分子肝素抗凝治療[初始劑量20~40U/kg,維持量5~15U/(kg·h)]或無肝素治療。治療7天后,CRRT組進行常規治療措施,病情需要的情況下可繼續連用CRRT治療。
4.觀察指標:觀察兩組患者治療前及治療 1、3、5、7天時PCT、IL-6、IL-10、TNF-α水平及T淋巴細胞亞群比例變化,以及兩組患者治療7天時的SOFA評分、APACHEⅡ評分、ICU住院天數(天)及28天病死率。
5.標本的采集及檢測:所有患者于入院當天及治療 1、3、5、7天空腹抽取靜脈血6ml,其中3ml采用肝素抗凝,離心取血清后,于-80℃冰箱凍存,采用酶聯免疫吸附試驗檢測PCT、IL-6、IL-10、TNF-α水平,嚴格按試劑盒說明書操作步驟進行;另外3ml應用流式細胞儀檢測血T淋巴細胞亞群比例,嚴格按照操作規程進行。
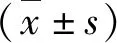
結 果
1.一般臨床資料:124例嚴重腹腔感染患者納入研究,其中男性66例,女性58例;患者年齡43~87歲,平均年齡52.78±7.56歲。兩組患者性別、年齡、基礎疾病、腎功能指標、APACHE Ⅱ評分及SOFA評分比較,差異無統計學意義(P均>0.05),兩組患者具有可比性(表1)。
2.兩組患者治療前后炎癥及免疫指標變化比較:兩組患者治療前PCT、 IL-6、IL-10、TNF-α水平,血T淋巴細胞亞群比例比較差異均無統計學意義(P均>0.05);而隨著治療時間延長,兩組 PCT、IL-6、IL-10、TNF-α均呈逐漸下降趨勢,CD3+、CD4+細胞比例呈逐漸升高趨勢。與常規治療組相比, CRRT治療組于治療3天起PCT、TNF-α水平明顯降低,治療5天起IL-6、IL-10水平明顯降低,治療7天起CD3+細胞比例明顯升高,治療5天起CD4+細胞比例明顯升高,差異均有統計學意義(P均<0.05,圖1)。

表1 兩組嚴重腹腔感染患者一般資料比較
*為偏態分布資料用

圖1 不同治療方法兩組嚴重腹腔感染患者治療前后不同時間點炎癥及免疫指標的變化比較與本組治療前比較,*P<0.05,與常規治療組比較,#P<0.05
3.兩組患者治療指標比較:CRRT治療組與常規治療組治療7天時SOFA評分、APACHEⅡ評分及ICU住院天數明顯低于常規治療組,差異有統計學意義(P均<0.05)。同時,CRRT治療組患者28天病死率與常規治療組比較,差異無統計學意義(P>0.05,表2)。
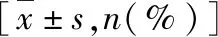
表2 兩組患者治療指標比較
討 論
嚴重腹腔感染的發生與腹腔內空腔臟器穿孔或破裂直接相關,多發生于消化道穿孔、破裂及腸吻合口破裂合并的繼發性腹膜炎,也可能是發生在原發性或繼發性腹膜炎治療失敗后的復發性腹膜炎或持續性腹膜炎[7]。嚴重腹腔感染合并膿毒癥或膿毒性休克后,引發炎性介質大量釋放以及機體免疫功能紊亂,最終導致MODS甚至衰竭,病死率極高。盡管現代醫學手段取得了長足的進步,但嚴重腹腔感染仍是危重癥患者死亡的主要原因之一。
近年來通過早期CRRT治療清除炎性因子或內毒素來治療腹源性膿毒癥也受到越來越多關注。CRRT的應用不僅局限于腎臟疾病領域,在危重癥尤其是重癥感染患者中也占有特殊地位,為危重患者的救治提供了重要的、賴以生存的機體內環境,為多器官功能的恢復提供了支持[8~12]。CVVH模式主要通過對流的方式清除體內溶質。通過CVVH治療將體內過多的促炎性因子清除是膿毒癥的潛在治療手段。吸附也是血液凈化治療清除溶質的重要機制。由于吸附治療對大分子物質清除效果更好,因此吸附治療在膿毒血癥中對炎性因子、內毒素等大分子物質的清除更為重要。雖然對流是CVVH對溶質清除的主要機制,但在CVVH過程中仍存在一定程度的非特異性吸附。這種非特異性吸附作用與透析器的材料有關。研究發現聚丙烯腈膜及其改良的AN69 ST膜對炎性因子的吸附作用優于其他種類透析膜[13]。
目前臨床上常用的評價感染后炎性反應的指標有PCT、IL-6、IL-10、TNF-α。正常情況下,PCT由甲狀腺的髓質細胞分泌,在體內穩定,不會降解為激素樣活性的降鈣素,也不會存在于外周血液中。研究表明,PCT 與細菌感染具有相關性,并將其作為診斷標準之一[14]。PCT 水平在感染性疾病患者外周血中升高,腹腔感染時尤為明顯,且持續時間較長。IL-6由淋巴細胞、上皮細胞、巨噬細胞分泌,是一種急性期炎癥的重要細胞因子,在嚴重感染病程中能被內毒素誘導,造成全身性免疫抑制,加速機體炎性反應進程[11]。IL-10是一種多細胞源、多功能的細胞因子,調節細胞的生長與分化,參與炎性反應和免疫反應,是目前公認的炎癥與免疫抑制因子。在腫瘤、感染、器官移植、造血系統及心血管系統中發揮重要作用 。TNF-α是由單核-吞噬細胞產生的細胞因子,在免疫系統中起著非常重要的調控作用。在炎性反應的急性期,血漿TNF-α可影響血管內皮細胞活性,并對血管炎癥過程有調控作用。但是,TNF-α過度表達可引起炎性反應失控,加重組織損傷,甚至導致全身性炎性反應[15]。
本研究結果顯示,嚴重腹腔感染患者CRRT治療組在CRRT治療前血 PCT、IL-6、IL-10、TNF-α水平與常規治療組比較差異無統計學意義,治療后則呈逐漸下降趨勢,且明顯低于常規治療組,差異有統計學意義。這可能與CRRT治療能穩定內環境,有效清除循環中炎性介質及內毒素,從而減少炎性反應所致組織損傷及控制炎癥進展有關[16]。通常CVVH使用濾器中位截留相對分子質量為10000~20000,而PCT及細胞因子相對分子質量多>10000(PCT:13000;IL-6:26000;IL-10:18000;TNF-α:17000),這說明常規CVVH較難清除炎性因子。在CVVH過程中也存在一定程度的非特異性吸附。由于聚丙烯腈膜及其改良的AN69 ST膜對炎性因子的吸附作用優于其他種類透析膜,因此本研究中PCT、IL-6、IL-10、TNF-α水平隨著治療時間延長逐漸下降,可能與應用Prisma flex連續性血液凈化裝置,使用材料為甲基丙烯磺酸鈉-丙烯晴共聚物的AN69 HF濾器有關。
T淋巴細胞亞群的數量和比例是反映機體細胞免疫功能狀態的重要指標。CD3+、CD4+均是T淋巴細胞主要的表面抗原標志物, 其作為免疫效應細胞在直接殺傷靶細胞進行免疫調節等方面發揮著重要的作用,已經被普遍用于免疫功能評估。本研究結果表明, 嚴重腹腔感染患者血清CD3+及CD4+T細胞水平均低于正常水平,這與免疫細胞的凋亡及自噬能力下降有關[17]。CD3+可用作T細胞總數的計數[18];而T細胞的免疫調節作用主要通過CD4+T細胞完成,其分泌淋巴因子,激活、趨化巨噬細胞,促進巨噬細胞吞噬功能等[19]。在重癥感染時,CD8+細胞興奮,抑制CD4+細胞增殖,使其數量減少,導致免疫應答受損,而機體免疫應答下降可造成感染難以控制,形成惡性循環[20]。本研究結果顯示,嚴重腹腔感染患者CRRT治療組CRRT治療前患者CD3+細胞及CD4+細胞比例與常規治療組比較差異無統計學意義,而治療后則逐漸升高,且明顯高于常規治療組,差異有統計學意義。這可能與CRRT治療改善了感染患者單核細胞功能,重建免疫穩態有關。
嚴重腹腔感染患者的病情進展主要是由于毒素或者炎性介質在對血流動力學造成影響后,引起多器官組織細胞缺血、缺氧,最終導致多器官衰竭(multiple organ failure, MOF)。本研究結果顯示,CRRT治療組患者治療7天時SOFA評分、APACHEⅡ評分及ICU住院天數明顯低于常規治療組,考慮與CRRT治療在清除炎性介質、調節機體免疫功能等方面的作用有關,從而達到延緩病情快速進展,減少ICU住院天數的目的。本研究結果顯示CRRT治療組和常規治療組在28天病死率比較差異無統計學意義,這與Payen等[21]及Shum等[22]研究結果一致。
綜上所述,在嚴重腹腔感染治療早期,CRRT治療可以明顯清除患者體內炎性介質,恢復免疫穩態,延緩病情的快速進展,為綜合治療提供了時機和條件,但仍需開展前瞻性、多中心、大樣本隨機對照研究進一步證實。

