靶向調控TOX3基因對乳腺癌細胞增殖及周期的影響
韓翠翠 劉立琨 王玉春 楊 瑩 馬立威
研究認為乳腺癌發病機制可能與惡性表征相關基因的異常有關。TOX3為高遷移率(high mobility group,HMG)蛋白家族成員3基因,又名三核苷酸重復9基因(trinucleotide repeat-containing gene 9,TNRC9),CAG三核苷酸重復基因F9 基因(CAG trinucleotide repeat-containing gene F9,CAGF9)[1]。近年來,越來越多的研究報道,TOX3可能參與腫瘤的發展。在不同人群的全基因組關聯分析(genome-wide association study,GWAS)中發現TOX3與乳腺癌易感性相關,其在乳腺癌組織中高表達,且與臨床TNM分期分級以及淋巴結轉移具有相關性,但其在乳腺癌發生、發展進程中的生物學功能以及調控機制尚不清楚[2~7]。因此,本研究在前期構建穩定沉默和過表達TOX3基因細胞模型的基礎上,初步探討靶向調控TOX3基因的表達對乳腺癌細胞增殖活性以及周期的影響,為進一步探討TOX3基因在乳腺癌惡性病變過程中的生物學功能奠定研究基礎。
材料與方法
1.材料:人乳腺癌ZR-75-1細胞、MDA-MB-231細胞購自中國科學院上海細胞庫,穩定沉默TOX3基因的的乳腺癌細胞(TOX3-shRNA細胞)、陰性對照細胞(LV3-NC細胞)、穩定過表達TOX3基因乳腺癌細胞(MDA-MB-231-TOX3細胞)和陰性對照細胞(MDA-MB-231-NC細胞)模型均由本實驗室構建;L-15培養基和1640培養基、胰蛋白酶、胎牛血清均購自美國Gibco Technology 公司;BCA 蛋白定量試劑盒和ECL高靈敏度化學發光試劑盒均購自北京康為世紀生物科技有限公司;TOX3兔抗人單克隆抗體購自英國Abcam公司;GAPDH鼠抗人多克隆抗體購自北京康為世紀生物科技有限公司;抗兔二抗和抗鼠二抗均購自美國Cell Signaling Technology公司;細胞周期與細胞凋亡檢測試劑盒購自碧云天生物技術有限公司。
2. 方法:將已構建的穩定沉默TOX3的乳腺癌ZR-75-1細胞系分為空白對照組(ZR-75-1細胞)、陰性對照組(LV3-NC細胞)和TOX3干擾組(TOX3-shRNA細胞);穩定過表達的MDA-MB-231細胞分為空白對照組(MDA-MB-231細胞)、陰性對照組(MDA-MB-231-NC細胞)和TOX3過表達組(MDA-MB-231-TOX3細胞)。(1)Western blot法檢測穩定轉染后乳腺癌細胞TOX3蛋白的表達:將各組細胞接種于60mm培養皿中,待細胞融合度達到80%左右,收集各組細胞,各組細胞按照一定比例加入含有PMSF蛋白酶抑制劑的RIPA強效裂解液,冰上提取總蛋白,離心,收集蛋白液。BCA法檢測提取蛋白液濃度并進行定量,經變性后,取20μg蛋白進行聚丙烯酰胺凝膠電泳,轉膜,BSA封閉液4℃封閉,過夜。按照1∶2000比例加入TOX3單克隆抗體,1∶3000比例加入GAPDH抗體,室溫孵育3h后,洗膜3次。1∶3000比例加入抗兔二抗和抗鼠二抗,室溫孵育2h,洗膜,ECL化學發光試劑顯影,曝光。(2)MTT法檢測過表達和干擾TOX3對MDA-MB-231和ZR-75-1細胞增殖活性的影響:將各組細胞常規消化,計數,使細胞密度為3000個/孔,接種于96孔板內,每組平行設5個復孔,過夜。次日棄掉舊培養基,每孔加入200μl新鮮L-15或1640培養基,繼續培養。于檢測當日加入20μl 5mg/ml的MTT溶液(注意避光),37℃孵育4h,終止培養,吸出上清液,每孔加入150μl DMSO溶液,室溫充分震蕩使結晶溶解。應用酶標儀檢測570nm波長處各孔吸光度值,觀察第0~7天的細胞增殖活性的變化。(3)平板單克隆實驗檢測過表達TOX3對MDA-MB-231細胞單克隆形成能力的影響:將過表達TOX3的MDA-MB-231各組細胞常規消化,計數,以3000個/孔細胞密度接種于6孔板內,于培養箱內常規培養,視生長狀況換液,連續培養14天后,吸去舊培養基,PBS清洗兩次。采用冰甲醇固定10min,PBS清洗,結晶紫溶液染色10min,洗去結晶紫。計細胞數>50個的集落數,計算集落形成率。集落形成率(%)=計數細胞集落數/細胞總數×100%。(4)流式細胞術檢測穩定沉默和過表達TOX3基因后乳腺癌細胞周期變化:將各組細胞常規消化,以1×106個/孔的細胞密度接種于6孔板中,37℃培養過夜。常規消化細胞,收集細胞懸液到離心管中,2000r/min離心5min,棄掉上清。加入預冷的PBS懸浮細胞,2000r/min離心5min。棄掉上清液,再次加入預冷的PBS重懸細胞,離心。棄上清,加入預冷的70%乙醇,輕輕吹散細胞,4℃固定,過夜。離心,棄掉乙醇,加入預冷的PBS重懸細胞。離心,棄掉PBS,每個樣品加入0.5ml配制好的碘化丙啶染色液,重懸細胞,37℃避光反應30min,用流式細胞儀檢測各組細胞周期的變化。
結 果
1.穩定轉染后乳腺癌細胞TOX3蛋白的表達:Western blot法檢測已構建的穩定沉默TOX3的乳腺癌ZR-75-1細胞系和穩定過表達TOX3的乳腺癌MDA-MB-231細胞系內TOX3蛋白的表達。實驗結果顯示,轉染ZR-75-1細胞后,與陰性對照組比較,TOX3干擾組(TOX3-shRNA細胞)TOX3蛋白表達水平明顯降低(P<0.05,圖1)。轉染MDA-MB-231細胞后,與陰性對照組比較,TOX3過表達組(MDA-MB-231-TOX3細胞)TOX3蛋白表達水平明顯升高(P<0.05,圖2)。

圖1 穩定沉默TOX3的ZR-75-1細胞TOX3蛋白的表達與陰性對照組比較,*P<0.05

圖2 穩定過表達TOX3的MDA-MB-231細胞TOX3蛋白的表達與陰性對照組比較,*P<0.05
2.過表達和干擾TOX3基因對MDA-MB-231和ZR-75-1細胞增殖的影響:采用MTT實驗觀察過表達TOX3基因對MDA-MB-231細胞增殖活性的影響。實驗結果顯示,0~7天內空白對照組與陰性對照組細胞的增殖活性比較差異無統計學意義,TOX3過表達組隨著時間的推移細胞的增殖活性增強(圖3)。干擾TOX3后,ZR-75-1細胞增殖活性降低(圖4)。

圖3 過表達TOX3基因對MDA-MB-231細胞增殖的影響與陰性對照組比較,*P<0.05

圖4 干擾TOX3基因對ZR-75-1細胞增殖的影響與陰性對照組比較,*P<0.05
3.過表達TOX3對MDA-MB-231細胞單克隆形成能力的影響:采用平板克隆實驗檢測過表達TOX3對細胞單克隆形成能力的影響。與空白對照組比較,陰性對照組細胞集落形成率無明顯變化;與陰性對照組比較,TOX3過表達組細胞的集落形成率明顯增大,單克隆形成能力增強(P<0.05,圖5)。
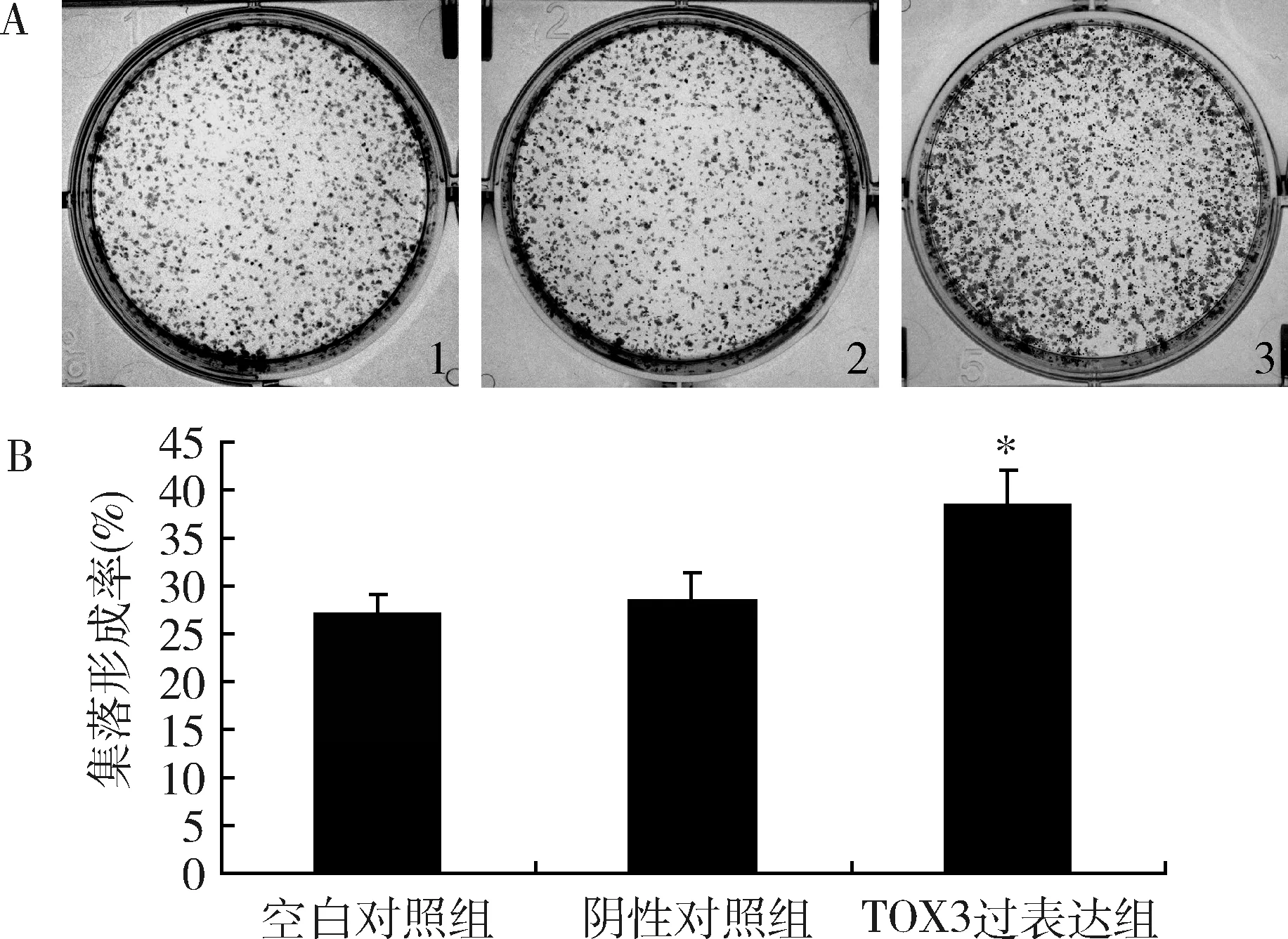
圖5 過表達TOX3基因對MDA-MB-231細胞單克隆形成的影響A.各組細胞平板克隆形成圖;B.各組細胞平板克隆分析圖;1.空白對照組;2.陰性對照組;3.TOX3過表達組;與陰性對照組比較,*P<0.05
4.干擾TOX3基因對ZR-75-1細胞周期的影響:流式細胞術檢測干擾TOX3基因對ZR-75-1細胞周期的影響。與空白對照組比較,陰性對照組各周期細胞比例無明顯變化。與陰性對照組比較,TOX3干擾組細胞G0/G1期細胞比例明顯增加(P<0.05),G2/M期細胞比例減少(P<0.05),而S期有減少的趨勢但差異無統計學意義(P>0.05,表1,圖6)。

表1 干擾TOX3基因對乳腺癌細胞周期的影響
與陰性對照組比較,*P<0.05
5.過表達TOX3基因對MDA-MB-231細胞周期的影響:流式細胞儀檢測過表達TOX3對MDA-MB-231細胞周期的影響。空白對照組與陰性對照組各周期細胞比例比較差異無統計學意義。與陰性對照組比較,過表達TOX3組G0/G1期細胞所占比例減少,G2/M期細胞比例明顯增多(P<0.05),而S期差異無統計學意義(P>0.05,表2,圖7)。

圖6 干擾TOX3基因對乳腺癌細胞周期的影響A.空白對照組;B.陰性對照組;C.TOX3干擾組

表2 過表達TOX3基因對MDA-MB-231細胞周期的影響
與陰性對照組比較,*P<0.05
討 論
近年來,研究發現TOX3與腫瘤的發展相關。組織學分層分析表明TOX3多態性位點rs3803662的基因分型CT/TT與彌漫型胃癌較好的生存期相關[8]。TOX3基因的變異體可能在慢性粒細胞白血病早期診斷和治療中起重要作用[9]。另有研究發現,在HIV感染的肺癌組織中,TOX3 mRNA的表達高于相應的癌旁組織,表明TOX3可能與HIV感染的肺癌相關[10]。然而越來越多的研究表明TOX3基因與乳腺癌密切相關。

圖7 過表達TOX3基因對MDA-MB-231細胞周期的影響A.空白對照組;B.陰性對照組;C.TOX3過表達組
近年來,在不同人群中的GWAS研究發現,TOX3與乳腺癌的發展密切相關[2~6]。研究顯示,含有多個TOX3危險等位基因的患者大大增加了患乳腺癌的風險,且TOX3基因多態性明顯增加了家族乳腺癌的風險[11,12]。GWAS研究發現,TOX3基因上的多態性位點與雌激素受體陽性乳腺癌具有較強的相關性,可作為絕經前和絕經后女性乳腺癌患病風險的預測因子之一[13]。此外,研究發現TOX3在雌激素受體陽性的乳腺細胞中表達,且在乳腺癌腫瘤中高表達,TOX3的高表達與Luminal B型乳腺癌不良預后相關。降低TOX3的表達,Luminal B型乳腺癌細胞增殖的能力下降,但TOX3在乳腺癌發生、發展中的生物學功能尚不清楚[14]。
研究發現,與正常乳腺組織比較,TOX3蛋白在乳腺癌組織中呈高表達,且其表達水平與臨床TNM分期和分級呈顯著相關[7]。Shan等[15]研究也發現,與正常乳腺組織比較,TOX3在乳腺癌尤其是晚期乳腺癌組織內高表達,且發現其可下調BRCA1的表達,使乳腺癌細胞侵襲和轉移能力增強。沉默TOX3的表達,可抑制人乳腺癌細胞MCF-7和ZR-75-1細胞增殖,其體內研究進一步證實干擾TOX3基因后,成瘤率明顯降低,且形成的腫瘤也明顯減小。以上研究證實,TOX3基因參與了乳腺癌發展進程,并發揮重要作用。
筆者前期研究應用慢病毒表達載體成功構建了穩定過表達TOX3的乳腺癌MDA-MB-231細胞模型和穩定沉默TOX3的乳腺癌ZR-75-1細胞模型[16]。本研究在此基礎上檢測已構建的穩定沉默TOX3的乳腺癌ZR-75-1細胞系和穩定過表達TOX3的乳腺癌MDA-MB-231細胞系內TOX3蛋白的表達。結果顯示轉染ZR-75-1細胞后,TOX3干擾組TOX3蛋白表達水平明顯降低。轉染MDA-MB-231細胞后,TOX3過表達組TOX3蛋白表達水平明顯升高。在此基礎上采用MTT法及平板單克隆實驗檢測TOX3對MDA-MB-231細胞增殖能力的影響,結果發現過表達TOX3基因可使MDA-MB-231細胞增殖和單克隆形成能力增強,干擾TOX3基因可使ZR-75-1細胞的增殖能力下降,這與Shan等[15]研究發現的干擾TOX3基因乳腺癌細胞的增殖能力下降結果相符。
腫瘤是一種由多原因導致細胞周期紊亂性疾病。研究認為細胞周期中 G2/M期和S期所占的百分比可反映細胞的增殖活性[17]。本研究應用穩定沉默和過表達TOX3基因的乳腺癌細胞模型,采用流式細胞術分別檢測干擾和過表達TOX3對乳腺癌細胞周期的影響,結果發現干擾ZR-75-1細胞TOX3基因的表達后,G0/G1期細胞的比例顯著上升,G2/M期細胞明顯減少,S期細胞比例有減少趨勢,但差異無統計學意義。以上結果表明TOX3基因沉默后,生長停滯在G0/G1期不能進入DNA合成期的細胞比例增多,細胞的增殖活性減弱。過表達TOX3基因后,MDA-MB-231細胞G0/G1期細胞百分比減小,G2/M期細胞所占百分比增大,而S期細胞比例沒有明顯變化,細胞增殖活性增強。以上結果提示TOX3基因可通過調控乳腺癌的細胞周期而影響細胞增殖。
綜上所述,本研究發現靶向調控TOX3基因的表達可改變乳腺癌細胞增殖和單克隆形成能力,影響乳腺癌細胞周期。

