不同類型水生植物對(duì)水化學(xué)性質(zhì)影響差異研究
張 乾 柱李 玉 秀蘇 玲
(1.重慶交通大學(xué) 建筑與城市規(guī)劃學(xué)院,重慶 400074; 2.長(zhǎng)江科學(xué)院 重慶分院,重慶 400026; 3.自然資源部 廣西巖溶動(dòng)力學(xué)重點(diǎn)實(shí)驗(yàn)室,廣西 桂林 541004)
作為水域生態(tài)系統(tǒng)的重要組成部分,水生植物通過(guò)光合作用和呼吸作用影響水-巖-氣之間的相互作用以及水中溶解無(wú)機(jī)碳(DIC)的穩(wěn)定性,進(jìn)而引起水化學(xué)動(dòng)態(tài)變化[1-2]。水化學(xué)性質(zhì)的空間、季節(jié)甚至?xí)円棺兓饾u受到人們的重視[3-5]。對(duì)水化學(xué)性質(zhì),尤其是對(duì)水中DIC的來(lái)源、轉(zhuǎn)化及其影響因素的監(jiān)測(cè),也成為了研究全球碳循環(huán)的重要手段。
然而,不同類型的水生植物利用的碳源(CO2或HCO3-)[6]、根際環(huán)境[7]等有所差別,進(jìn)而會(huì)對(duì)水化學(xué)性質(zhì)產(chǎn)生不同影響。由于氣體CO2在水中的擴(kuò)散受到限制,沉水植物進(jìn)行光合作用更傾向于利用水中HCO3-作為碳源,而挺水植物則可以更多地利用大氣中的CO2。對(duì)桂林會(huì)仙濕地研究發(fā)現(xiàn),盡管挺水植物的固碳量大于沉水植物,但沉水植物固定的碳77.27%~100%來(lái)自于水中HCO3-,挺水植物固定的碳則只有17.65%~35.07%來(lái)自于水中HCO3-,其余部分來(lái)自于大氣CO2[8]。另外,沉水植物分布的水域,溶解氧(DO)主要受沉水植物光合作用和呼吸作用影響,往往與HCO3-濃度表現(xiàn)出相反的變化特征[4]。而在挺水植物分布的水域,挺水植物根部泌氧則是影響水中DO的主要原因[9],因此導(dǎo)致挺水植物水域DO含量較高[10]。這說(shuō)明在不同的植物類型影響下,水化學(xué)性質(zhì)會(huì)表現(xiàn)出不同的變化特征。揭示不同水生植物對(duì)其產(chǎn)生的影響機(jī)制,有利于準(zhǔn)確估算全球碳通量并為合理改善水生態(tài)環(huán)境提供理論依據(jù)。
1 研究區(qū)概況
該研究選擇重慶交通大學(xué)李子湖為研究對(duì)象。研究區(qū)位于重慶市江津區(qū),屬亞熱帶季風(fēng)氣候,年平均氣溫和年平均降水量分別為18.2°C和1 034.7 mm。于2018年5月7日從上游至下游,在東西兩岸各選擇4個(gè)監(jiān)測(cè)點(diǎn)進(jìn)行對(duì)比分析(見圖1)。該區(qū)出露地層為侏羅系上沙溪廟組暗紫色、紫紅色砂質(zhì)泥巖、泥巖與灰?guī)r、灰紫色長(zhǎng)石砂巖、粉砂巖互層。作為校區(qū)內(nèi)重要的水體景觀,李子湖受人類活動(dòng)影響較強(qiáng),湖水中藻類繁盛。西岸連續(xù)分布挺水植物(香蒲),而東岸緊鄰教學(xué)區(qū)域,挺水植物較少且分布零散。另外,4號(hào)和8號(hào)監(jiān)測(cè)點(diǎn)生長(zhǎng)大量沉水植物(菹草)。湖水主要來(lái)源于上游的李子水庫(kù),并從4號(hào)處流出。
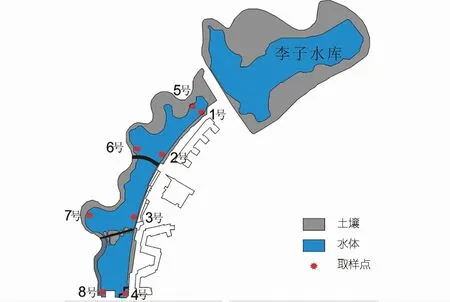
圖1 研究區(qū)概況Fig.1 Location of study site
2 樣品采取與監(jiān)測(cè)方法
在各監(jiān)測(cè)點(diǎn)現(xiàn)場(chǎng)監(jiān)測(cè)水溫、pH、電導(dǎo)率(EC)、溶解氧(DO)及總?cè)芙夤腆w(TDS)。水溫、EC、pH值及DO采用德國(guó)WTW公司生產(chǎn)的Multi350i測(cè)定,精度分別為0.1°C、1 μS/cm、0.01和0.5%;TDS用美國(guó)麥隆9P型便攜式電導(dǎo)率儀進(jìn)行測(cè)定,精度為1 μS/cm;HCO3-和CO32-濃度在現(xiàn)場(chǎng)用德國(guó)Merck堿度計(jì)測(cè)定,精度為0.1 mmol/L。同時(shí),采集水樣以測(cè)試湖水陰陽(yáng)離子濃度及δ13CDIC。用50 mL聚乙烯塑料瓶采集水樣,加入1∶1優(yōu)級(jí)純硝酸,酸化至pH <2,以防止陽(yáng)離子附著在瓶壁上,用賽默飛iCAPTM7200 ICP-OES 等離子體光譜儀測(cè)試陽(yáng)離子濃度,測(cè)試工作在長(zhǎng)江科學(xué)院重慶分院完成。用50 mL棕色聚乙烯塑料瓶裝滿水樣,在現(xiàn)場(chǎng)滴入2滴飽和HgCl2以避免微生物對(duì)其產(chǎn)生干擾,帶回實(shí)驗(yàn)室后保存在4°C的冰箱中,用連接Gas Bench的MAT253(美國(guó)熱電公司)同位素質(zhì)譜儀測(cè)試δ13CDIC(V-PDB),分析誤差<0.15‰,測(cè)試工作在自然資源部巖溶動(dòng)力學(xué)重點(diǎn)實(shí)驗(yàn)室完成。
3 結(jié)果與分析
3.1 李子湖水化學(xué)性質(zhì)變化特征
各監(jiān)測(cè)點(diǎn)之間距離較近,水溫差異較小,但pH,EC,TDS和DO差異明顯,其變化范圍分別為8.68~9.74,392.80~460.70 μS/cm,257.80~304.80 mg/L以及8.87~14.20 mg/L(見圖2)。pH,EC,TDS和DO在東岸呈現(xiàn)出沿程降低的變化特征;在西岸,8號(hào)處的EC和TDS最低, pH值和DO含量最高。
兩岸離子濃度的變化特征也具有一定的差異性。東岸Ca2+濃度沿程降低,而西岸除8號(hào)處Ca2+濃度明顯降低外,其他各點(diǎn)Ca2+濃度變化不大,見圖3(a)。除8號(hào)外,各監(jiān)測(cè)點(diǎn)的Mg2+濃度差異較小,變化范圍為8.03~8.97 mmol/L,見圖3(b)。由于湖水pH大于8.3且小于12,水中溶解無(wú)機(jī)碳(DIC)由HCO3-以及CO32-兩部分組成。HCO3-,CO32-及DIC的濃度分別為1.7~2.7,0.1~0.5,2.2~2.8 mmol/L。東岸DIC濃度呈現(xiàn)出沿程增加的趨勢(shì),從1號(hào)處的2.3 mmol/L上升到4號(hào)處的2.7 mmol/L。而西岸除8號(hào)處DIC濃度明顯下降外,其他3個(gè)監(jiān)測(cè)點(diǎn)的DIC濃度基本相同,見圖3(c)。
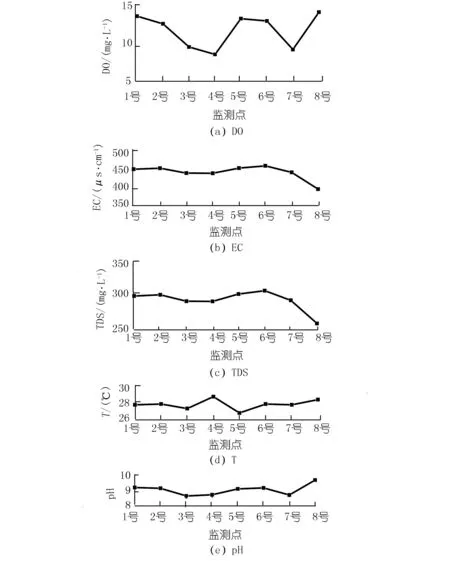
圖2 各監(jiān)測(cè)點(diǎn)水化學(xué)性質(zhì)差異Fig.2 Variation of hydrochemistry among eight sites
3.2 不同水生植物光合作用對(duì)水化學(xué)性質(zhì)的影響
8號(hào)處的DIC濃度、Ca2+濃度、EC以及TDS最低,pH值和DO濃度最高(見圖2,3),這與該監(jiān)測(cè)點(diǎn)分布有大量沉水植物有關(guān)。由于取樣時(shí)間為13:00~16:00,植物光合作用強(qiáng)烈,沉水植物光合作用可以利用水中HCO3-作為碳源并釋放氧氣。許多研究也發(fā)現(xiàn)了類似的現(xiàn)象,尤其是在HCO3-濃度較高的巖溶地區(qū),水生植物光合作用吸收HCO3-并導(dǎo)致方解石沉淀,進(jìn)而導(dǎo)致水中DIC濃度、Ca2+濃度以及EC降低而DO和pH上升[11]。然而,4號(hào)監(jiān)測(cè)點(diǎn)也分布有大量沉水植物,水化學(xué)性質(zhì)并沒(méi)有表現(xiàn)出與8號(hào)相似的特征。Hayashi等人的研究發(fā)現(xiàn),在平水期受植物光合作用和呼吸作用影響,水中的DO和pH具有明顯的晝夜變化,但洪水導(dǎo)致流速加快會(huì)移除生物膜和固著生物,影響水生植物的光合作用,從而使DO和pH的晝夜變化受到干擾[12]。由于4號(hào)位于李子湖出水口處,流速較高導(dǎo)致湖水滯留時(shí)間較短,從而在一定程度上限制了光合作用的影響。因此,4號(hào)處的水化學(xué)性質(zhì)與8號(hào)處存在明顯差異。
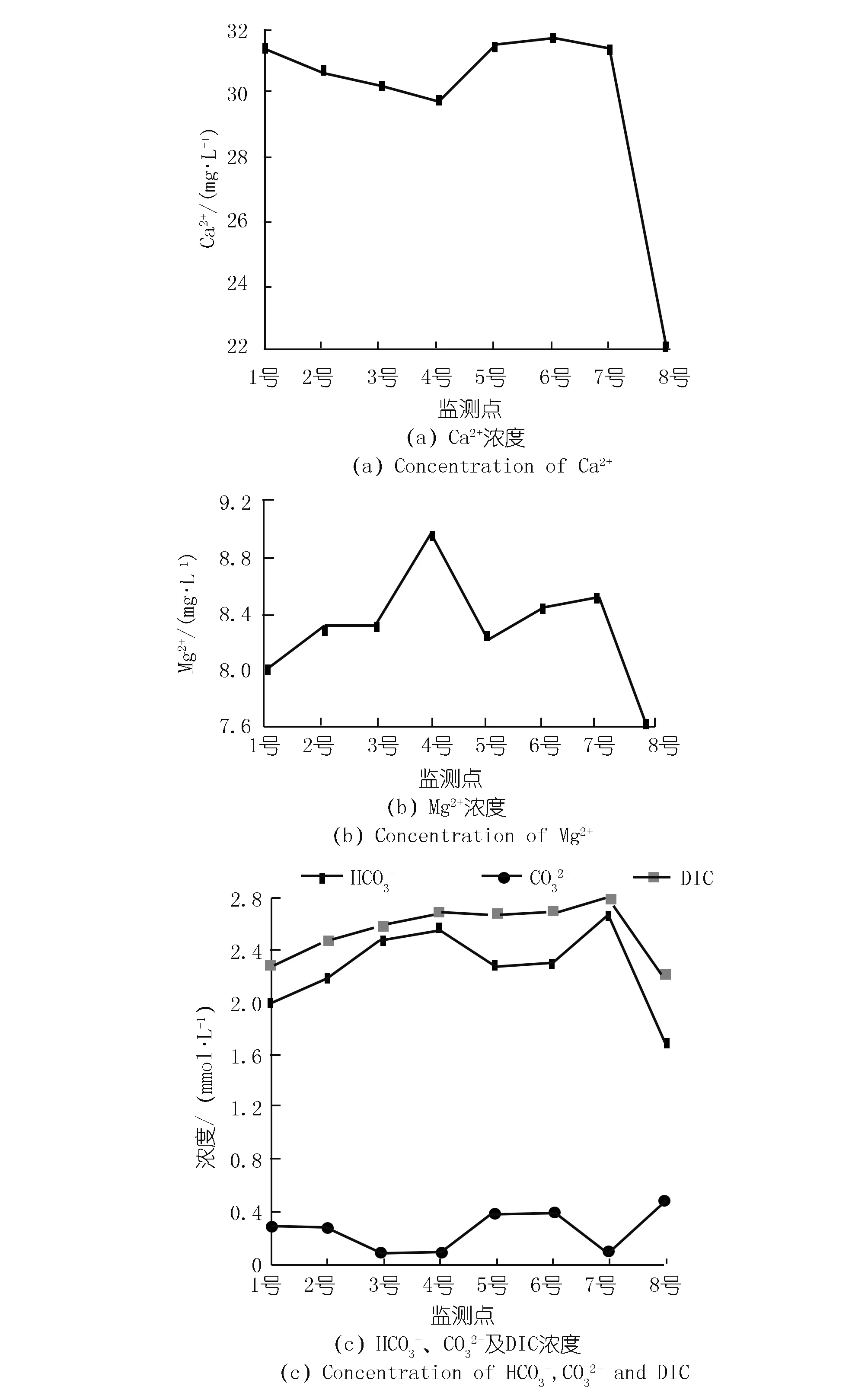
圖3 各監(jiān)測(cè)點(diǎn)離子濃度Fig.3 Ion concentrations of eight sites
在不考慮8號(hào)的情況下,對(duì)比兩岸水化學(xué)性質(zhì)發(fā)現(xiàn),西岸5,6,7號(hào)的Ca2+濃度、DIC濃度、EC和TDS分別大于東岸1,2,3號(hào),這可能與兩岸水生植物類型的差異有關(guān)。不同的水生植物,其利用碳源的方式并不相同。李子湖東岸水生植物主要以藻類為主,其光合作用消耗HCO3-導(dǎo)致DIC濃度降低。而西岸分布有大量的挺水植物,其進(jìn)行光合作用并不以水中HCO3-為主。根據(jù)李強(qiáng)等對(duì)貴州草海的研究,沉水植物進(jìn)行光合作用的碳源可以全部來(lái)自于HCO3-,而挺水植物進(jìn)行光合作用的碳源只有12.93%來(lái)自于HCO3-[6]。這是因?yàn)橥λ参锟梢猿浞掷么髿狻⑺泻偷啄嘀蠧O2三種碳源,并且在水中DIC濃度較低的情況下,挺水植物更傾向于利用大氣CO2[13]。同時(shí),挺水植物還會(huì)通過(guò)遮光作用、與藻類競(jìng)爭(zhēng)水中營(yíng)養(yǎng)物質(zhì)以及分泌抑制藻類的化感物質(zhì)等,對(duì)藻類生長(zhǎng)產(chǎn)生抑制作用[14-15],阻礙藻類通過(guò)光合作用吸收HCO3-,進(jìn)而導(dǎo)致西岸水中Ca2+濃度、DIC濃度、EC和TDS大于東岸。然而,水化學(xué)性質(zhì)若只受光合作用影響,DO應(yīng)與DIC濃度、EC和TDS呈現(xiàn)相反的變化特征。但圖2顯示,西岸DO并沒(méi)有小于東岸,因?yàn)橥λ参锟梢酝ㄟ^(guò)植物的通氣組織將氧氣輸送到底質(zhì)部分以增加水中DO[10,16]。因此,雖然西岸挺水植物抑制藻類生長(zhǎng)使DIC濃度高于東岸,但并沒(méi)有導(dǎo)致水中的DO濃度降低。
3.3 水化學(xué)性質(zhì)沿程變化特征及影響因素
3.3.1東 岸
東岸EC、TDS和Ca2+濃度沿程遞減反映了藻類光合作用對(duì)水化學(xué)性質(zhì)產(chǎn)生了重要影響。但如上所述,藻類光合作用消耗水中DIC并釋放氧氣,水中DIC濃度應(yīng)沿程逐漸降低而pH和DO應(yīng)沿程逐漸升高。結(jié)果卻顯示東岸DIC含量沿程逐漸增加,而pH和DO逐漸降低(見圖2)。
本次監(jiān)測(cè)期間的湖水溫度較高(見圖2),微生物活性加強(qiáng)。微生物分解有機(jī)質(zhì)消耗氧氣,并向水體釋放CO2,可能導(dǎo)致東岸DO、pH沿程降低而DIC濃度沿程增加。然而除碳源氧化耗氧外,有機(jī)質(zhì)分解耗氧還包括硝化耗氧[17]。硝化耗氧也會(huì)降低DO,同時(shí)釋放H+,導(dǎo)致湖水pH下降。但硝化耗氧并不產(chǎn)生CO2,從而不會(huì)導(dǎo)致水中DIC濃度增加。為驗(yàn)證湖水中DIC是否主要來(lái)源于有機(jī)質(zhì)的分解,本研究進(jìn)一步分析了湖水DIC的穩(wěn)定碳同位素(δ13CDIC)。
李子湖水δ13CDIC為-7.91‰~-4.82‰(見圖4),這與貴州草海湖水δ13CDIC(-3.7‰~-10.6‰)的變化范圍一致[18]。李子湖水主要來(lái)源于上游的李子水庫(kù),大氣CO2、水生植物呼吸與有機(jī)質(zhì)分解產(chǎn)生的CO2以及基巖溶解是水中DIC的主要來(lái)源。由于各個(gè)碳源的δ13C不同,δ13CDIC可以反映出不同碳源對(duì)水中DIC的貢獻(xiàn)。有機(jī)質(zhì)的δ13CDIC較為偏負(fù)[18],如果湖水中DIC濃度沿程增加是由于微生物分解有機(jī)質(zhì)造成的,湖水δ13CDIC應(yīng)沿程逐漸偏負(fù)。
然而,東岸δ13CDIC沿程偏正,說(shuō)明水中DIC增加的主要原因并不是有機(jī)質(zhì)分解,而是有更為偏正的碳進(jìn)入水體。其來(lái)源可能有以下兩個(gè):① 研究區(qū)基巖中碳酸鹽巖的溶蝕。碳酸鹽巖溶蝕性較強(qiáng),并且碳酸鹽巖的δ13C通常為-3‰~+2‰[19],溶蝕后會(huì)導(dǎo)致水中DIC濃度增加且δ13CDIC偏正。但東岸Ca2+濃度、EC以及TDS并沒(méi)有隨DIC增加而增加,說(shuō)明東岸DIC濃度沿程增加并不是由碳酸鹽巖溶蝕造成的。② 大氣CO2通過(guò)水-氣界面進(jìn)入水體。太湖春季水-氣界面的碳通量監(jiān)測(cè)結(jié)果顯示,在水體營(yíng)養(yǎng)化嚴(yán)重的湖區(qū),白天湖水會(huì)成為大氣CO2的匯[20]。陳毅鳳等[18]建立的貴州草海湖泊系統(tǒng)碳循環(huán)簡(jiǎn)單模式,也發(fā)現(xiàn)大氣CO2每年向湖水輸入的凈碳量高達(dá)35 t。大氣CO2的δ13C約為-8‰,其溶解于水后發(fā)生+8%的同位素分餾,形成的DIC的δ13C約為0‰[21]。假設(shè)4號(hào)處DIC由1號(hào)處的DIC和混入水中的DIC兩個(gè)端元組成。運(yùn)用同位素混合比例法可知混入水中的DIC的δ13C。公式如下:
δ13CDIC(4號(hào))=
Xδ13CDIC(1號(hào))+(1-X)δ13CDIC(混入DIC)
式中,X為各端元DIC所占比例。1號(hào)處為2.3 mmol/L,占4號(hào)處DIC(2.7 mmol/L)的85%;沿途DIC增加了0.4 mmol/L(即混入了0.4 mmol/L的DIC),占4號(hào)處DIC的15%;4號(hào)處δ13CDIC為-5.29‰;1號(hào)處δ13CDIC為-5.95‰。計(jì)算得出混入水中的DIC,其δ13C為-1.55‰,接近大氣CO2進(jìn)入水中形成的DIC的δ13C值(0‰),說(shuō)明東岸增加的DIC主要來(lái)自于大氣CO2。其δ13C值略偏負(fù)于大氣CO2的δ13C,則說(shuō)明并不能完全排除生物分解有機(jī)質(zhì)對(duì)湖水DIC有一定的貢獻(xiàn)。
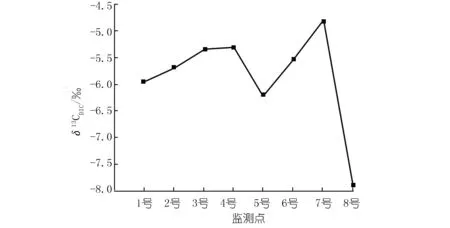
圖4 各監(jiān)測(cè)點(diǎn)δ13CDICFig.4 δ13CDICof eight sites
3.3.2西 岸
在不考慮8號(hào)的情況下,DO在6號(hào)處上升隨后在7號(hào)處下降,Ca2+濃度、DIC濃度在5號(hào)、6號(hào)和7號(hào)處變化并不明顯,這可能與西岸挺水植物有關(guān)。如上文所述,挺水植物輸送到根際的氧氣補(bǔ)償了硝化作用對(duì)DO的消耗,從而導(dǎo)致6號(hào)處DO上升。而在7號(hào)處, DO下降則說(shuō)明硝化耗氧的影響可能又開始大于挺水植物。另外,西岸Ca2+濃度并沒(méi)有與東岸一樣表現(xiàn)出沿程下降的趨勢(shì)。一方面是由于挺水植物限制了藻類對(duì)水中DIC的吸收,從而減少了方解石沉淀;另一方面可能是由于挺水植物根部分泌有機(jī)酸以及根際環(huán)境有利于微生物生長(zhǎng),加速了碳酸鹽巖溶蝕,從而彌補(bǔ)了光合作用造成的Ca2+損失。碳酸鹽巖溶蝕同樣會(huì)彌補(bǔ)藻類光合作用消耗的DIC,并導(dǎo)致湖水δ13CDIC偏正。但隨著溶蝕作用加強(qiáng),水中pCO2升高,這又會(huì)反過(guò)來(lái)限制大氣CO2進(jìn)入水體[22]。因此,與東岸不同,西岸受幾種作用共同影響,雖然δ13CDIC沿程偏正但DIC濃度變化不大。
8號(hào)處明顯受到了沉水植物光合作用的影響,但其δ13CDIC卻最為偏負(fù),這與光合作用會(huì)導(dǎo)致δ13CDIC偏正的現(xiàn)象不符。其原因可能是因?yàn)?號(hào)處較為封閉,沉水植物產(chǎn)生的有機(jī)質(zhì)使水中輕碳富集,并且新鮮有機(jī)質(zhì)的分解速率明顯較快[23],碳源耗氧可能對(duì)水中DIC的貢獻(xiàn)較大,從而導(dǎo)致了8號(hào)處δ13CDIC最為偏負(fù)。
4 結(jié) 語(yǔ)
(1) 水生植物光合作用會(huì)對(duì)水化學(xué)性質(zhì)產(chǎn)生明顯影響,但不同植物類型產(chǎn)生的影響并不相同。沉水植物和藻類吸收水中的DIC,導(dǎo)致Ca2+濃度、DIC濃度、TDS和EC電導(dǎo)率下降,而DO和pH升高;但挺水植物光合作用主要吸收大氣CO2,同時(shí)對(duì)藻類產(chǎn)生抑制作用,從而導(dǎo)致東西兩岸水化學(xué)性質(zhì)的差異明顯。
(2) 水中有機(jī)質(zhì)分解硝化耗氧和大氣CO2進(jìn)入水體是影響東岸湖水DO、pH和DIC濃度沿程變化的主要因素。西岸挺水植物導(dǎo)致水化學(xué)性質(zhì)受幾種作用的綜合影響,水化學(xué)性質(zhì)沿程變化特征及影響因素與東岸明顯不同。
該研究只監(jiān)測(cè)了水化學(xué)性質(zhì)的空間變化特征,為進(jìn)一步探索李子湖水化學(xué)性質(zhì)的影響因素,還需對(duì)水化學(xué)的時(shí)間(晝夜、季節(jié))變化進(jìn)行對(duì)比。

