HPLC法測定銀菊感冒膠囊中馬來酸氯苯那敏的含量及含量均勻度
云南省曲靖市食品藥品檢驗檢測中心,云南 曲靖 655000
銀菊感冒膠囊為曲靖市中醫醫院的院內制劑(批準文號:滇ZJGF/2005-538),由金銀花、菊花、射干、氨基比林、馬來酸氯苯那敏等組成,具有清熱解毒、解熱鎮痛的作用。臨床用于感冒、發熱、頭痛、咽喉腫痛等癥[1]。制劑中馬來酸氯苯那敏僅有薄層色譜定性鑒別,未建含量測定方法。本文參照相關文獻[2-4],采用高效液相色譜法(HPLC)對該品種中馬來酸氯苯那敏含量及含量均勻度進行測定,結果表明本方法簡單快捷,穩定性及重現性較好,可有效控制銀菊感冒膠囊質量。
1 儀器與材料
1.1 儀器 Agilent1200型高效液相色譜儀(四元泵,自動進樣器,柱溫箱, 紫外檢測器);METTLE MS205DU電子天平(上海梅特勒-托利多儀器有限公司)MS205DU電子天平(上海梅特勒-托利多儀器有限公司);一體式超純水儀(PURELAB Flex 3,英國ELGA公司)。
1.2 藥品與試劑 銀菊感冒膠囊(規格0.25g/粒,批號181007、181118、181220)樣品均來自云南省曲靖市中醫醫院;馬來酸氯苯那敏(批號100047-201507,含量99.7%)購于中國食品藥品檢定研究院;乙腈為色譜純,磷酸二氫銨和磷酸為分析純,水為超純水。
2 方法與結果
2.1 色譜條件與系統適用性試驗 色譜柱:Amethyst C18(4.6 mm×200 mm,5 μm); 磷酸鹽緩沖液(取磷酸二氫銨11.5 g,加水適量使溶解,加磷酸1 mL,用水稀釋至1000 mL)-乙腈(80∶20)為流動相;流速:1.0 mL· min-1; 柱溫:30 ℃,;檢測波長:262 nm;進樣量:10 μL。理論板數按氯苯那敏峰計算不低于4000,氯苯那敏峰與相鄰雜質峰的分離度應符合要求。
2.2 溶液的制備
2.2.1 對照品溶液制備 取馬來酸氯苯那敏對照品17.86 mg,精密稱定,置200 mL容量瓶中,加流動相使溶解并稀釋至刻度,搖勻,即得。
2.2.2 供試品溶液制備 取銀菊感冒膠囊20粒,計算平均裝量,取內容物,研細,混勻,取適量(約相當于馬來酸氯苯那敏4 mg),精密稱定,置50 mL容量瓶中,加流動性30 mL,超聲處理15 min,放冷,加流動相至刻度,搖勻,濾過,濾液再用0.45 μm微孔濾膜濾過,即得。
2.2.3 陰性樣品溶液制備 根據制劑處方及工藝,配制缺馬來酸氯苯那敏的陰性樣品(由云南省曲靖中醫醫院提供),再按“2.2.2”項下方法制備,即得。
2.3 結果
2.3.1 專屬性試驗 在上述色譜條件下,分別精密吸取對照品溶液、供試品溶液和陰性樣品溶液各10 μL,注入液相色譜儀,記錄色譜圖,結果如圖1所示。結果表明,馬來酸氯苯那敏分離較好,無干擾,說明測定方法專屬性較好。
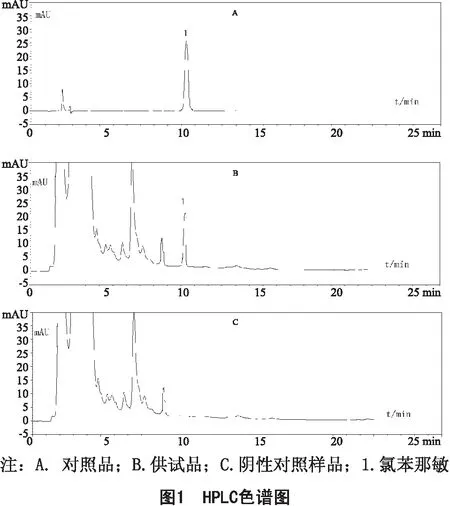
2.3.2 線性關系試驗 精密吸取“2.2.1”項下的對照品溶液0.1、0.2、0.5、1.0、2.0、5.0 mL,分別置于 10 mL容量瓶中,用流動相稀釋至刻度,搖勻,即得。分別重復進樣3次,記錄峰面積。以進樣量X(μg)為橫坐標,峰面積(以氯苯那敏計)平均值(Y)為縱坐標,進行線性回歸,得回歸方程:Y=9226.8829X-0.6386,r=0.999 9。結果表明,馬來酸氯苯那敏質量濃度在0.893~44.65 μg/mL范圍內線性關系良好。
2.3.3 檢測限和定量限 取“2.2.1”項下的對照品溶液適量,等倍逐級稀釋進樣測定,記錄峰面積。當信噪比為3∶1時,得檢測限為 2.025 ng;當信噪比為10∶1時,得定量限為 6.211 ng。
2.3.4 穩定性試驗 取經“2.2.2”項方法制備的樣品(批號181007)供試品溶液,按照“2.1”項下的色譜條件進行分析,分別在0、2、4、6、8、12、24 h不同時間進樣測定。結果峰面積RSD為1.36%(n=7)。結果表明供試品溶液在 24 h 內色譜峰面積變化不大,溶液較穩定。
2.3.5 回收率試驗 取已知含量的同一批樣品(批號:181007)5份,每份約 0.5 g,精密稱定;另取馬來酸氯苯那敏對照品 25.12 mg,精密稱定,置 25 mL容量瓶中,加流動性使溶解并稀釋至刻度,搖勻,分別精密量取 2 mL置已稱定樣品中,按“2.2.2”項下的方法制備供試品溶液,按照“2.1”項下的色譜條件進行分析,結果見表1。
2.3.6 精密度試驗 精密取經“2.2.1”項方法制備的樣品(批號181007)供試品溶液 10 μL,按照“2.1”項下的色譜條件進行分析,連續6次。結果馬來酸氯苯那敏峰面積的RSD分為0.30%,結果表明儀器平行精密度良好。
2.3.7 重復性試驗 取同一批次的樣品(批號:181007),平行6份(1.0 g),精密稱定,按“2.2.1”項下的方法操作,按照“2.1”項下的色譜條件進行分析,每1 g樣品中含馬來酸氯苯那敏 3.9424 mg,RSD為0.26%,結果表明該方法重復性良好。
2.3.8 樣品測定 含量測定:取樣品3批次(批號181007、181118、181220)分別按“2.2.1”項下的方法制備供試品溶液,按照“2.1”項下的色譜條件進行分析,計算標示含量,結果3批樣品中馬來酸氯苯那敏的平均標示含量分別為98.56%、98.96%、99.05%。含量均勻度測定:取3個批號的樣品各10粒,分別置于 25 mL容量瓶中,加流動性 15 mL,超聲處理 15 min,放冷,加流動相至刻度,搖勻,濾過,續濾液再用 0.45 μm微孔濾膜濾過,濾液按照“2.1”項下的色譜條件進行分析,計算標示含量,結果見表2,符合《中國藥典》2015年版通則0941含量均勻度項下有關規定(A+2.2S≤ L,L=15.0)。
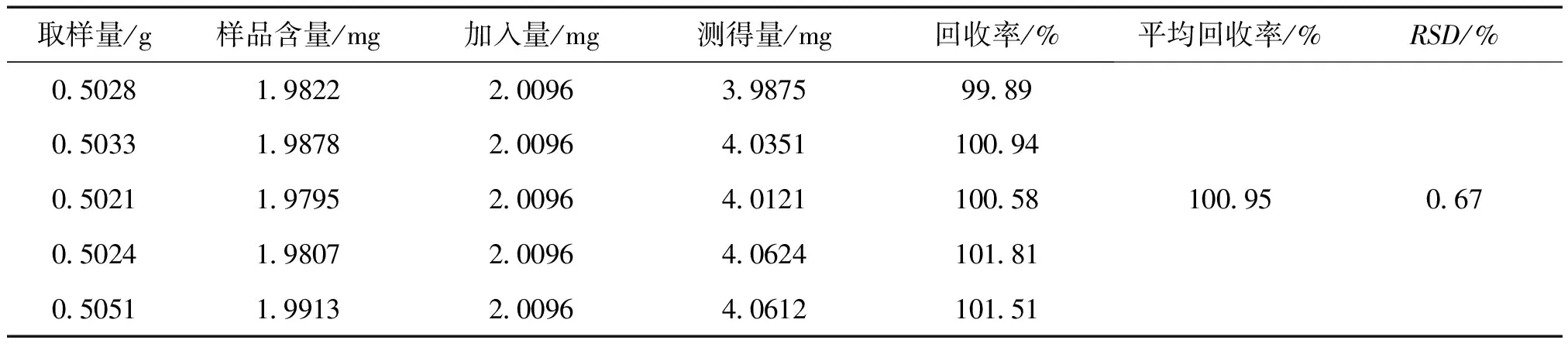
表1 回收率試驗結果 ( n=5)
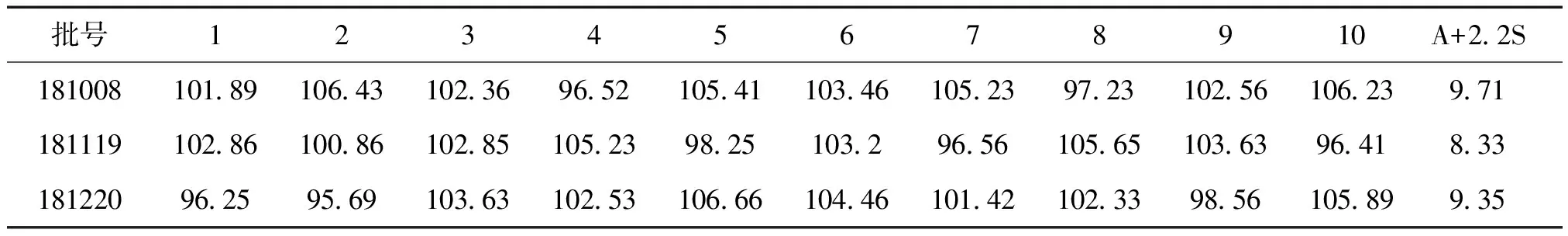
表2 樣品含量均勻度測定結果 (n=3)
3 討論
3.1 檢測波長的選擇 通過實驗馬來酸氯苯那敏在262.5 nm波長處有最大吸收,結合中國藥典及相關文獻報道[5-8]最終選用 262 nm作為檢測波長。
3.2 提取條件選擇 試驗中曾采用甲醇、水、乙醇、流動相等溶媒超聲15 min,進行提取,經比較,以流動相作為提取溶劑為佳;再以流動相為提取溶劑,對同一批號樣品的超聲時間進行考察,選擇超聲10、15、30、45、60 min后處理的樣品溶液分別進行分析,結果各樣品含量基本接近,故選擇超聲時間 15 min處理樣品。
3.3 分離條件選擇 本試驗曾采用了3種流動相進行成分分離[9-11]。①乙腈:磷酸鹽緩沖液②甲醇-水 ;③甲醇-乙腈-水。結果發現磷酸鹽緩沖液(取磷酸二氫銨11.5 g,加水適量使溶解,加磷酸 1 mL,用水稀釋至1000 mL)-乙腈(80∶20)為流動相保留時間合適且各成分獲得較好的分離。
4 結論
本試驗中采用高效液相色譜法測定銀菊感冒膠囊中馬來酸氯苯那敏的含量及含量均勻度,該方法操作簡便,準確可靠,可有效控制該制劑質量。

