雞血漿中乙酰氨基阿維菌素HPLC檢測法的 建立及口服給藥后的藥代動力學研究
許曉琳,潘婷婷,張樹棟,王傳文,潘保良*
(1. 中國農業大學動物醫學院,北京 100193;2. 北京市藥品檢驗所,北京 102206)
乙酰氨基阿維菌素(eprinomectin,EPR)是一種高效、廣譜、低殘留的獸用新一代驅蟲藥物[1-2],主要用于防治家畜(特別是泌乳家畜)的外寄生蟲(蜱、虱、螨、蠅)和內寄生蟲(各種線蟲)的感染[3-5]。該藥應用于奶牛和肉牛時無需休藥期[6]。但該藥應用于禽類寄生蟲的防控尚未見報道。雞皮刺螨是蛋雞養殖中最常見、危害最嚴重的外寄生蟲病,但傳統的藥物防治存在不徹底、耐藥性等問題。本實驗室前期研究EPR對雞皮刺螨的防控作用發現,5 mg/kg的給藥劑量可達到100%的殺螨效率[7],為了更好地了解EPR在雞體內的藥代動力學特征,本研究建立了雞血漿中EPR濃度測定的熒光HPLC檢測方法,并對其在雞體內的藥代動力學進行了研究,為EPR的制劑開發及在雞皮刺螨防治中的臨床應用提供科學依據。
1 試驗材料
1.1 主要儀器與設備 Waters 2695高效液相色譜儀,配有Waters 2475 熒光檢測器(Waters 公司);SunFireTMC18反相色譜柱(4.6×150 mm,5 μm;Waters 公司);Sep-Pak C18固相萃取柱(Waters 公司);DT5-2型離心機(北京時代北利離心機有限公司);OA-SYS型氮吹儀(Organomation Associates 公司);渦動儀(北京方正生物技術發展有限公司);Sartorius BP310s電子天平(Sartorius公司)。
1.2 試劑與藥品 EPR標準品,純度94.5%,批號:G157148,購自德國Dr.Ehrenstorfer公司;色譜純的乙腈、甲醇(德國Merck-KGaA),N-甲基咪唑、三氟乙酸酐(百靈威),色譜純的冰乙酸、三乙胺(阿拉丁);蒸餾水(屈臣氏集團)。
1.3 試驗動物 6只白羽蛋雞,體重1.3~1.7 kg,年齡為20~22周。所有雞均沒有使用過EPR等藥物,雞在雞舍內自由飲水、采食,在試驗前適應一周,并采血檢測,確定血漿中沒有EPR。試驗前16 h及給藥后6 h內禁食禁水。
2 試驗方法
2.1 溶液制備
2.1.2 衍生化試劑的制備 A 液:N-甲基咪唑+乙腈(2+7,V/V);B液:三氟乙酸酐+乙腈(2+7,V/V),A液與B液均現用現配。
2.1.3 EPR口服溶液的制備 EPR溶解于乙醇中,以乙醇:吐溫80:PBS(pH=7.4)=40:2:58的比例配置2 mg/mL的EPR溶液。
2.2 EPR的熒光HPLC檢測方法的建立
2.2.1 血漿樣品的前處理
2.2.1.1 EPR的提取與純化 取空白雞血漿450 μL,加入50 μL EPR標準系列工作液,加入3 mL乙腈渦動混勻2 min,超聲10 min,4000 r/min離心20 min,將上清液轉移至新離心管中,下層殘渣用3 mL乙腈重復提取一次,合并上清液。上清液中加入9 mL蒸餾水稀釋并混勻。將稀釋的上清液通過活化的ODS-C18固相萃取柱(先用3 mL甲醇進行活化,然后用超純水淋洗,再用3 mL 70%甲醇水溶液進行平衡),依次用3 mL蒸餾水和3 mL 70%甲醇水溶液進行淋洗,吹干后,使用4 mL甲醇(分3次,分別為2、1、1 mL)進行洗脫。收集洗脫液,使用氮吹儀將液體吹干。
2.2.1.2 熒光衍生化 向干燥的樣品中依次加入200 μL A液、200 μL B液、45 μL冰醋酸和45 μL三乙胺,渦動混勻后將其置于65 ℃真空干燥箱內反應30 min,再依次置于4 ℃冰箱3 min、室溫12 min。用流動相定容至1 mL,混勻后過0.22 μm有機濾膜,濾液供HPLC分析。
2.2.2 色譜條件 色譜柱: SunFireTMC18 反相色譜柱;熒光檢測波長:激發波長365 nm,發射波長463 nm;流動相:甲醇:乙腈:水= 63:32:5(V/V/V);流速:1.0 mL/min;柱溫:35 ℃;進樣量:20 μL;檢測時間:12 min。
2.2.3 標準曲線的繪制 取雞空白血漿450 μL于離心管中,然后加入不同濃度的EPR標準系列工作液50 μL,使其濃度為0.1、0.5、1、5、10、20、50、100 ng/mL,參考方法2.2.1項與2.2.2項進行血漿樣品的處理與HPLC檢測分析。每個濃度設3個重復,繪制出濃度-峰面積標準曲線。
該煤炭企業風選項目初步方案是,從煤場第一部振動篩下出料口將8cm以下原煤引入風選設備中,經風選系統排矸后精煤再返回原煤場篩分第二部振動篩內,依次分級為中塊(5-8cm)、小塊(2-5cm)、粒煤(1-3cm)和末煤。風選系統與原煤篩分系統有機結合,原煤篩分系統可以單獨運行,也可以與風選系統搭配使用。
2.2.4 方法學驗證
2.2.4.1 準確度與精密度的測定 使用EPR標準系列工作液配置低、中、高三種血漿濃度添加水平,即0.5、10、100 ng/mL三種血漿添加濃度,同時配置0.5、10、100 ng/mL的標準溶液。添加標準工作液的雞血漿樣品經過前處理、衍生化后進行HPLC檢測,測出峰面積;標準溶液直接經氮吹儀吹干、衍生化與HPLC檢測,測出對應的藥物峰面積。每個濃度設5個重復,測3個批次,計算批內和批間的變異系數(RSD)。
2.2.4.2 檢測限與定量限 取雞空白血漿5份,參考方法2.2.1項與2.2.2項對樣品進行處理與HPLC檢測,測得對應保留時間位置背景信號(噪音)的標準偏差,按信噪比(S/N)為3計算,求得各個樣品檢測方法的檢測限(LOD)。以S/N=10,計算定量限(LOQ)。
2.3 藥物代謝動力學試驗
2.3.1 給藥與采集血樣 在試驗前對試驗動物稱重,以5 mg/kg的給藥劑量灌服EPR溶液,在給藥后0.25、0.5、0.75、1、1.5、2、2.5、3、4、6、8、12、24、36 h進行翅下靜脈采血,12000 r/min離心10 min分離血漿,-20 ℃冰箱保存備用。由于本試驗中給藥劑量較大,為了準確的檢測雞血漿中的EPR,對血漿進行了稀釋處理。
2.3.2 雞血漿中EPR的濃度測定 取恢復至室溫的雞血漿500 μL,對血漿中的EPR進行提取、純化與衍生化,定容后過濾膜,進行HPLC分析。方法參照2.2.1項與2.2.2項。
2.3.3 數據處理 將測得的各個血樣的HPLC檢測值,使用Waters儀器提供的Empower3軟件分析,計算出各個血漿樣品中EPR的濃度,繪制出樣品的時間-藥物濃度散點圖。
采用WinNinlin5.2.1(Pharsight Corporation, Mountain View, CA, USA)分析軟件對樣品的時間-藥物濃度曲線進行模擬分析,以非房室模型分析方法對藥代數據進行分析,并求出相應的藥物代謝動力學參數。
3 結果與分析
3.1 標準曲線 血漿中EPR濃度-HPLC吸收峰面積標準曲線見圖1。在濃度為0.1~100 ng/mL添加范圍內,EPR峰面積與濃度呈線性相關。其線性回歸方程為:Y=123938X+23011,相關系數r=0.9999。
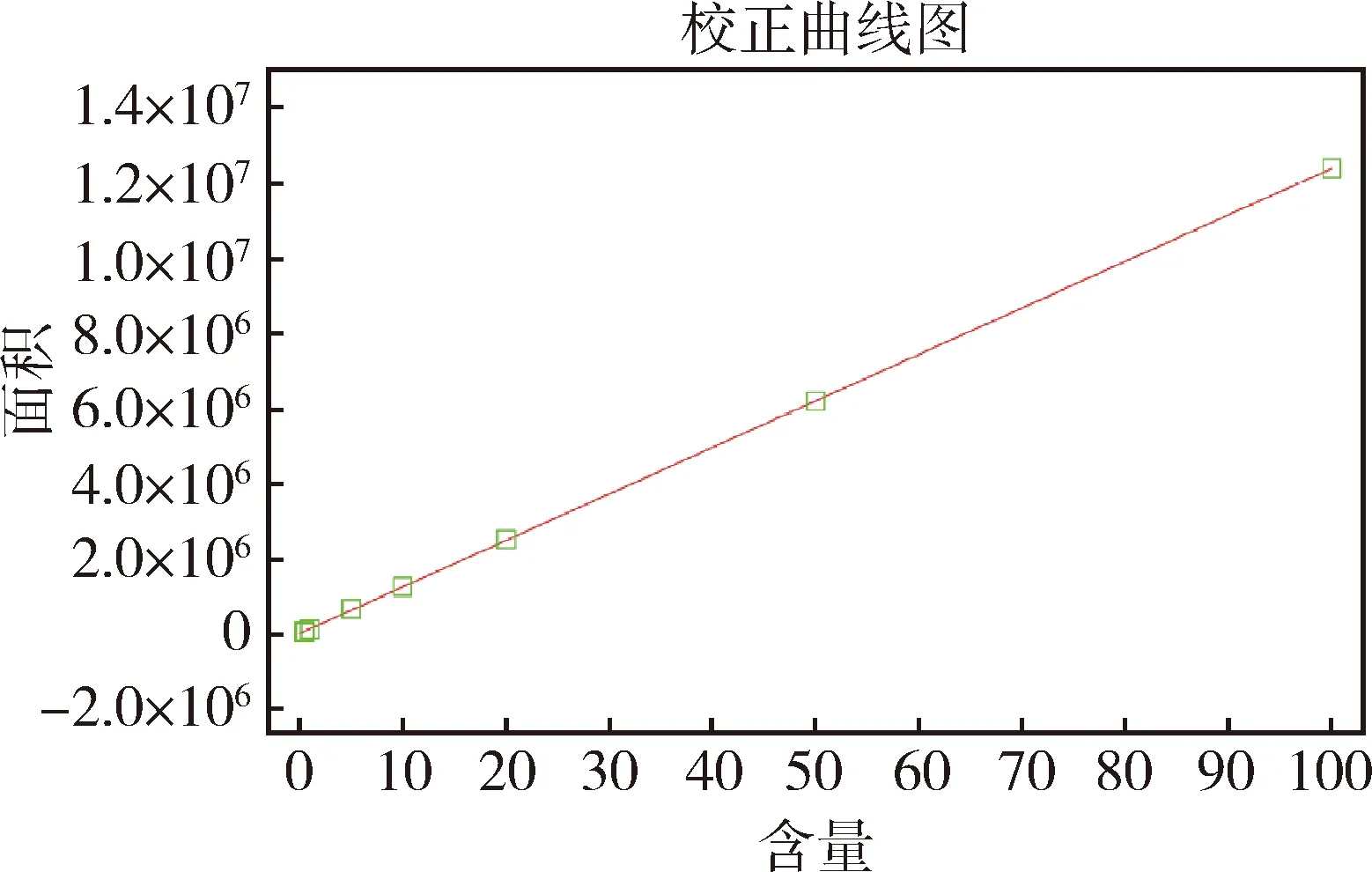
圖1 EPR標準曲線圖(0.1~100 ng/mL)Fig 1 Standard curve for EPR (0.1~100 ng/mL)
3.2 準確度與精密度 在雞血漿中,3個濃度、3個批次的添加回收率和變異系數(RSD)見表1。EPR在雞血漿中的添加水平為0.5、10、100 ng/mL時,平均回收率在90.55%~101.30%之間,批內RSD在2.81%~8.02%之間,批間RSD在4.32%~5.83%之間,表明該方法準確度、精密度高,重復性好,可達到分析要求。
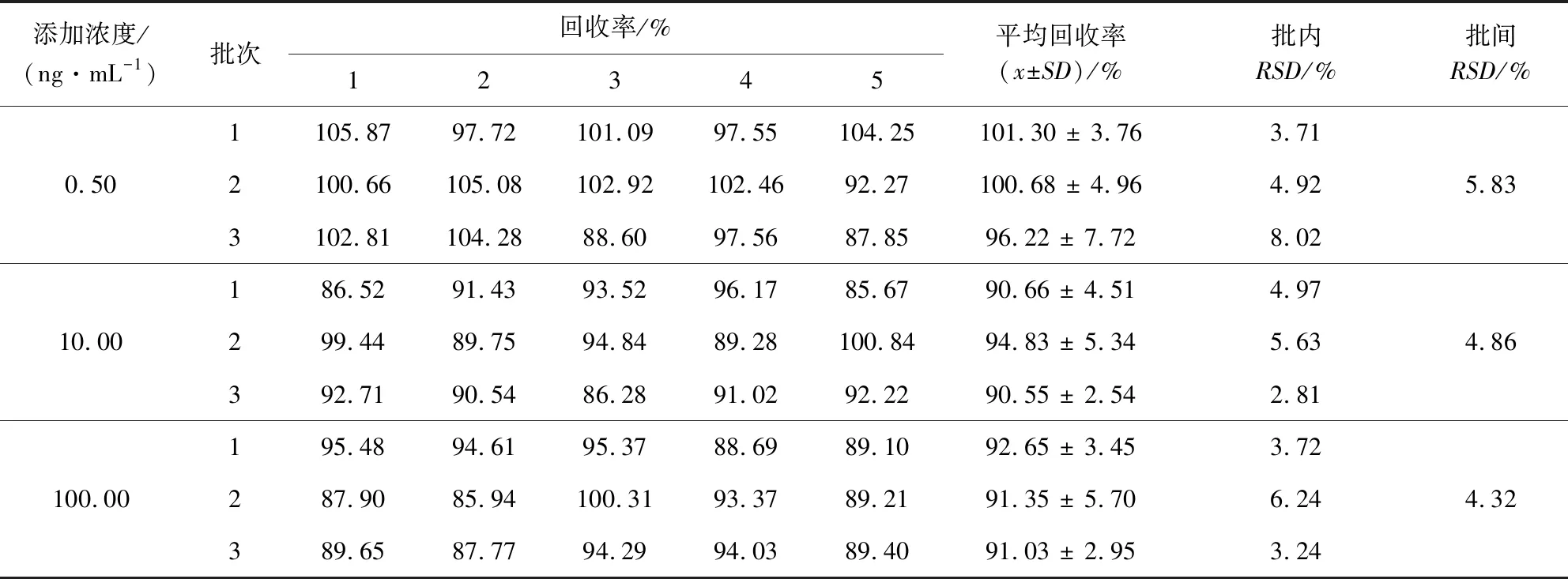
表1 回收率試驗結果Tab 1 Results of recovery tests
3.3 檢測限與定量限 通過添加試驗確定本方法的EPR的LOD和LOQ分別為0.1 ng/mL和0.3 ng/mL。
3.4 熒光HPLC色譜分析 EPR標準工作液(10 ng/mL)色譜圖如圖2。雞空白血漿以及向空白血漿中添加EPR標準工作液(10 ng/mL)的色譜圖分別見圖3、圖4。EPR的保留時間為7.6 min左右,色譜峰分離良好、對稱性好,EPR峰周圍無明顯干擾峰,達到了檢測的要求。

圖2 EPR標準工作液色譜圖(10 ng/mL)Fig 2 Chromatogram of EPR standard solution (10 ng/mL)

圖3 雞空白血漿色譜圖Fig 3 Chromatogram of chicken plasma solution

圖4 雞血漿添加EPR標準工作液色譜圖(10 ng/mL)Fig 4 Chromatogram of chicken plasma solution with EPR standard solution (10 ng/mL)
3.5 EPR溶液在雞體內的藥代結果 雞口服5 mg/kg的EPR溶液后,血漿樣品的時間-EPR藥物平均濃度散點圖見圖5,雞血漿樣品藥代動力學參數見表2。在給藥后1.58 ± 0.38 h,EPR溶液在雞體內的最大血藥濃度(Cmax)為354.27 ± 65.99 ng/mL,消除半衰期(T1/2el)為5.52 ± 1.67 h,曲線下面積AUC0-t為2306.55 ± 531.82 ng/mL,AUC0-∞為2348.53 ± 547.16 ng/mL,平均滯留時間(MRT)為6.40 ± 1.03 h。
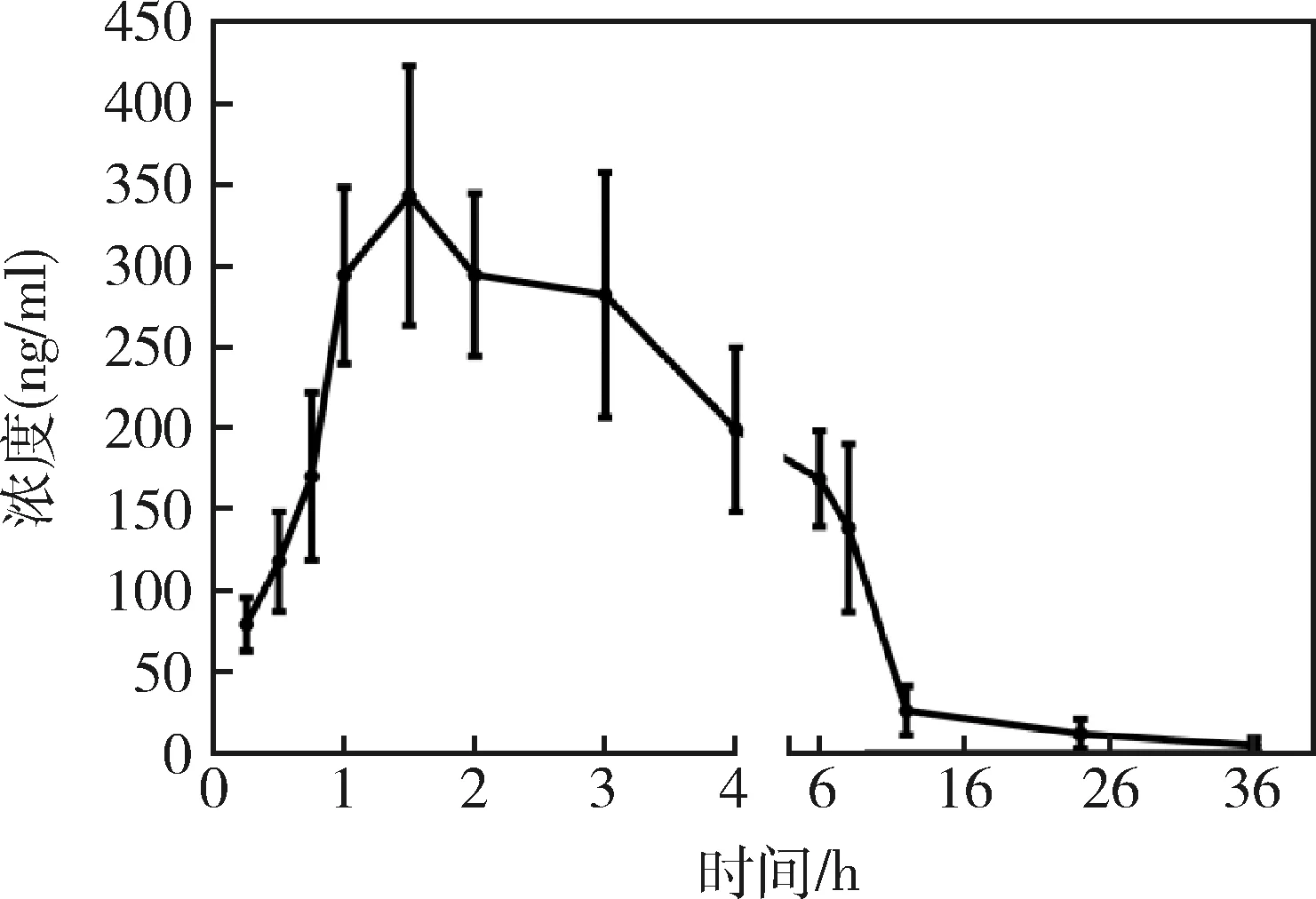
圖5 血漿樣品的時間-EPR藥物平均濃度散點圖(5 mg/kg)Fig 5 Concentration-time profile of EPR in plasma (5 mg/kg)

參數值(x±SD)Cmax/(ng·mL-1)354.27±65.99Tmax/h1.58±0.38AUC0-t/(ng·h·mL-1)2306.55 ± 531.82AUC0-∞2348.53±547.16MRT/h6.40±1.03T1/2el/h5.52±1.67
Cmax為最大藥物濃度,Tmax為到達最大藥物濃度的時間,T1/2el為消除半衰期,AUC0-t為時間從0到所選擇的最后一個時間點時曲線下面積,AUC0-∞為時間從0到無窮期間的曲線下面積,MRT為藥物的平均滯留時間
4 討論與結論
自EPR開發上市以來,圍繞藥物開展了制劑研發、檢測方法的建立與優化、藥效試驗與藥代試驗等研究。目前,EPR澆潑劑、注射劑與口服糊劑等廣泛應用于肉牛、奶牛、羊、兔等動物,EPR在相應動物體內的藥物代謝動力學研究已有報道,但EPR在家禽上的應用較少,以及EPR在家禽體內的藥代動力學研究還未有報道。本研究為了探討EPR在雞體內藥代動力學過程,成功建立了雞血漿中EPR的熒光HPLC檢測方法,并進行了雞體內EPR藥代動力學研究。
雞血漿中EPR的熒光HPLC方法建立,在Dannher等[8]建立的衍生化方法、潘保良等[9]建立的牛奶中EPR的HPLC檢測方法基礎上進行了改進,用N-甲基咪唑和三氟乙酸酐作為衍生化試劑,加入冰醋酸后,又嘗試加入三乙胺[10],使EPR的衍生化方法趨于穩定,衍生化產物在22 h內不發生明顯的降解,解決了衍生化產物不穩定的問題。此外,EPR色譜峰分離良好,峰周圍無明顯干擾峰,滿足檢測要求。
在藥代動力學研究中,根據藥代動力學參數可知,EPR溶液經口服給雞后,在1.58 h(Tmax)就達到了血藥濃度峰值(354.27 ng/mL,Cmax),提示EPR在雞體內吸收與分布迅速;EPR在雞血漿中的消除半衰期為5.52 h(T1/2el),平均滯留時間為6.40 h(MRT),說明EPR在雞體內消除較快。EPR在雞體內吸收分布迅速、消除快的特點與阿維菌素類藥物在哺乳動物體內的藥代的吸收代謝特征存在明顯區別。據報道,EPR澆潑劑(0.5 mg/kg)用于綿羊時,在給藥后3.13 d可達到最大血藥濃度6.20 ng/mL,消除半衰期為6.40 d[11]。EPR口服糊劑(0.2 mg/kg)用于泌乳期奶牛時,在給藥后1.60 d達到最大血藥濃度30.02 ng/mL,平均滯留時間為3 d,消除半衰期為1.24 d[12]。EPR注射液(0.2 mg/kg)在泌乳奶牛體內的藥代動力學研究結果顯示:在血漿中,EPR在給藥后39 h達到最大藥物濃度44.0 ng/mL,消除半衰期為164.0 h,平均滯留時間為211 h[13]。通過試驗數據對比,可以發現,EPR在雞體內的吸收分布與消除均明顯快于EPR在哺乳動物[14-15]體內的代謝情況。與EPR同屬于阿維菌素類藥物的伊維菌素(IVM)在家禽和哺乳動物中的藥代動力學特征也存在類似的區別。IVM在羊體內的藥代結果顯示[16],羊皮下注射或口服IVM后,分別在60.0和16.4 h達到最大血藥濃度30.8和22.0 ng/mL,消除半衰期分別為88.4和10.1 h。而給雞靜脈注射、皮下注射或口服IVM后,在血漿中可達到的最大血藥濃度分別為316.0 ng/mL、82.9 ng/mL(Tmax=6 h)和10.2 ng/mL(Tmax=3.36 h),消除半衰期分別為0.37、1.45和0.23 d[17],其吸收和藥物代謝速度明顯快于哺乳動物。IVM、EPR在哺乳動物和雞體內的藥代結果表明阿維菌素類藥物在雞體內具有吸收分布迅速、消除快的藥代動力學特征。將藥代結果與前期EPR對雞皮刺螨的殺螨效率試驗[7]相結合可推測,在臨床應用中,EPR需要通過多次給藥以達到徹底清除雞螨蟲的目的。此外,由于EPR在雞血漿中代謝消除快,可以有效避免藥物殘留造成的安全問題,但EPR在雞不同組織、蛋中的藥物殘留還未知,因此需要開展相關試驗來確定EPR在雞體、蛋中的殘留消除規律。
本研究首次建立了雞血漿中EPR的HPLC檢測方法,并開展了EPR在雞體內的藥代動力學研究,為EPR防治雞螨蟲新制劑研制與臨床應用提供了理論依據。

