二維斑點追蹤顯像(STI)評價硫酸吲哚酚(IS)對腎功能不全(CRF)大鼠的心臟毒性
孫敏敏 曹學森 潘翠珍 郭 瑤 譚 笑 舒先紅
(1復旦大學附屬中山醫院心超室,2腎內科 上海 200032; 3上海市影像醫學研究所 上海 200032;4上海市心血管病研究所 上海 200032)
心血管并發癥是終末期腎病(end-stage renal disease,ESRD)患者的首要死因[1],傳統心血管疾病危險因素不能完全解釋患者心血管死亡風險顯著增加。尿毒癥毒素是ESRD患者心血管并發癥的獨立危險因素[2]。硫酸吲哚酚(indoxyl sulfate,IS)作為一種代表性蛋白結合腎臟毒素,在患者體內升高最早且最明顯,常規透析方法無法清除,在動脈粥樣硬化和心肌肥厚過程中參與關鍵步驟[3-4]。IS在體外可引起心肌細胞肥厚及成纖維細胞纖維合成增加[5],在高血壓大鼠模型中IS可通過氧化應激促進心肌細胞纖維化[6],故無創性超聲心動圖監測IS引起的心臟重構和功能改變對臨床意義重大。斑點追蹤顯像(speckle tracking imaging,STI)基于高幀頻灰階超聲圖像,實時跟蹤心肌內回聲斑點的空間運動,時間及空間分辨率較高,無角度依賴性[7-8]。本研究采用5/6腎切除SD大鼠模型,通過外源性IS誘導,明確IS作用下在體心臟的形態、功能及病理改變,同時采用STI技術對大鼠的左室功能進行評估,以探測其應用價值。
資料和方法
實驗試劑麻醉用5%戊巴比妥鈉(國藥集團化學有限公司);0.9%氯化鈉注射液(百特制藥有限公司);硫酸吲哚酚(美國Sigma公司)。
儀器和分析軟件Vivid E9心臟超聲診斷儀(美國GE公司)配備12S探頭(11 MHz),數據分析采用EchoPac BT12工作站。
研究對象30只6周齡SD大鼠,體質量為(220±20)g,由復旦大學上海醫學院動物實驗中心提供和籠養,室溫和相對濕度恒定,食物及水源供應充足。隨機分為3組,每組10只,即假手術(sham operation,SOR)組、腎功能不全手術對照(chronic renal failure,CRF)組和CRF+IS處理組。本研究獲得復旦大學實驗動物關懷和利用委員會的許可。
研究方法
動物模型制備及實驗流程 采用5/6腎切除術[9]建立腎功能不全大鼠模型。一期手術采用5%戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,左腎被腹正中暴露切開,暴露左腎,剝離腎包膜,將左腎上下級各1/ 3 切除,明膠海綿壓迫止血并縫合。一期手術后1周行二期手術,同樣方法麻醉,右側背部切開暴露右腎,結扎腎蒂,摘除右腎。SOR組與5/6腎切除術組動物同期進行二次手術,僅切開并剝離腎包膜暴露腎臟后關腹。術后6周(13周齡)采集血液標本,測血肌酐較基線上升2~3倍,建模成功。IS組隔天腹腔注射IS(100 mg/kg)[10]24周,每次注射前配置IS溶液,另兩組注射等量生理鹽水24周。所有大鼠在IS注射結束1周時采集血液標本,測量肌酐及IS濃度,采集心超圖像后處死,采集心臟標本,血液IS濃度測量采用高效液相色譜-電噴霧電離-串聯質譜(HPLC-ESI-MS/MS)法[11]。
超聲心動圖像采集 所有大鼠均于基線狀態下及IS注射結束1周時采集常規二維及斑點追蹤顯像圖像,采用GE E9超聲診斷儀,12S探頭,采集時頻率設為11 MHz,深度為2.5 cm,幀頻為(220±25)F/s。圖像定量分析采用EchoPAC BT12脫機軟件。
二維超聲圖像定量分析 在大鼠左室胸骨旁長軸切面,將取樣線盡量垂直穿過室間隔及二尖瓣前葉瓣尖,取M型,測量左室舒張末內徑(left ventricular end-diastolic diameter,LVEDD)及收縮末內徑(left ventricular end-systolic diameter,LVESD),計算左室射血分數(left ventricular ejection fraction,LVEF)。于左室乳頭肌水平短軸根據時鐘法分為4個象限,于每個象限內分別測量左室壁厚度且取平均值為左室壁厚度(left ventricular wall thickness,LVWT)。
斑點追蹤圖像分析 采用大鼠左室乳頭肌水平短軸圖像,進入斑點追蹤分析2D分析系統,手動描繪心內膜,調整追蹤環寬度,軟件自動識別并跟蹤整個心動周期內的左室壁聲學斑點,自動計算出左室應變及應變率指標(圖1):環向應變(circumferential strain,CS)、徑向應變(radial strain,RS)、徑向應變率(RS rate,SRr)和環向應變率(CS rate,SRc),徑向應變率舒張早期E’峰(E’-SRr)和徑向應變率舒張晚期A’峰(A’-SRr),環向應變率舒張早期E’峰(E’-SRc)和環向應變率舒張晚期A’峰(A’-SRc),并計算左室舒張功能參數徑向E’/A’-SRr和環向E’/A’-SRc[12]。每個圖像分別分析3個心動周期并取平均值。
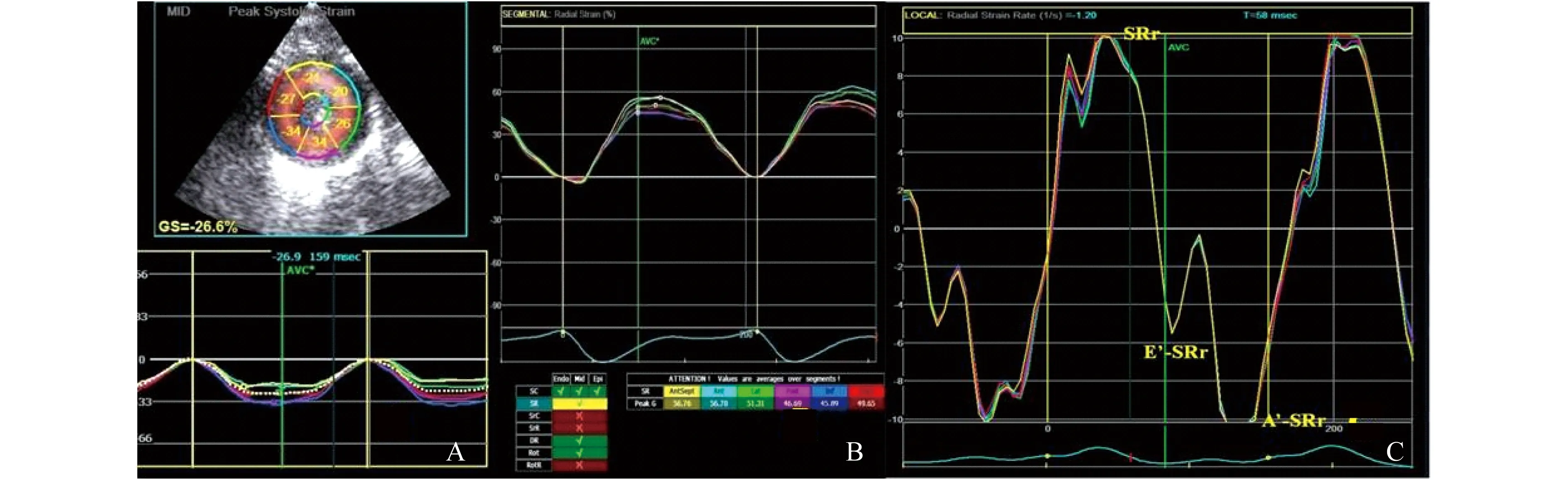
CS:Circumferential strain;RS:Radial strain;RSr:RS rate;STI:speckle tracking imaging.
圖1 STI測量左室CS (A)、RS (B)及RSr (C)
Fig 1 CS (A),RS (B) and RSr (C) of left ventricle by STI
病理學檢查圖像采集結束后處死大鼠,取心臟,稱重,觀察心肌大體形態。HE染色,光鏡下觀察心肌細胞形態(細胞核、胞質、橫紋),細胞核呈藍色,細胞質呈淡紅色,評價心肌細胞肥厚及壞死程度。在200倍鏡下攝片,測量鏡下細胞總面積及細胞數,計算單個細胞面積平均值。Masson染色,觀察心肌細胞纖維化程度,心臟組織中膠原纖維呈藍色。病理切片評分由1名經驗豐富且不知情的病理科醫師完成。
一致性檢驗對10例隨機選取的大鼠圖像使用斑點追蹤顯像分析的測量結果進行一致性檢驗。觀察者內差異為同一觀察者間隔24 h以上的2次測量結果比較,觀察者間差異為2位獨立觀察者各自的測量結果比較,采用組內相關系數(intra-class correlation coefficient,ICC)表示。
結 果
實驗室數據IS組中3只大鼠在注射IS后12~20周猝死,未采集實驗后的超聲圖像,故未納入最終統計分析。經解剖發現,這3只大鼠中2只存在大量心包和腹腔積液,1只在注射部位出現巨大壞死包塊。3組大鼠基線、建模成功及實驗結束時的血肌酐數值及血IS值見表1。
常規超聲心動圖數據比較基線狀態下3組參數差異無統計學意義。3組LVEDD較基線均明顯增大;SOR組室壁厚度與基線差異無統計學意義,而另兩組室壁厚度較基線均明顯增厚(P均<0.05);SOR組LVEF由92%±3%降至88%±5%(P<0.001),而另兩組LVEF術后與基線無明顯改變(圖2和表2~3)。
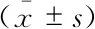
表1 3組大鼠基線、建模成功和實驗結束時的血肌酐值及血IS值Tab 1 Serum creatinine and IS on baseline,successful modeling and post-operation in the 3 groups of rats
(1)vs.Baseline,(2)vs. SOR group,(3)vs. CRF group,P<0.05.Scr:Serum creatinine;IS:Indoxyl sulfate.

A:SOR group;B:CRF group;C:IS group.
圖2 大鼠術后左室乳頭肌水平短軸圖像
Fig 2 Images of short axis of left ventricle after operations in rats
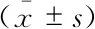
表2 3組大鼠基線與實驗后心超數據比較Tab 2 Comparison of echocardiographic parameters on baseline and post-operation in the 3 groups of rats
HR:Heart rate;LVEDD:Left ventricular end-diastolic diameter;LVWT:Left ventricular wall thickness;LVEF:Left ventricular ejection fraction;RS:Radial strain;CS:Circumferential strain;SRr:RS rate;SRc:CS rate.
應變參數比較基線狀態下3組CS及RS差異無統計學意義。實驗前后比較,RS在CRF組中顯著增加(P=0.017),RS及CS在IS組及SOR組差異均無統計學意義(表3)。
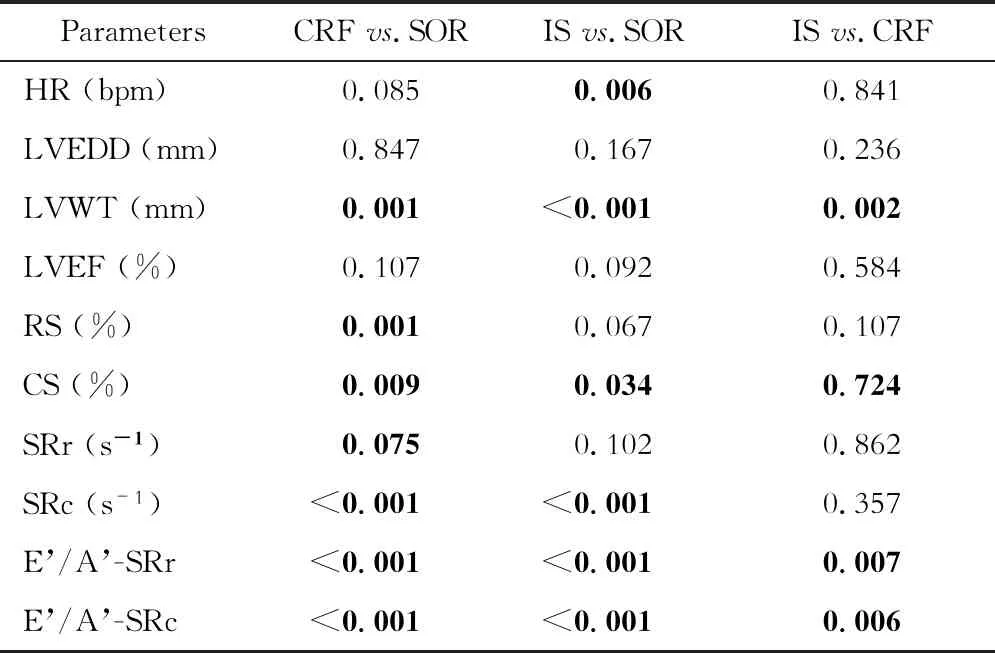
表3 3組大鼠實驗后心超數據的組間比較Tab 3 Pairwise comparison of echocardiographic parameters on post-operation in the 3 groups of rats (P value)
Abbreviations refer to Tab 2.
應變率參數比較基線狀態下比較3組SRr、SRc、E’/A’-SRr及E’/A’-SRc,差異均無統計學意義。CRF組和IS組實驗后SRc及SRr較基線均明顯增加(P<0.001);而SOR組實驗前后SRc無顯著變化,實驗后SRr較基線明顯增加(P=0.001)。實驗后3組SRc及SRr比較差異無統計學意義。IS組和CRF組實驗后E’/A’-SRc和E’/A’-SRr較基線均顯著降低(P均<0.001),SOR組則無顯著變化。實驗后IS組E’/A’-SRc和E’/A’-SRr均顯著低于CRF組(P=0.01和0.001,表3)。
一致性檢驗STI指標RS、CS、SRr、SRc、E’/A’-SRr和E’/A’-SRc的觀察者內差異的ICC值分別為0.93(95%CI:0.79~0.98,P<0.001)、0.91(95%CI:0.76~0.95,P<0.001)、0.92(95%CI:0.80~0.96,P<0.001)、0.91(95%CI:0.73~0.97,P<0.001)、0.88(95%CI:0.70~0.93,P=0.001)和0.89(95%CI:0.71~0.94,P=0.001),觀察者間差異的ICC值分別為0.90(95%CI:0.75~0.95,P<0.001)、0.89(95%CI:0.73~0.94,P<0.001)、0.89(95%CI:0.73~0.93,P<0.001)、0.88(95%CI:0.72~0.93,P<0.001)、0.83(95%CI:0.70~0.92,P=0.001)和0.85(95%CI:0.73~0.94,P=0.001)。提示STI測量獲得的應變及應變率參數一致性較好。
病理學檢查CRF組及IS組的心臟重量均大于SOR組(P<0.05)。HE染色示:SOR組、CRF組及IS組心肌細胞面積依次增大(P<0.05);Masson染色示:3組心肌纖維化程度依次增加(圖3,表4)。
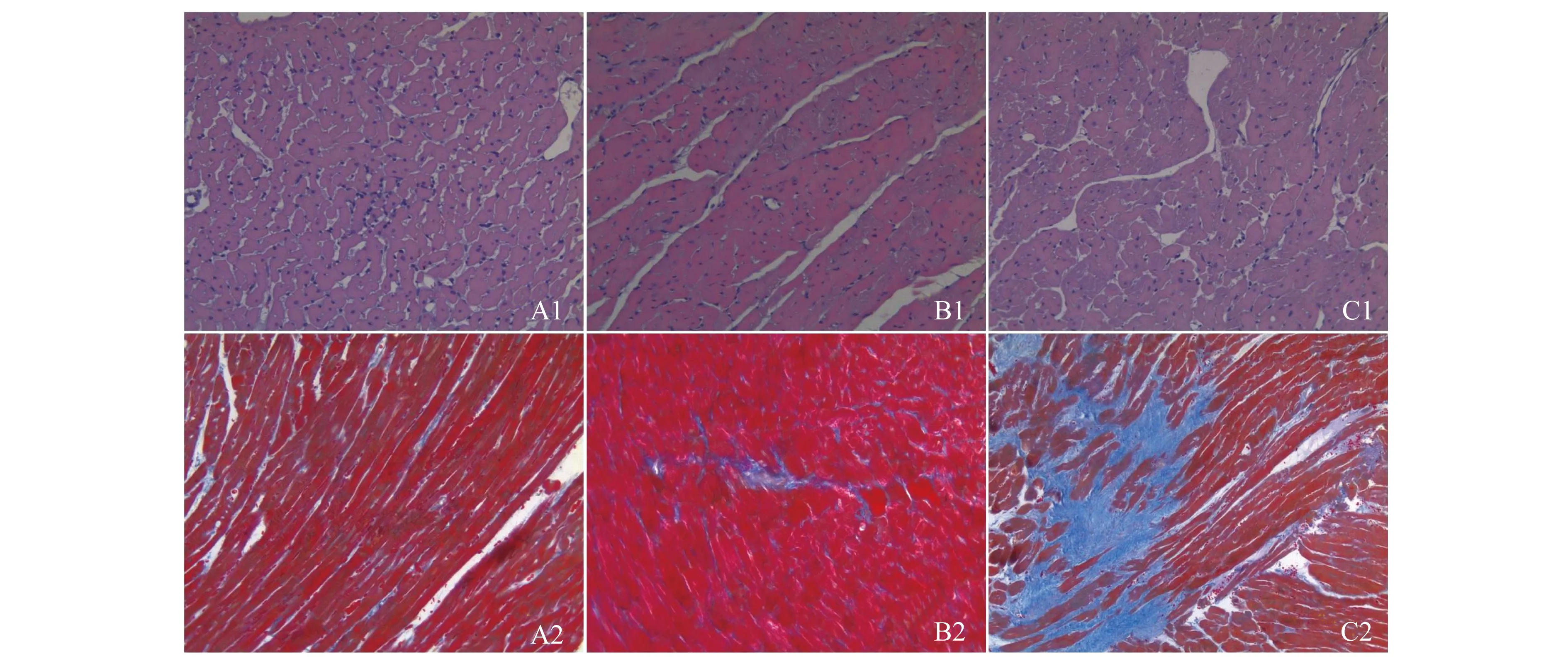
A:SOR group;B:CRF group;C:IS group.A1,B1 and C1:HE staining;A2,B2 and C2:Masson staining (blue area indicated fibrosis).
圖3 大鼠心臟的病理學檢查(*200)
Fig 3 Pathologial examination of rats’ cardiac tissues (*200)
表4 3組大鼠心臟重量及心肌細胞面積的比較Tab 4 Histological analysis of heart weight and myocardial cell area in the 3 groups of rats
(1)CRFvs.SOR;(2)ISvs.SOR;(3)ISvs.CRF.
討 論
IS分子式為C8H7NO4S,相對分子質量為213 210,為陰離子蛋白結合尿毒癥毒素,是腸道細菌酵解蛋白質的產物。腸道細菌分解色氨酸產生吲哚,經門靜脈入肝,經羥化生成3-羥基吲哚,再經硫酸化生成IS。循環中90%以上的IS和白蛋白非共價結合,正常情況下IS通過近端腎小管分泌由尿液排出體外,腎功能受損時在體內蓄積[13]。近年來IS 在ESRD 患者心血管并發癥中的作用越來越受到重視,研究發現:IS是預測ESRD患者并發心血管疾病的重要標志物[14];血漿IS高濃度是全因死亡和心血管疾病死亡的強力預測因子[15];258例維持性血液透析患者中,血漿IS高濃度組較低濃度組的心衰發生風險增加5.31倍[16]。基礎研究證實,IS可通過多種途徑參與動脈粥樣硬化的發生[17-18],同時通過誘導氧化應激[6]、激活p38 MAPK、p42/44 MAPK 和NF-κB[19]、抑制腎臟Klotho基因表達[20]等多條通路促進心肌細胞肥厚和膠原纖維增生;動物實驗證實,口服碳吸附劑AST-120可通過抑制IS前體的吸收,顯著降低腎功能不全大鼠的心肌纖維化和改善預后[21]。
目前缺乏IS在體研究資料,更鮮有運用超聲心動圖評估的報道。本研究采用常規超聲測量,發現CRF組和IS組左室心肌明顯肥厚,且IS組心肌肥厚更顯著,與心臟大體重量和病理結果一致,證實超聲心動圖在評估左心室壁肥厚方面的可行性和準確性。反之,LVEF在CRF組和IS組均未顯著受損,甚至出現代償性增強,可能與本實驗采用Teichholtz校正公式計算LVEF有關,Teichholtz公式側重于徑向收縮的成分,而心肌肥厚的功能變化早期常表現為縱向收縮降低而徑向收縮代償性增強[22]。該結果從側面證實了采用常規超聲參數LVEF評估心臟受損的局限性和滯后性。
STI技術基于高幀頻灰階超聲圖像,實時跟蹤心肌內回聲斑點的空間運動,具有較高的時間及空間分辨率,無角度依賴性,能分辨心肌的主動運動和被動牽拉,多項研究證實其能敏感準確發現心肌的結構功能改變,且與磁共振結果高度相關[23]。本研究采用STI顯示RS在CRF組中顯著增加,CS也有增加的趨勢,而IS組前后并無顯著變化,提示IS組的心肌代償能力下降。Kouzu等[24]在高血壓人群中發現其縱向應變較正常人降低,但其早期RS較正常人增強,尿毒癥性心肌改變發生縱向應變的降低是多個研究獲得的共識,而對于RS及CS是否發生改變仍有爭議,由于大鼠心臟的超聲切面非常有限,無法獲得滿意的心尖部四腔心等切面,故未能成功分析長軸應變數據,這也是本實驗的局限性之一。
嚙齒類動物作為研究對象,由于心率快,超聲切面有限,左心室舒張功能評估一直是個難點,而STI的應變率顯像則為評價左心室的舒張功能開辟了一條全新的道路。文獻報道采用應變率顯像評價左室舒張功能更為敏感可靠[12]。舒張功能反映心肌細胞的順應能力,心肌細胞肥厚、壞死及纖維化均可導致心肌的順應性下降而產生舒張功能障礙,而舒張功能障礙可通過心室的充盈不良進一步影響左心室的收縮功能[25]。腎功能不全患者中舒張功能障礙發生率達50%~65%,且其發生早于收縮功能障礙[26],與不良預后密切相關[27]。Sato等[28]報道高血漿IS 與左室舒張功能障礙密切相關,這可能與IS刺激心肌細胞肥大、加重纖維化有關。本研究采用STI技術獲得左心室舒張功能參數,通過比較顯示CRF組和IS組的左心室舒張功能出現顯著減退,且IS組減退程度更為顯著,證實了STI在動物實驗中評價左心室舒張功能的可行性與準確性。
嚙齒類動物的心率較快,對圖像的幀頻要求較高,常規二維超聲無法兼顧幀頻和清晰度,導致資料無法分析。STI幀頻較高,在本研究中可達到220~250幀/s,具備較高的時間分辨率[29],是嚙齒類動物實驗中心臟超聲評估的首選。
本研究的不足之處:(1)未設立單純注射IS組,在腎功能正常人群中IS的清除率為(3 023±533) mL·min-1·1.73 m-2,是肌酐的(22±4)倍[30],故未設立單純注射IS大鼠組作為對照;(2)未能成功分析獲得縱向應變資料;(3) IS組中有3例大鼠在IS注射期間猝死,并出現心包、胸腔積液和局部膿腫包塊,可能與IS注射部位消毒操作不規范及IS對局部組織的刺激作用有關,應規范操作以避免類似情況的發生;(4)動物樣本量較小,未通過IS注射量進行分組研究,未能進一步分析IS導致的心肌細胞病變是否具有劑量相關性,這將成為下一步的研究方向。
IS可以加重腎功能不全大鼠的心肌損害,表現為心肌細胞的肥厚、壞死和纖維化,且左室舒張功能的下降早于收縮功能受損,應變率顯像的舒張功能指標可敏感檢測IS導致的左室舒張功能改變。

