磁共振擴散加權成像(DWI)評估前列腺癌Gleason評分(GS):單指數模型與峰度模型比較
單穎嬋 劉 鍇 曾蒙蘇 周建軍
(1復旦大學附屬中山醫院放射科 上海 200032; 2上海市影像醫學研究所 上海 200032)
前列腺癌在全球癌癥發病率調查中排名居高不下,死亡率僅次于肺癌[1-2]。前列腺癌是一種高度異質性的腫瘤,即在同一個癌癥患者的腺體內同時存在幾種不同分化程度的癌細胞群體。Gleason評分(Gleason score,GS)系統是目前應用最廣泛的評斷前列腺癌惡性程度的評分系統,其主要病理組織學依據為癌灶腺體結構形態,GS越高表明惡性程度越高,侵襲性相應增加,越容易發生遠處轉移,因此GS可以作為患者進一步臨床治療的良好依據。穿刺活檢具有一定的風險且有可能引發后遺癥,如出血、感染等,文獻報道的診斷率約48%[3],因此穿刺結果陰性并不能排除癌灶的存在,仍然需要隨訪或者重復穿刺。常規經直腸超聲引導下的系統穿刺活檢不能評估腫瘤大小,且存在由于細針穿刺帶來的抽樣誤差導致的漏診代表性病灶,致使穿刺病理結果得到的GS可能并不準確。
磁共振擴散加權成像(diffusion-weighted imaging,DWI)是唯一無創性評估活體內組織水分子擴散運動的技術,研究表明DWI參數表觀擴散系數(apparent diffusion coefficient,ADC)值與GS有良好的相關性[4-6]。但是傳統的ADC值是通過單指數模型計算得到的,該模型假設組織中水分子的擴散是服從高斯分布,即純自由水狀態,但實際上人體組織尤其是腫瘤組織中的水分子進行的擴散運動遠比這要復雜得多。擴散峰度模型引入參數Kapp評估峰度,由于高斯行為的偏差在水分子由其中擴散的組織復雜性決定,因此這種擴散峰度可以被視為組織結構復雜程度的量度,組織微結構空間越復雜越不規則,峰度值越高[7]。本文旨在探究這兩種模型在評估前列腺癌的Gleason分級中的診斷能力及二者是否存在差異。
資料和方法
臨床資料本研究為前瞻性研究,通過復旦大學附屬中山醫院倫理委員會的審批,在檢查前均獲得患者本人的知情同意。收集本院2017年5月至2018年12月間接受前列腺3.0T多參數磁共振成像(multiparametric MRI,mpMRI)的患者。納入標準:(1)臨床疑診前列腺疾病行前列腺MRI;(2)未經過治療的首診病例;(3)手術或穿刺病理證實為腺癌,進行GS,且獲得的病理結果與MRI相隔時間不超過3個月。排除標準:(1)存在MRI禁忌證;(2)病灶長徑<5 mm,無法勾畫ROI或存在很大采樣誤差的可能;(3)影像上無法明確病灶;(4)患者配合度差,圖像質量不佳;(5)僅獲得穿刺病理,且GS<9。
最終納入患者43名(表1),年齡57~85歲,平均年齡為70歲,中位年齡為69歲,自述存在相關臨床表現的19名,包括尿頻尿急、排尿困難、夜尿增多、肉眼血尿、體重短期減輕中的一種或幾種,另外有一名患者自述有感染病史,抗感染治療有效。術前查得最高PSA水平范圍為4.36~102.10 ng/mL,平均(28.87±26.02) ng/mL,中位數為20.89 ng/mL。其中40名經穿刺后確診行根治術治療,3名穿刺確診后或在MRI檢查中發現遠處轉移選擇內分泌治療,其中2名GS 4+5=9,1名GS 5+4=9。以上病例依據GS大小作如下分組:低危組GS ≤3+4,13例;中危組GS =4+3,11例;高危組GS >7,19例。
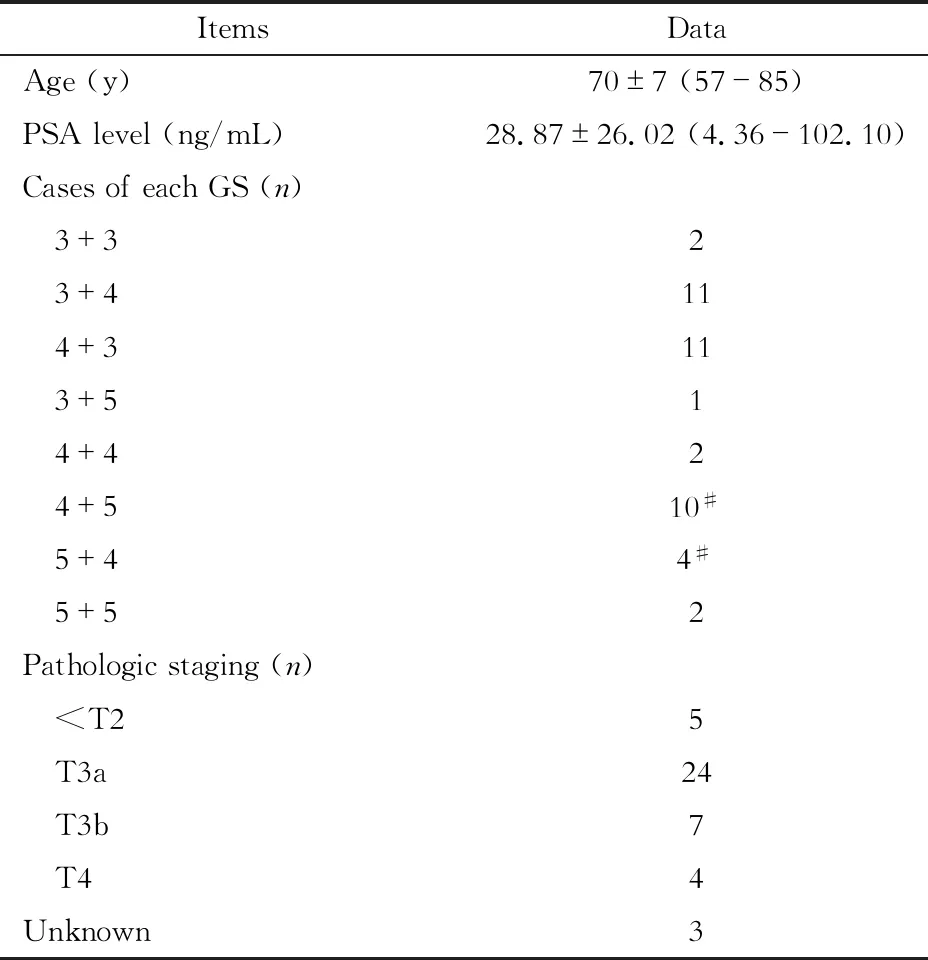
表1 43名入組患者臨床資料數據Tab 1 Clinical data of the 43 patients
#3 cases of GS=9 were evaluated by biopsy.
MR檢查方案使用美國GE公司生產的750型3.0T磁共振掃描儀,32通道腹部線圈,檢查序列包括:常規T1-weighted imaging(T1WI)、T2-weighted imaging(T2WI)、DWI及動態增強磁共振掃描(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)。T2WI使用螺旋槳技術加抑脂(Propeller fs T2WI),并分別獲取橫斷位、冠狀位及矢狀位3組圖像,具體掃描參數如下:橫斷位T2WI,TR 7 972 ms,TE 93 ms,層厚3.0 mm,層間距0.5 mm,NEX 3.0次,FOV 20 cm*20 cm,矩陣320*320;冠狀位T2WI,TR 6432 ms,TE 95 ms,層厚3.0 mm,層間距0.5 mm,NEX 2.0次,FOV 22 cm*22 cm,矩陣320*320;矢狀位T2WI,TR 7 486 ms,TE 106 ms,層厚3.0 mm,層間距0.5 mm,NEX 2.5次,FOV 22 cm*22 cm,矩陣320*320。DWI檢查采用單次激發自旋平面回波序列行橫斷位掃描,TR 2 000 ms,TE minimum,層厚3.0 mm,層間距0.5 mm,矩陣128*160,FOV 28 cm*25.2 cm,b值采用0、50、100、200、900、1 100、1 400、1 800、2 200、2 500和3 000 s/mm2,對應NEX分別為1、1、1、1、4、4、6、8、10、10和12。DCE-MRI采用3D T1 LAVA FLEX序列,并使用了拉鏈技術,具體參數如下:TR 3.6 ms,TE Min Full,層厚4.0 mm (ZIP2),層間距0 mm,矩陣160*128,FOV 28 cm*28 cm,掃描50期(第一期為增強前蒙片)。使用釓雙銨對比劑,劑量為0.1 mmol/kg,經肘靜脈以2~3 mL/s的速度團注。
DWI圖像的數據測量及分析由2位有2年以上前列腺疾病研究經驗的放射科醫師采用盲法獨立閱片,分別對病灶的位置、范圍、信號特點等進行評價,依據PI-RADS V2診斷標準對可疑灶進行評分,每個患者均獲得1~4個具有PI-RADS V2評分的病灶。依據病理結果共同討論決定用于勾畫ROI的病灶,標準:(1)病灶在T2WI、DWI、DCE-MRI上均能在同一位置找到,且范圍相仿;(2)屬于PI-RADS范疇的3~5分;(3)病灶體積(在DWI上,b=2 200)≥0.5 cm3。病理結果指示病灶位置(腫瘤區):(1)有2個以內滿足以上標準的病灶(后文簡稱標準病灶),則選擇PI-RADS范疇得分最高者(后文簡稱得分);(2)有超過2個標準病灶的,則選擇得分最高的兩個,當存在相同評分需要選擇時,選擇體積最大的一個。同一個患者中選取的所有標準灶視為一個ROI,取參數平均值分析。數據的測量由2名醫師分別使用 IMAge/enGINE MR_Diffusion后處理軟件V2.0.3在DWI (b=2 200)上勾畫,避開尿道、輸精管、出血灶。該軟件的ROI 3D勾畫技術較逐層勾畫更簡便,并提高了病灶的自動識別,最后由軟件計算得出每個ROI的單指數模型參數ADC的平均值和峰度模型參數Kapp、Dapp的平均值。數據分析使用2名觀察者所測得每個參數的均值。單指數模型及其參數計算公式為Sb/S0=exp (-b*ADC),其中Sb是對應b值下的信號值,S0即b=0時的信號基線值;峰度模型及參數服從公式Sb/S0=exp (-b*Dapp+b2*Dapp*Kapp/6),參數Dapp為校正后的ADC;表征高斯分布的部分,Kapp為表觀擴散峰度值,為無量綱參數。
統計學分析應用SPSS 20.0版及MedCalc 15.8版軟件系統作統計分析。使用組間相關系數(interclass correlation coefficient,ICC)分析評估2名觀察者所測得數據間的一致性(<0.40,一致性差;0.40~0.59,一致性一般;0.60~0.74,一致性好;0.75~1.00,一致性優異);Shapiro-Wilk檢驗用于檢驗各參數是否服從正態分布,P>0.05服從正態分布;使用Spearman 相關分析檢驗癌區DW參數與Gleason評分的相關性,并分析ADC和Kapp的相關性(0.0~0.2,非常弱甚至可以忽略;0.2~0.4,弱;0.4~0.7,中等;0.7~0.9,強;0.9~1.0非常強);單因素方差分析和獨立樣本t檢驗用于三組及兩組間參數差異顯著性分析,使用Kruskal-Wallis單因素方差分析(即κ樣本)及Mann-Whitney U檢驗分別行三組及兩組間非參數檢驗分析;通過ROC曲線評估各參數鑒別診斷不同GS分組前列腺癌的效能,參數間AUC差異分析使用DeLong方法,并得出95%CI,供參考的診斷臨界值及其相應的敏感性、特異性、約登指數。P<0.05為差異有統計學意義,且均為雙尾檢驗。
結 果
共勾畫ROI 43個,所涵蓋癌灶的PI-RADS綜合得分情況為:3分者4個,4分者24個,5分者26個,其中有1個ROI同時包含2個評分為4分的病灶,10個ROI包含評分為4、5分的病灶。
組間一致性及參數正態性檢驗2名觀察者所測得43個ROI參數ADC、Kapp、Dapp值均具有良好的一致性,其ICC值分別為0.95 (95% CI:0.90~0.97)、0.94 (95%CI:0.90~0.97)和0.97(95%CI:0.94~0.98)。ADC (P=0.52)、Kapp (P=0.18)服從正態分布,Dapp (P=0.03)不服從正態分布。
DWI參數與癌灶GS相關性分析參數ADC、Dapp與癌灶的GS呈中等程度負相關,而Kapp則與其呈中等程度正相關(表2)。此外,ADC與Kapp呈強的負相關(ρ=-0.856,P=0.00)。

表2 各參數與癌灶GS的Spearman相關系數分析結果Tab 2 Spearman’s rank correlation analysis of parameters and GS
DWI參數鑒別不同GS組別前列腺癌效能分析ADC、Dapp和Kapp在組別GS≤3+4和GS>7間差異均有統計學意義(P<0.05);在組別GS≤3+4和GS=4+3間的差異均無統計學意義;僅Kapp在組別GS=4+3和GS>7間的差異具有統計學意義(P<0.01);此外,ADC、Dapp和Kapp在組別GS≤3+4和GS>3+4間差異均有統計學意義(P<0.05)。ROC曲線分析顯示Kapp的AUC最大,但是3個參數的AUC比較差異無統計學意義(P=0.58~0.76)。具體結果參見表3、4及圖1,圖2、3為典型病例示例。
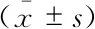
表3 擴散參數高低危組間差異顯著性檢驗結果Tab 3 Significance test of difference of DW parameters between Low- and High-risk groups
aADC and Kapp were analyzed by independent-samplesttest;bDapp was analyzed by Mann-WhitneyUtest.
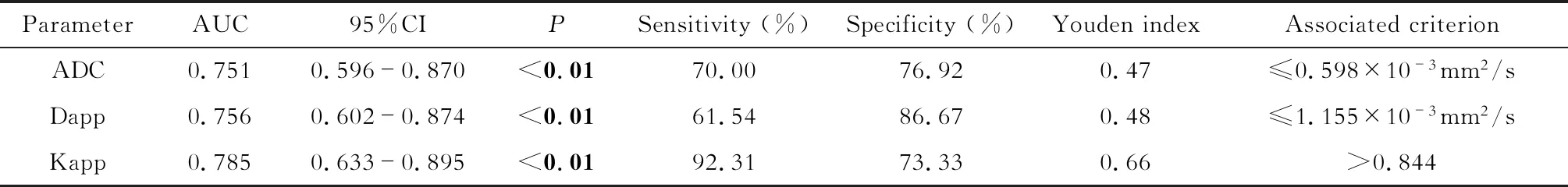
表4 擴散參數鑒別診斷GS≤3+4和GS>3+4組的ROC曲線分析結果Tab 4 ROC curve analysis of DW parameters for differentiating GS≤3+4 and GS>3+4 groups
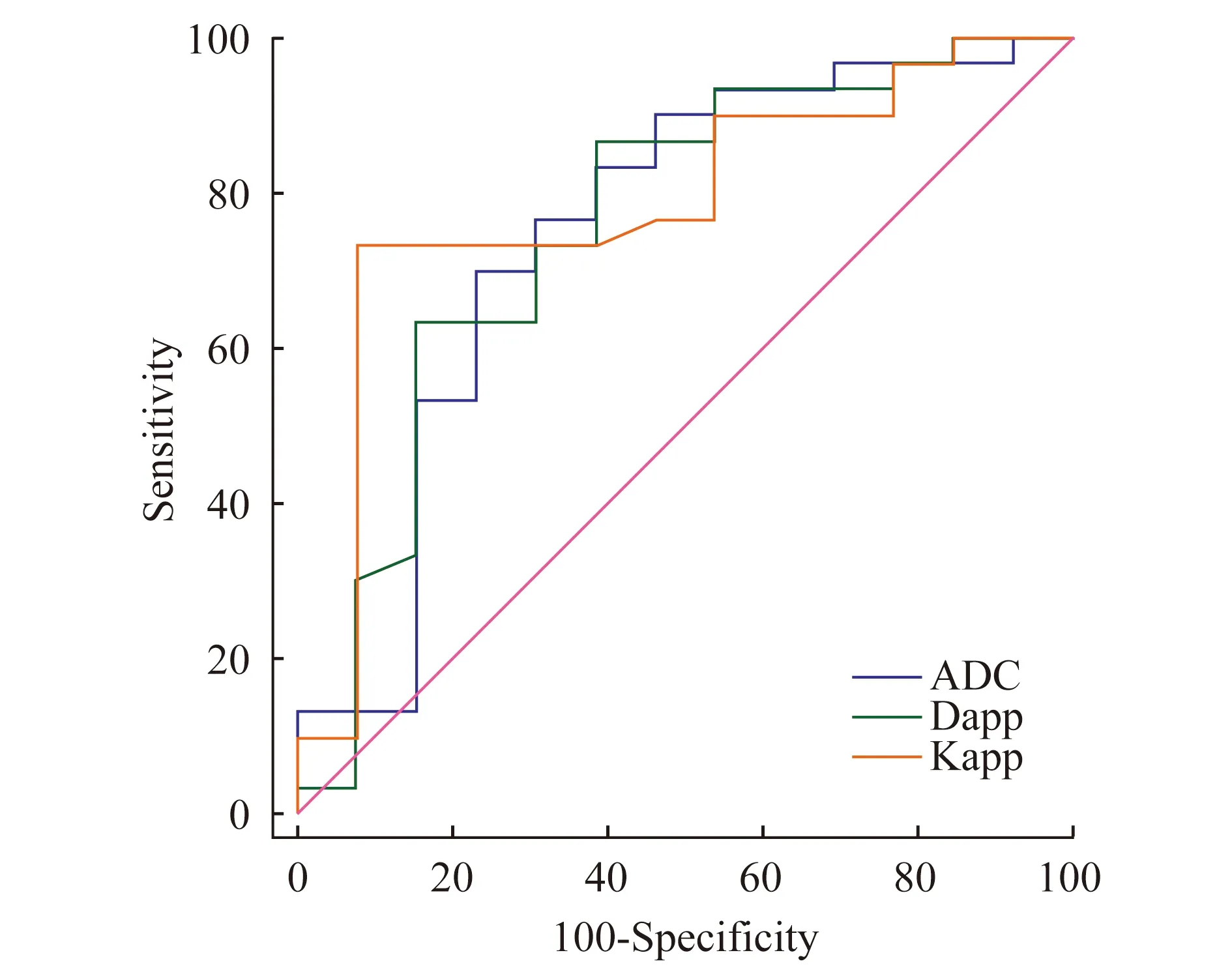
The receiver operating characteristic curve of ADC,Dapp,Kapp for differentiating GS≤3+4 and GS>3+4 groups.Gray line:Chance diagonal.
圖1 DW參數ROC曲線比較圖
Fig 1 Comparison of ROC curves of DW parameters
討 論
本研究得出單指數模型的參數ADC值與峰度模型的參數Dapp、Kapp均能鑒別診斷高低危前列腺癌。單指數模型即傳統ADC,現已在臨床工作中得到了很好的推廣。以往研究已證實前列腺良性疾病的ADC值高于惡性腫瘤[8],ADC值對前列腺癌病灶侵襲性預測的研究在不斷開展。前列腺癌腫瘤組織細胞組分隨著GS增加[9-10],利于擴散的基質、腺體腔隙組分減少,不利于擴散的血管及上皮細胞的成分增多,從而影響組織中自由水分子的擴散運動,進而反映在ADC值的改變上[11-12]。許多研究表明ADC值與GS存在負相關[5,6,13-16],本研究也得出類似結果。Anwar等[13]探究ADC值(使用b值50、400和800 s/mm2,1.5T)預測外周帶前列腺癌侵襲性的研究結果顯示,ADC值有助于鑒別診斷低危(GS=6)和高危(GS>7)的前列腺癌,亦能鑒別診斷中危(GS=7)和高危(GS>7)的前列腺癌,但是在低、中危組間ADC差異無統計學意義。Wu等[16]的研究(50、400、800 s/mm2,3.0T)也得到了相似的結果,這有可能是因為GS=6和GS=7的腫瘤組織微觀結構改變的差異不大,他們還得出腫瘤組織中ADC最小值在GS=3+3組與GS=3+4組之間差異有統計學意義。既往的研究中使用的GS分組依據多來自活檢穿刺,GS分組的真實情況存疑。本研究中使用的病理結果除了3個高分組病例(GS=4+5/5+4)外均來自根治術后的大體標本,因此分組結果更為可靠。近年研究表明GS=4+3的前列腺癌較GS=3+4者更容易發生轉移事件,概率分別為2.8%和0.9%,總體生存率前者較后者降低23%[17]。GS=3+4的腫瘤具有較高的生物學惰性和較好的預后,推薦積極監測,避免過度治療[18]。本研究結果表示ADC能夠鑒別GS≤3+4和GS>3+4的腫瘤,有助于臨床決策,但是分別比較GS=4+3和GS≤3+4、GS>7癌區ADC值差異無統計學意義,一方面可能是受樣本量的限制,另一方面也可能是因為微觀結構差異不明顯。
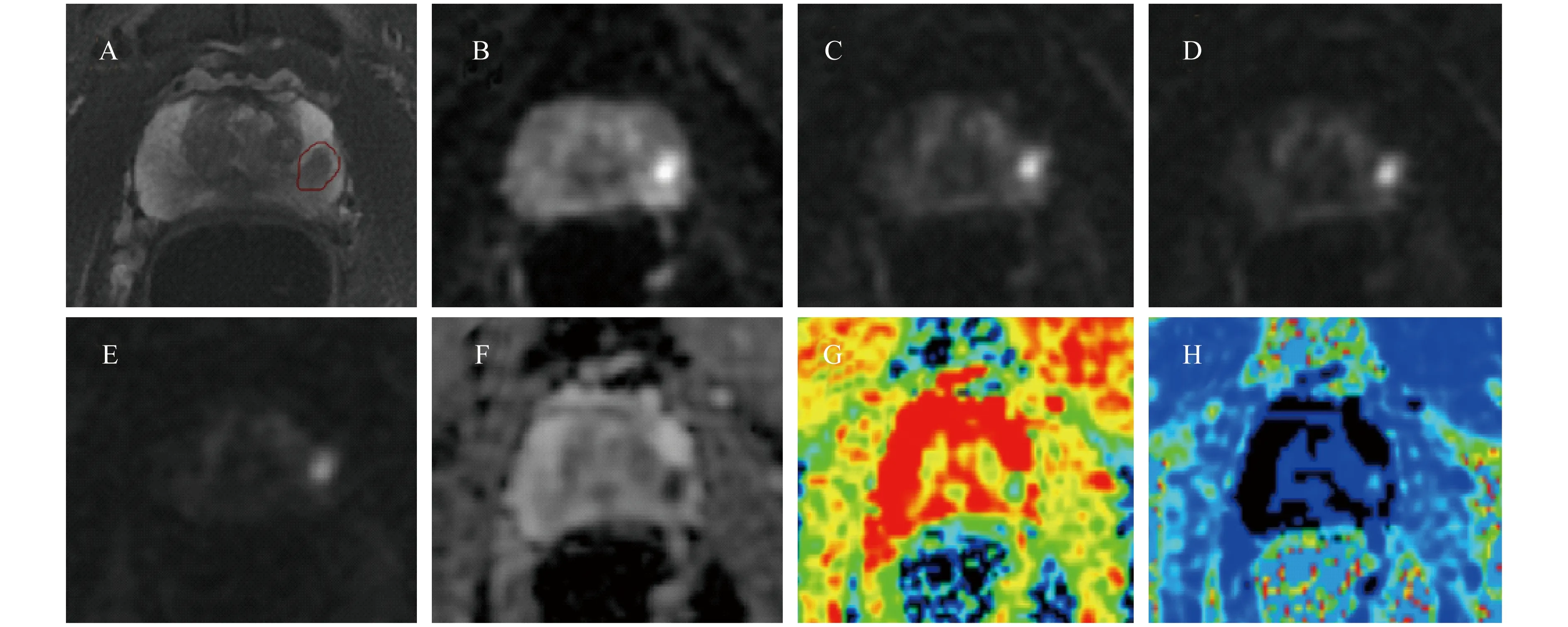
Images show a case of seventy two-year-old man with prostate cancer (GS 3+4=7,lesions in left lobe of prostate, 圖2 典型病例1 Images show a seventy-year-old man with prostate cancer (GS 4+5=9,lesions in both lobes of prostate,T3a,PSA 7.9 ng/mL).The index lesion (1.8 cm) in the left PZ,PI-RADS V2 category 5.A:The lesion is indicated by an red circle on T2WI;B-E:Images obtained with b values of 900,1 100,2 200 and 3 000 s/mm2,as the b value increases,the signal of the normal tissue is gradually suppressed,whereas the tumor’s signal becomes more and more obvious;F:Mean ADC value of ROI is 0.544 *10-3mm2/s on ADC map;G-H:Dapp and Kapp values are 0.940*10-3mm2/s and 0.943 on pseudo color maps,respectively. 圖3 典型病例2 單指數模型是假定組織中水分子的擴散運動,是服從高斯分布的最簡單的擬合方式。然而實際上組織中水分子的擴散運動要比純水的運動復雜,而且磁共振設備的更新使高b值DWI掃描成為可能,隨著b值的增加水分子擴散的非高斯特性越發明顯。DWI的高等模型之一峰度模型即是以水分子的非高斯運動來曲線擬合的,引入了擴散峰度系數Kapp,并且生成經過校正后的ADC-Dapp。近年有研究表明峰度參數Kapp與前列腺癌的病理參數中細胞質、基質占比呈負相關,與細胞占比呈正相關[12]。細胞內擴散可以通過例如帶電荷的大分子(包括蛋白質和極化膜)來限制,導致水分子的締合。這些水分子的細胞內相互作用促進非高斯擴散行為,增加了峰度,尤其是在具有許多大界面的細胞和不規則、異質性高的組織環境中增加明顯。因此隨著腫瘤GS升高,Kapp值增加,本研究結果表明Kapp在鑒別高低危前列腺癌方面具有良好的診斷效能。Suo等[19]的研究(b=0、500、80、1 200、1 500、2 000 s/mm2,3.0T)結果得出Kapp和Dapp能有效鑒別正常前列腺外周帶組織和前列腺癌,且比ADC的重疊范圍小,Kapp和ADC均能鑒別診斷GS=6、7和GS ≥8的前列腺癌,而Dapp與GS之間無相關性。這一點與本實驗得出的結果不同,可能是抽樣誤差導致。Dapp與ADC表達相近的意義,數值上前者較后者稍大,Lu等[20]認為這表明峰度模型較單指數模型得到了更適合的擬合。 通過ROC曲線分析得出3個參數間的AUC差異無統計學意義,這與之前的研究結論基本一致[21-22]。但Kapp在3次(樣本數分別為20、33、43)階段性結果分析中,始終穩定地保持最大的AUC,僅Kapp能夠鑒別GS=4+3和GS>7的前列腺癌病灶。一項大樣本量(n=121)的研究報告顯示[23],Kapp在鑒別高低級別GS腫瘤的敏感度顯著高于ADC和Dapp,分別為68.6%、51.0%和49.0% (P<0.004)。本研究中相應的敏感度為92.31%,Youden指數為0.66,提示將DKI納入前列腺MRI方案的潛在臨床優勢。另外本研究和部分既往研究都得出ADC值和Kapp值存在明顯的負相關[24-25],這可能表明,它們傳遞了相似的腫瘤微觀結構信息。有研究表明ADC聯合Kapp較單獨的ADC能更好地鑒別診斷GS分組[24]。 本研究存在幾點局限:(1)病例來源單一,病例數較少;(2)并未區分外周帶及中央區腺體癌灶影像診斷差異;(3)手動繪制ROI,盡管3D繪制提供了方便,但是人為或軟件系統誤差仍不能完全避免;(4)病理結果參照并非來自大體標本的逐層切片,因此影像上病灶的定位有可能存在一定偏差。 綜上所述,DWI單指數模型參數和峰度模型參數均有助于術前評估前列腺癌的Gleason分級,但差異無統計學意義;Kapp可能是腫瘤侵襲性的優秀預測因子,推薦將DKI應用于臨床。Kapp在預測腫瘤侵襲性方面的優勢有待多中心試驗進一步論證。 致謝本院放射科技術組GE750機器值班技術人員及技術組老師為磁振檢查提供了支持,本院泌尿外科朱延軍醫師提供了病源。
Fig 2 Typical case 1
Fig 3 Typical case 2

