不同成熟度樹葡萄葉片中類黃酮合成轉錄組基因分析
張少平, 鄭開斌, 洪佳敏, 林寶妹, 張帥, 邱珊蓮*
不同成熟度樹葡萄葉片中類黃酮合成轉錄組基因分析
張少平1,2, 鄭開斌1,2, 洪佳敏1, 林寶妹1, 張帥1, 邱珊蓮1*
(1. 福建省農業科學院亞熱帶農業研究所,福建 漳州 363005; 2. 福建省農業科學院作物研究所,福州 350013)
為了解樹葡萄()類黃酮合成相關酶差異表達基因信息,對其幼葉和成熟葉進行全轉錄組測序并比較分析。結果表明,從樹葡萄幼葉和成熟葉中獲得59 321條單基因簇(Unigenes),在8大數據庫共注釋到32 912條Unigenes信息,其中類黃酮合成代謝相關酶基因77個,在成熟葉片中顯著下調表達的基因6個,包括2個、1個、1個、1個2-羥基異黃酮脫水酶基因和1個。5個差異表達基因經qRT-PCR驗證的結果與轉錄組測序結果相符合。因此,樹葡萄葉片中含有大量不同種類黃酮合成代謝相關酶家族基因,成熟葉片中類黃酮含量顯著減少是由于少量相關基因顯著下調。
樹葡萄;葉片;類黃酮;轉錄組基因
樹葡萄()俗稱珍寶果、嘉寶果、擬愛神木等,為桃金娘科(Myrtaceae)擬愛神木屬常綠灌木或喬木,原產于巴西等南美地區[1]。我國對樹葡萄引種栽培較早的地區始于臺灣[2],近年來,隨著人們對樹葡萄的青睞,福建沿海等地也逐漸出現較大面積引種栽培[3]。樹葡萄一年可多次開花,但果實盛產期集中在春秋兩季,花果主要著生于樹干或粗壯的枝條上。樹葡萄不僅是集果實食用和觀賞為一體的名貴優良樹種[4],而且全株(包括根、莖、葉、花和果實)富含類黃酮等活性成分[5-6],具有抗氧化、抗炎、抗腫瘤及降低膽固醇和降血糖血脂等多種功效[7-9]。類黃酮是植物中多酚類次生代謝產物[10],主要成分包括查爾酮、黃烷酮、黃酮、異黃酮、二氫黃酮、黃酮醇及花青苷等[11-13]。
類黃酮合成代謝途徑涉及的酶主要包括查爾酮合成酶(chalcone synthase, CHS)、查爾酮異構酶(chalcone isomerase, CHI)、黃烷酮3-羥化酶(flavanone 3-hydroxylase, F3H)(或黃酮醇合成酶 flavonol synthase, FLS)、類黃酮3?-羥化酶(flavonoid 3-hydroxylase, F3?H)(或類黃酮3-單加氧酶flavonoid 3-monooxygenase)、類黃酮3?,5?-羥化酶(flavonoid 3,5-hydroxylase, F3?,5?H)、二氫黃酮醇4-還原酶(dihydroflavonol/flavone 4-reductase, DFR)、黃酮合成酶(flavone synthase,FSI和FSII)、異黃酮還原酶(isoflavone reductase, IFR)、異黃酮合成酶(isoflavone synthase, IFS)(或異黃酮羥化酶isoflavone hydro- xylase)、花青素合成酶(anthocyanidin synthase, ANS)(或無色花色素雙加氧酶leucoanthocyanidindioxygenase, LDOX)、花青素3--糖基轉移酶(anthocyanidin 3--glucosyltransferase, 3GT)(或類黃酮3--糖基轉移酶flavonoid 3--glucosyltrans-ferase; 或UDP-葡萄糖UDP-glucose)、無色花色素還原酶(leucoanthocyanidin reductase, LAR)、花青素還原酶(anthocyanidin reductase, ANR)等[14-16]。近年來,有關樹葡萄的研究大多集中在栽培管理、營養成分、藥理功效及產品加工等方面[17-19],而對樹葡萄類黃酮代謝合成相關基因的研究還未見報道。樹葡萄葉片富含類黃酮,尤以嫩葉含量最高[20-21],因此,本研究將以樹葡萄栽培種沙巴幼葉為對象,以成熟葉為對照,利用高通量測序技術進行轉錄組基因測序,通過不同數據庫注釋后再進行類黃酮合成代謝中所涉及關鍵酶基因檢索,以期獲得葉片中類黃酮合成代謝相關基因的種類、表達量及差異表達信息,為深入研究樹葡萄或其他特色植物中類黃酮合成代謝奠定了基礎。
1 材料和方法
1.1 材料
從福建省農業科學院亞熱帶農業研究所天然產物源種質資源圃中,取15 a生樹葡萄栽培種沙巴(‘Shaba’)的嫩葉和成熟葉,嫩葉為春季新長出20 d內的葉片,紅色;成熟葉為30~60 d的葉片,嫩綠色。兩種葉片分別標號后送北京百邁克生物科技有限公司進行RNA提取、轉錄組測序、測序數據組裝和差異表達基因的qRT- PCR驗證等。
1.2 RNA提取和高通量測序
采用Trizol法分別提取樹葡萄嫩葉和成熟葉的總RNA,各3份共6個樣本,每個樣本檢測合格后取等量混勻組成1個RNA池,再分別進行帶有Oligo(dT)磁珠富集葉片mRNA并進行隨機打斷、反轉錄成雙鏈cDNA再進行純化和末端修復、加A尾后連接測序接頭、PCR富集制備測序文庫及測序等。
應用Illumina HiSeq測序平臺,構建樹葡萄葉片轉錄組文庫后,測序并獲取相關數據。所得原始數據通過過濾去除接頭序列及低質量讀序以獲取高質量的干凈讀序。將干凈讀序進行序列組裝,最后獲得樹葡萄栽培種沙巴葉片的單基因簇(Unigenes)庫。
1.3 功能注釋及關鍵基因檢索
轉錄組測序獲取樹葡萄葉片相關數據后,分別進行隨機性檢驗和飽和度檢驗等測序文庫質量評估,合格后的數據進行表達量分析。使用BLAST軟件[22]對樹葡萄葉片所有Unigenes在不同數據庫進行功能注釋,這些數據庫有蛋白質直系同源數據庫(cluster of orthologous groups, COG)、東京基因與基金組百科全書(Kyoto encyclopedia of genes and genomes, KEGG)、基因本體論數據庫(gene ontology, GO)、蛋白質真核同源數據庫(euKaryotic orthologous groups, KOG)、蛋白質序列數據庫(swiss-prot protein database, Swiss-Prot)、蛋白質家族域數據庫(protein families database, Pfam)、直系同源蛋白的功能描述和功能分類(evolutionary genealogy of genes: Non- supervised orthologous groups, eggNOG)和非冗余蛋白數據庫(non-redundant protein database, NR)。經數據庫注釋后,進一步在Swiss-Prot和NR數據庫進行類黃酮合成相關基因檢索分析,以期獲得樹葡萄幼葉和成熟葉片中類黃酮合成基因種類和表達量。
1.4 差異表達基因的qRT-PCR分析驗證
通過qRT-PCR檢測2個樹葡萄樣本在轉錄組測序中差異表達的5個類黃酮合成相關基因(表1)的表達。首先,樹葡萄幼葉和成熟葉各取1g RNA,使用TransScript II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal) (貨號:AH341)試劑盒,根據試劑盒說明書的方法進行反轉錄成cDNA。然后應用SYBRGreen染料進行qRT-PCR檢測分析,均設置3次重復。
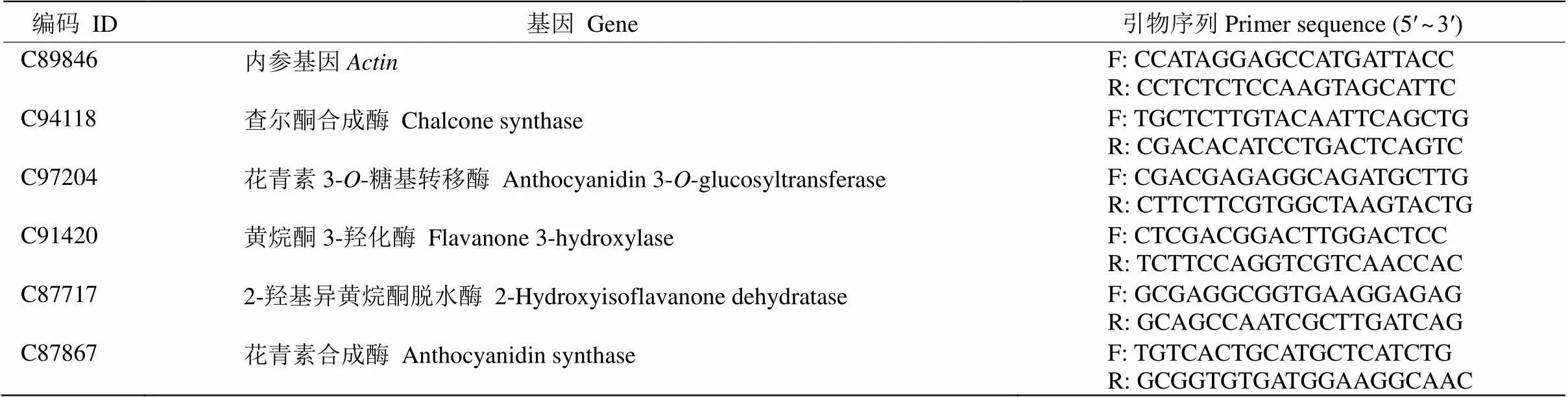
表1 qRT-PCR分析的5個基因和引物
2 結果和分析
2.1 測序分析
通過對樹葡萄幼葉和成熟葉轉錄組進行測序和合并組裝,共獲得16.53 Gb的clean data,各樣品的clean data均達到7.30 Gb,Q30堿基≥92.83%。組裝后共獲得59 321條Unigenes,其中長度在1 kb以上的有17 623條。所有Unigenes通過COG、KEGG、GO、KOG、Swiss-Prot、Pfam和NR等數據庫進行注釋比對,共有32 912條注釋, 其中長度在300 bp~ 1 kb的Unigenes為17 592條,而長度大于1 kb的有15 320條(表2)。
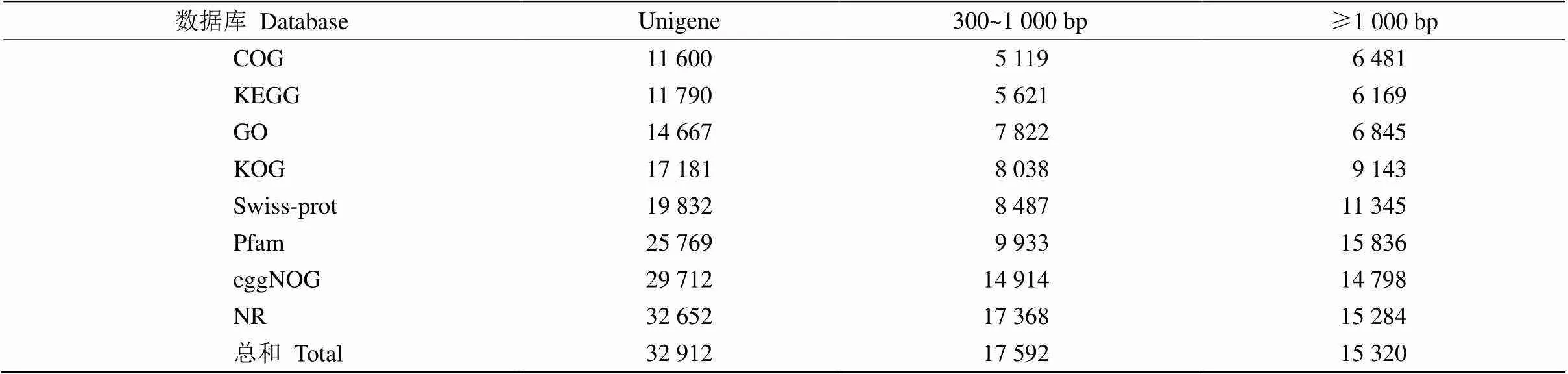
表2 數據庫注釋的Unigenes數量
2.2 類黃酮相關基因分析
2.2.1 查爾酮合成酶相關基因
所有32 912條Unigenes通過chalcone (查爾酮)關鍵詞檢索,依據NR和Swiss-Prot數據庫分析, 共獲得9個查爾酮合成酶相關基因(表3),包括3個和6個基因。差異表達極顯著下調的基因有3個,包括2個(編碼c93272和c86311)和1個基因(編碼c94118),這3個查爾酮相關核心基因在樹葡萄幼葉中的FPKM值明顯高于成熟葉片;同時,上述9條Unigenes在NR數據庫匹配的物種主要有巨桉(, 6條),而在Swiss-Prot數據庫匹配的物種有擬南芥(, 2條)和茶樹(, 2條)等7種植物。
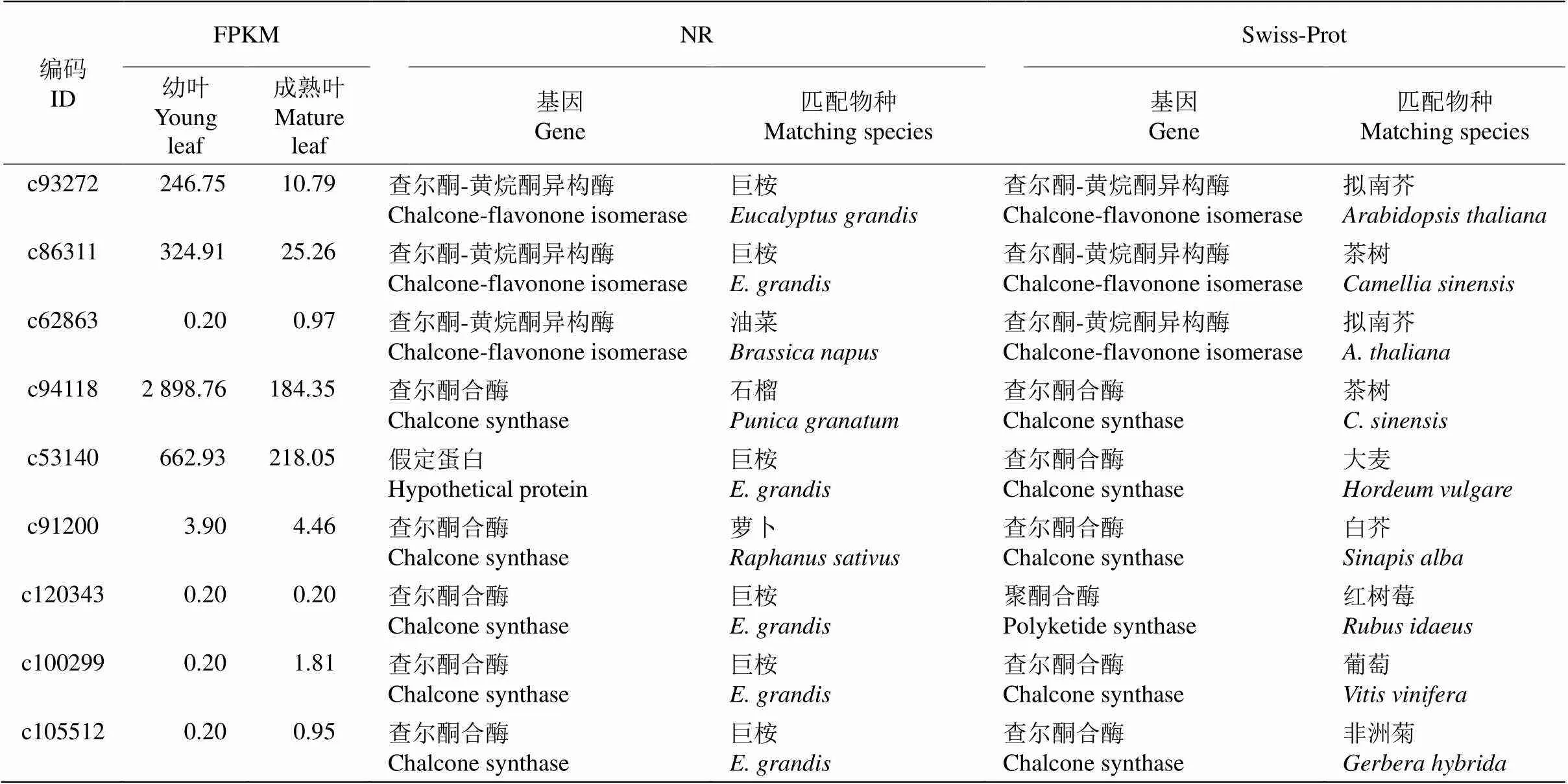
表3 9個查爾酮合成酶相關基因
2.2.2 類黃酮相關基因
通過flavonoid(類黃酮)關鍵詞檢索,依據NR及Swiss-Prot數據庫分析,共獲得6個類黃酮相關基因(表4),包括3個和3個,基因, 這些基因在樹葡萄幼葉和成熟葉中的表達差異不顯著,因此,該兩類家族基因在樹葡萄葉片中無差異表達。6條Unigenes在NR數據庫匹配的物種均是巨桉,而在Swiss-Prot數據庫匹配的物種有矮牽牛(, 5條)和茄子(, 1條)。
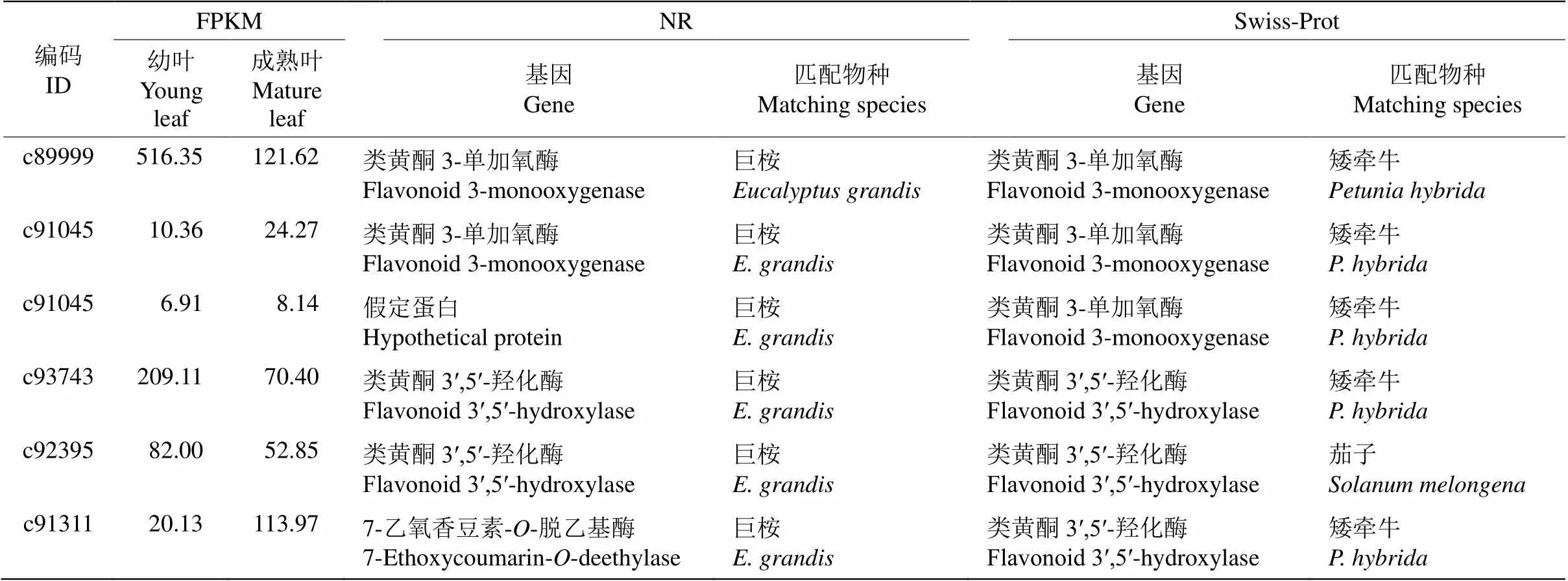
表4 6個類黃酮相關基因
2.2.3 黃酮相關基因
通過flavone (黃酮)關鍵詞檢索,依據NR及Swiss-Prot數據庫分析,共獲得10個黃酮相關基因(表5),包括5個、4個和1個黃酮3--酰基轉移酶基因。這些基因在樹葡萄幼葉和成熟葉的差異表達不顯著,但這些黃酮相關基因在幼葉的FPKM值普遍低于成熟葉。這10條Unigenes在NR數據庫匹配的物種主要為巨桉(7條);而在Swiss- Prot數據庫中,3個基因匹配油橄欖(),基因分別匹配甘草(, 2)和苜蓿(, 2)。
2.2.4 黃烷酮相關基因
通過flavanone (黃烷酮)關鍵詞檢索,依據NR和Swiss-Prot數據庫注釋分析,共獲得11個黃烷酮相關基因(表6),包括4個、6個2-羥基異黃烷酮脫水酶和1個黃烷酮鼠李糖轉移酶基因。這些基因在樹葡萄幼葉和成熟葉片的差異表達極顯著下調的有2個,分別為(編碼c91420)和2-羥基異黃烷酮脫水酶基因(編碼c87717),其他基因差異表達不顯著。這11條Unigenes在NR數據庫匹配的物種主要為巨桉(9條),而在Swiss-Prot數據庫匹配的物種有大豆(, 2條)、擬南芥(2條)和甘草(2條)等8種植物。
2.2.5 黃酮醇相關基因
通過flavonol (黃酮醇)關鍵詞檢索,依據NR及Swiss-Prot數據庫注釋分析,共獲得9個基因信息(表7)。這些基因在樹葡萄幼葉和成熟葉片的差異表達均不明顯,除編碼c82886的基因外,其他基因在幼葉的FPKM普遍低于成熟葉。同時,這9條Unigenes在NR數據庫匹配的物種較多,有菌類、草本和木本植物等7種,而在Swiss-Prot數據庫匹配的物種有擬南芥(4條)和水稻(, 2條)等4種植物。
2.2.6 花青素相關基因
通過anthocyanidin (花青素)和相關基因等關鍵詞檢索,依據NR及Swiss-Prot數據庫注釋分析, 共獲得32個花青素相關基因信息(表8),包括18個花青素相關糖基轉移酶、4個花青素相關酰基轉移酶、5個和4個基因。其中花青素相關糖基轉移酶基因包括13個和5個花青素5,3--糖基轉移酶基因;花青素相關酰基轉移酶包括3個花青素3--糖基6--酰基轉移酶和1個花青素酰基轉移酶基因。這些花青素相關基因在樹葡萄幼葉和成熟葉片的差異表達極顯著下調的只有編碼c87867的基因。27個Unigenes在NR數據庫匹配的物種為巨桉(只有4個和1個匹配為其他物種);而在Swiss-Prot數據庫中,花青素相關糖基轉移酶基因匹配的物種有木薯()、草莓()和擬南芥等7種植物,4個花青素相關酰基轉移酶基因匹配的物種均為擬南芥, 5個匹配的物種均為葡萄(),5個匹配的物種有擬南芥(3)和銀葉山螞蝗(, 2)。
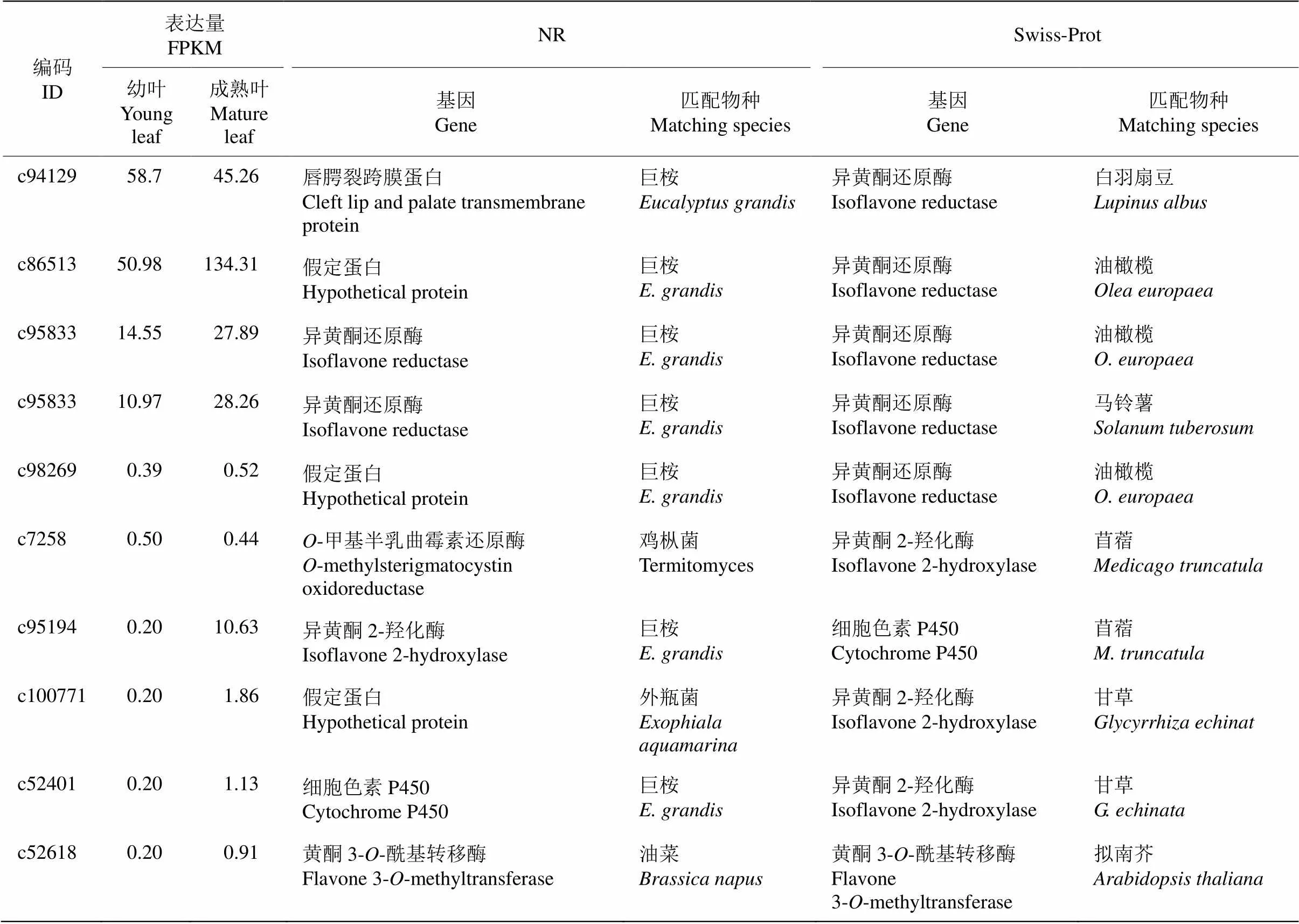
表5 10個黃酮相關基因
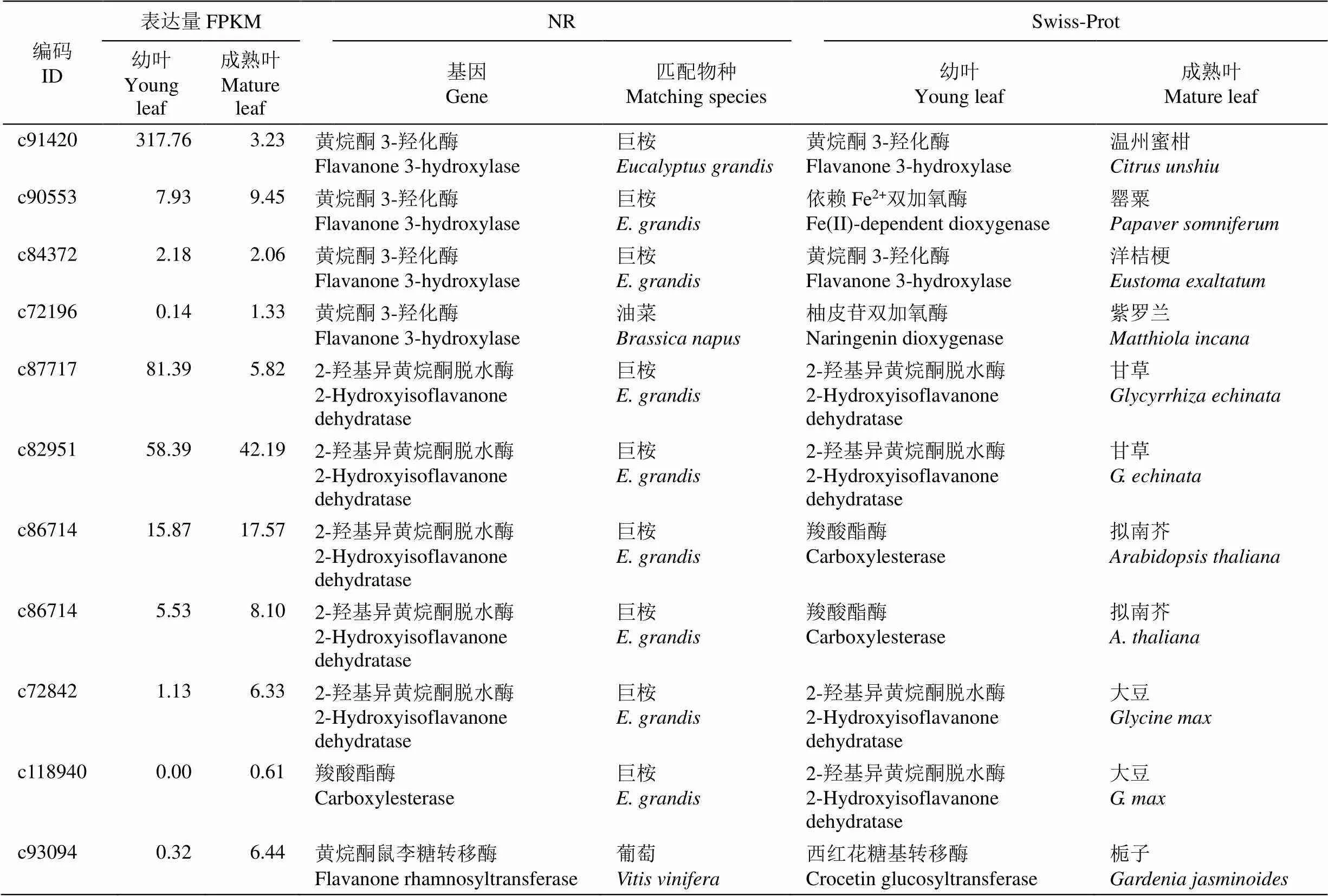
表6 11個黃烷酮相關基因
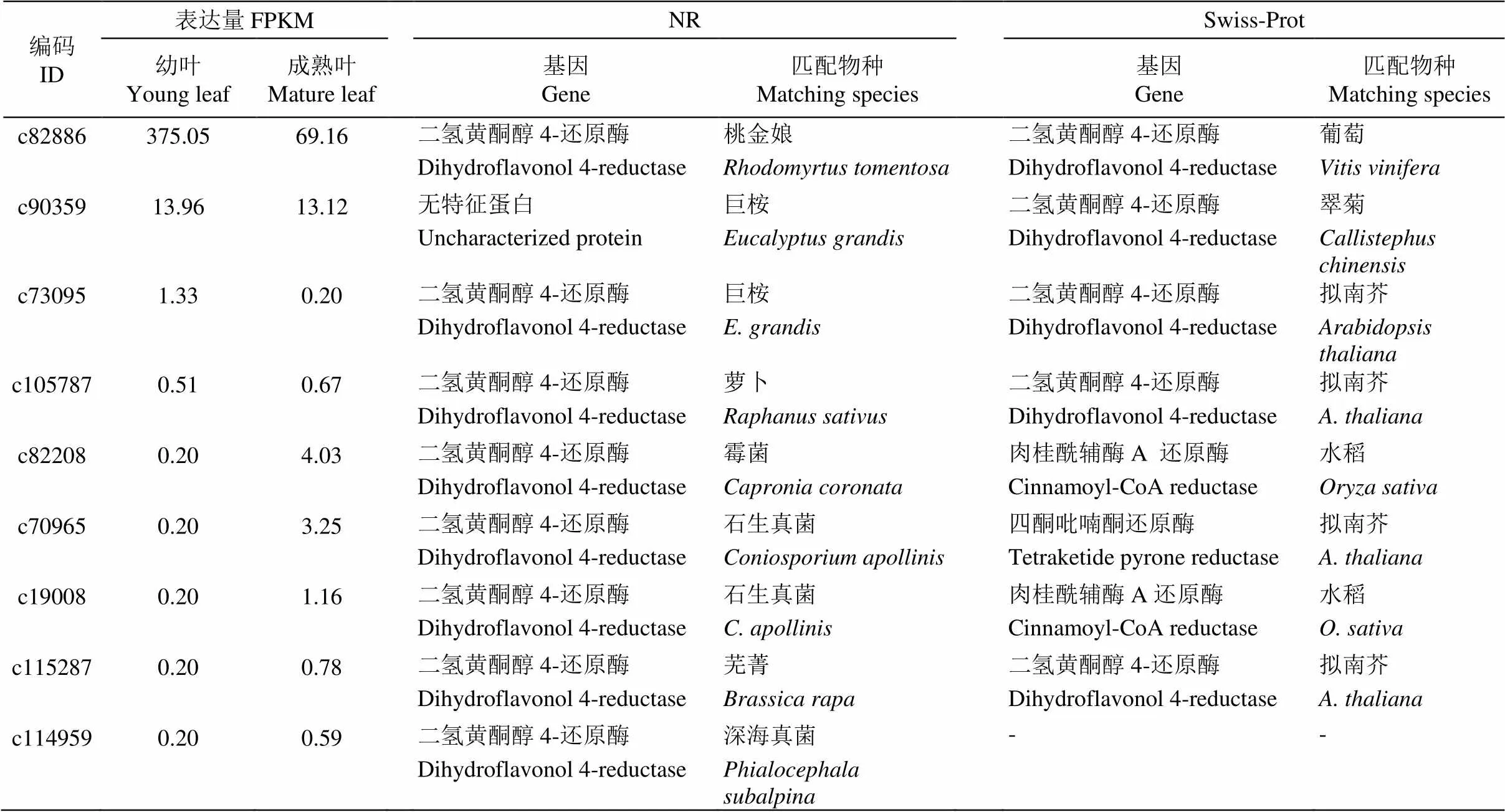
表7 9個黃酮醇相關基因
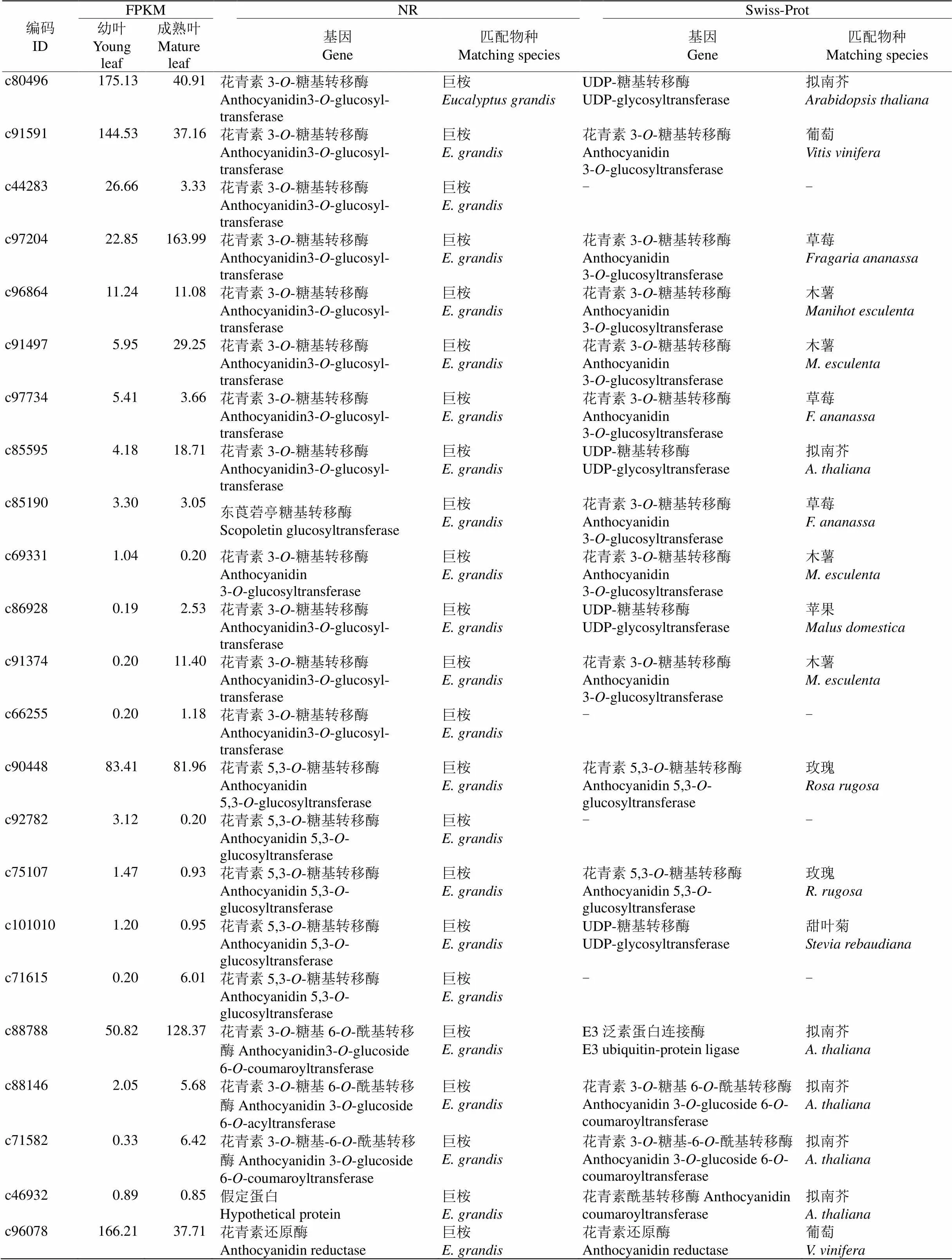
表8 32個花青素合成酶相關基因
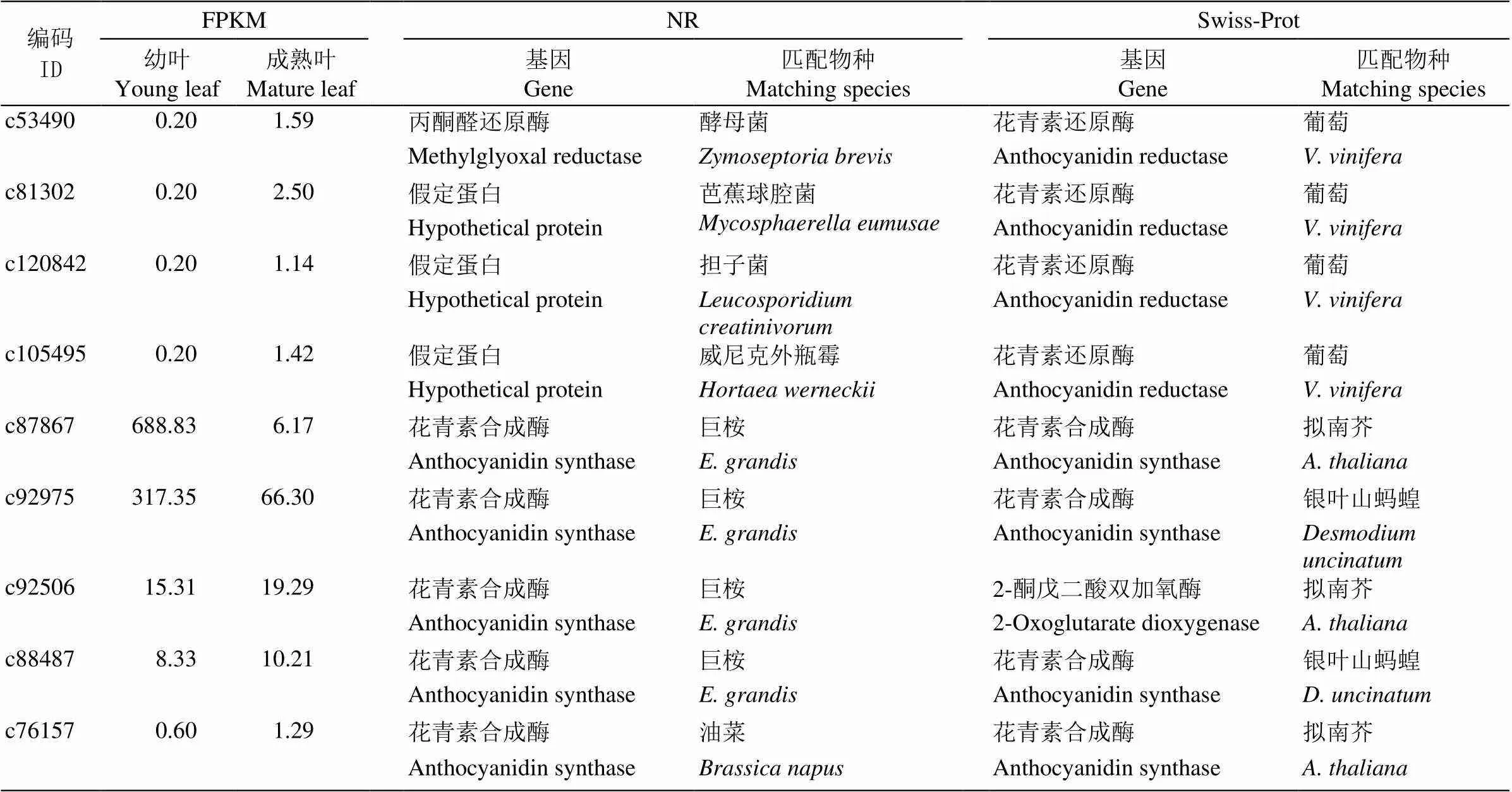
續表(Continued)
2.3 差異表達基因的qRT-PCR驗證
選擇差異表達顯著的5個類黃酮合成酶相關基因進行qRT-PCR分析,這5個基因包括上調基因花青素3--糖基轉移酶(編碼C97204)以及4個下調基因,如查爾酮合成酶(編碼C94118)、黃烷酮3-羥化酶(編碼C91420)、2-羥基異黃酮脫水酶(編碼C87717)和花青素合成酶基因(編碼C87867)。結果表明(表9),上述基因在樹葡萄幼葉及成熟葉片中的表達模式(上調或下調)與轉錄組測序結果完全吻合, 只是這兩種檢測結果的差異表達倍數略有不同。
3 結論和討論
通過高通量測序分析, 從樹葡萄幼葉和成熟葉片中共獲得59 321條Unigenes,在8大數據庫中共有32 912條Unigenes獲得功能注釋,NR數據庫注釋了32 652條Unigenes,幾乎覆蓋了所有其他數據庫,我們選擇NR數據庫對樹葡萄葉片類黃酮合成相關酶基因進行分析。由于NR數據庫整合標準比較寬松,冗余度較高[23],而Swiss-Prot數據庫中的蛋白質功能經過試驗驗證,注釋的準確度高[23],因此,本文選擇NR和Swiss-Prot數據庫進行共同注釋分析。這2個數據庫注釋到樹葡萄中77個類黃酮合成酶相關基因信息,包括查爾酮、類黃酮、黃酮、黃烷酮、黃酮醇及花青素等6大類共有19種,其中查爾酮相關基因包括和;類黃酮相關基因包括和;黃酮相關基因包括、和黃酮3--酰基轉移酶;黃烷酮相關基因包括、2-羥基異黃烷酮脫水酶和黃烷酮鼠李糖轉移酶;黃酮醇相關基因為;花青素相關基因包括花青素相關糖基轉移酶、花青素相關酰基轉移酶、和。NR和Swiss-Prot數據庫注釋的類黃酮合成酶相關基因均為60個,NR數據庫中有17條Unigenes沒明確為類黃酮相關基因;Swiss-Prot數據庫中有5條Unigenes未注釋到信息,另有12條沒明確為類黃酮相關基因。
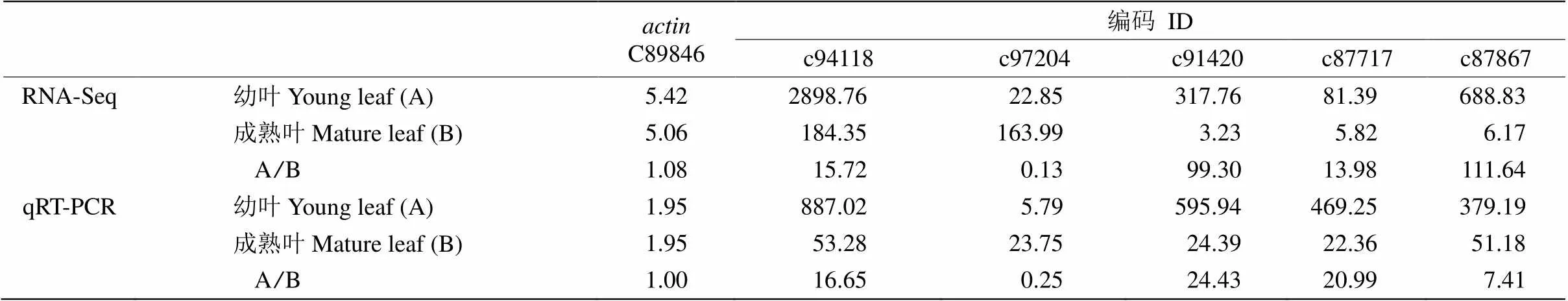
表9 差異表達基因的qRT-PCR分析
在NR數據庫注釋的類黃酮合成酶相關基因中,除、黃酮3--酰基轉移酶、黃烷酮鼠李糖轉移酶和等基因外,其他類黃酮合成酶相關基因匹配的物種大多為巨桉,尤其是、、、2-羥基異黃烷酮脫水酶、花青素相關糖基轉移酶和花青素相關酰基轉移酶等家族基因所匹配的物種全是巨桉。因此,巨桉與樹葡萄的大多數類黃酮合成酶相關基因親緣關系較近。在Swiss-Prot數據庫中,類黃酮合成酶相關基因匹配的物種較多,但家族成員匹配的均是矮牽牛,而家族成員匹配的均是葡萄,這表明矮牽牛的家族基因和葡萄的家族基因都進行了較為系統的研究。
通過比較樹葡萄幼葉和成熟葉中類黃酮合成酶相關基因的FPKM值可知,在77個類黃酮合成代謝相關酶基因中,差異表達極顯著的基因有6個,且在成熟葉中均顯著下調,因此,樹葡萄嫩葉中類黃酮含量顯著高于成熟葉是因為嫩葉中存在高表達量的2個、1個、1個、1個2-羥基異黃酮脫水酶基因和1個。然而,類黃酮是植物重要的次生代謝產物之一[24-25],其含量除受合成代謝相關酶基因影響外[26-27],還與其轉錄因子調控密切相關[28]。目前,已報道關于類黃酮合成代謝的轉錄因子主要有MYB、bHLH和WD40等[29]。因此,本研究根據轉錄組測序數據,進一步分析了樹葡萄葉中的上述轉錄因子,結果在獲取的283個MYB、88個bHLH和246個WD40等三類家族基因轉錄因子中,差異表達極顯著的分別有19、6和6個。與樹葡萄葉片類黃酮合成代謝差異顯著的合成酶皆為正向調控不同,這些差異表達極顯著的三類轉錄因子中存在5個MYB、1個bHLH和1個WD40共7個負向調控因子,他們具體作用于哪個或哪些類黃酮合成酶還有待深入研究。
本研究從樹葡萄類黃酮合成代謝相關酶中選取5個差異表達基因進行qRT-PCR驗證,結果與轉錄組測序相符合。因此,本研究從樹葡萄中獲取的大量類黃酮合成相關不同家族基因及其在不同成熟度葉片中的差異表達情況,結合其他高等植物中存在大量家族基因[30],說明樹葡萄在進化過程中經過不斷復制以及串聯復制等,獲得了多拷貝不同家族的類黃酮合成相關基因,而這些多拷貝家族成員中起促進或抑制相關基因的表達可能集中在該家族基因中的少數基因上,大多數基因可能與樹葡萄葉片類黃酮合成沒有直接關系,而是否存在其他間接聯系還有待進一步深入研究。本研究進行樹葡萄不同成熟度葉片轉錄組測序,所獲取的6個差異表達極顯著下調基因,為進一步深入研究樹葡萄或其他特色植物中類黃酮合成代謝奠定了基礎。
[1] NERI-NUMA I A, SORIANO S R A, PEREIRA A P A, et al. Small Brazilian wild fruits: nutrients, bioactive compounds, health-promotion properties and commercial interest [J]. Food Res Int, 2018, 103: 345- 360. doi: 10.1016/j.foodres.2017.10.053.
[2] LIU Y J, FU J X, LIN Q H, et al. The introdution performance and cultivation techniques of jaboticaba “Sabara” [J]. S China Fruits, 2011, 40(4): 97-99. doi: 10.13938/j.issn.1007-1431.2011.04.022. 劉友接, 傅加興, 林旗華, 等. “莎芭拉”嘉寶果引種表現及栽培技術要點 [J]. 中國南方果樹, 2011, 40(4): 97-99. doi: 10.13938/j.issn. 1007-1431.2011.04.022.
[3] LIN B M, ZHENG K B, ZHANG S, et al. Studies on antioxidant and-glucosidase inhibitory activities of ethanol extracts from peels and seeds of jaboticaba at different maturities [J]. J Trop Subtrop Bot, 2018, 26(3): 233-240. doi: 10.11926/jtsb.3831.林寶妹, 鄭開斌, 張帥, 等. 不同成熟度樹葡萄果實醇提取物抗氧化和抑制-葡萄糖苷酶活性研究 [J]. 熱帶亞熱帶植物學報, 2018, 26 (3): 233-240. doi: 10.11926/jtsb.3831.
[4] TANG L, YUAN T T, ZHONG Q P. Analysis of nutritional components in[J]. Nonwood For Res, 2014, 32(2): 120-124. doi: 10.14067/j.cnki.1003-8981.2014.02.019.唐麗, 袁婷婷, 鐘秋平. 嘉寶果營養成分分析 [J]. 經濟林研究, 2014, 32(2): 120-124. doi: 10.14067/j.cnki.1003-8981.2014.02.019.
[5] QIU S L, LIN B M, HONG J M, et al. Comparative study of the anti- oxidant activity and the-glucosidase inhibitory activity of the ethanol extracts from different parts of jaboticaba plant [J]. J Fruit Sci, 2018, 35(3): 311-318. doi: 10.13925/j.cnki.gsxb.20170316.邱珊蓮, 林寶妹, 洪佳敏, 等. 樹葡萄植株不同部位醇提物抗氧化及抑制-葡萄糖苷酶活性的比較研究 [J]. 果樹學報, 2018, 35(3) 311-318. doi: 10.13925/j.cnki.gsxb.20170316.
[6] MORALES P, BARROS L, DIAS M I, et al. Non-fermented and fermented jabuticaba (Mart.) pomaces as valuable sources of functional ingredients [J]. Food Chem, 2016, 208: 220-227. doi: 10.1016/j.foodchem.2016.04.011.
[7] PEREIRA L D, BARBOSA J M G, RIBEIRO da S A J, et al.Polyphenol and ellagitannin constituents of jabuticaba() and chemical variability at different stages of fruit development [J]. J Agric Food Chem, 2017, 65(6): 1209-1219. doi: 10.1021/acs.jafc.6b02929.
[8] SILVA R M, PEREIRA L D, VéRAS J H, et al. Protective effect and induction of DNA repair byseed extract and pedunculagin on cyclophosphamide-induced genotoxicity [J]. Mutat Res, 2016, 810: 40-47. doi: 10.1016/j.mrgentox.2016.10.001.
[9] HACKE A C M, GRANATO D, MACIEL L G, et al. Jabuticaba () seeds: Chemical characterization and extraction of antioxidant and antimicrobial compounds [J]. J Food Sci, 2016, 81 (9): C2206-C2217. doi: 10.1111/1750-3841.13405.
[10] NIE J Y, Lü D G, LI J, et al. A preliminary study on the flavonoids in fruits of 22 apple germplasm resources [J]. Sci Agric Sin, 2010, 43(21): 4455-4462. doi: 10.3864/j.issn.0578-1752.2010.21.015.聶繼云, 呂德國, 李靜, 等. 22種蘋果種質資源果實類黃酮分析 [J]. 中國農業科學, 2010, 43(21): 4455-4462. doi: 10.3864/j.issn.0578- 1752.2010.21.015.
[11] CHEN J J, PENG Z X, SHI M Y, et al. Advances in on flavonoid composition and metabolism in citrus [J]. Acta Hort Sin, 2016, 43(2): 384-400. doi: 10.16420/j.issn.0513-353x.2015-0689.陳嘉景, 彭昭欣, 石梅艷, 等. 柑橘中類黃酮的組成與代謝研究進展 [J]. 園藝學報, 2016, 43(2): 384-400. doi: 10.16420/j.issn.0513- 353x.2015-0689.
[12] ZHANG K, LEI J, HE Y, et al. A flavonoids compound inhibits osteoclast differentiation by attenuating RANKL induced NFATc-1/ c-Fos induction [J]. Int Immunopharmacol, 2018, 61: 150-155. doi: 10.1016/j.intimp.2018.05.030.
[13] XU H F, WANG N, JIANG S H, et al. Content and analysis of biosynthesis-related genes of flavonoid among four strains off.F1population [J]. Sci Agric Sin, 2016, 49 (16): 3174-3187. doi: 10.3864/j.issn.0578-1752.2016.16.011.許海峰, 王楠, 姜生輝, 等. 新疆紅肉蘋果雜種一代4個株系類黃酮含量及其合成相關基因表達分析 [J]. 中國農業科學, 2016, 49 (16): 3174-3187. doi: 10.3864/j.issn.0578-1752.2016.16.011.
[14] Lu Q, Peng Y, Zhu C H, et al. Effect of thermal treatment on carotenoids, flavonoids and ascorbic acid in juice of orange cv. Cara [J]. Food Chem, 2018, 265: 39-48. doi: 10.1016/j.foodchem.2018.05.072.
[15] YIN L, GUAN E S, ZHANG Y B, et al. Chemical profile and anti- inflammatory activity of total flavonoids fromFisch [J]. Iran J Pharm Res, 2018, 17(2): 726-734. doi: 10.22037/IJPR. 2018.2197.
[16] SEMAAN D G, IGOLI J O, YOUNG L, et al. Dataset on the kinetics of the inhibition of PTP1B by the flavonoids and pheophytin A from[J]. Data Brief, 2018, 17: 401-406. doi: 10.1016/ j.dib.2018.01.057.
[17] BALDIN J C, MUNEKATA P E S, MICHELIN E C, et al. Effect of microencapsulated jabuticaba () extract on quality and storage stability of mortadella sausage [J]. Food Res Int, 2018, 108: 551-557. doi: 10.1016/j.foodres.2018.03.076.
[18] HSU J D, WU C C, HUNG C N, et al.extract improves diabetic nephropathy via suppression of oxidative stress and inflammation in streptozotocin-nicotinamide mice [J]. J Food Drug Anal, 2016, 24(4): 730-737. doi: 10.1016/j.jfda.2016.03.009.
[19] SERAGLIO S K T, SCHULZ M, NEHRING P, et al. Nutritional and bioactive potential of myrtaceae fruits during ripening [J]. Food Chem, 2018, 239: 649-656. doi: 10.1016/j.foodchem.2017.06.118.
[20] QIU S L, LIN B M, ZHENG K B, et al. Antioxidative activity and- glucosidase inhibitory activity of ethanol extracts of leaves of different cultivars of jaboticaba [J]. J Fruit Sci, 2017, 34(11): 1450-1457. doi: 10.13925/j.cnki.gsxb.20170141.邱珊蓮, 林寶妹, 鄭開斌, 等. 不同品種樹葡萄葉片醇提物抗氧化及抑制-葡萄糖苷酶活性研究 [J]. 果樹學報, 2017, 34(11): 1450- 1457. doi: 10.13925/j.cnki.gsxb.20170141.
[21] LIN B M, QIU S L, ZHANG S P, et al. Antioxidant capacities of different leaf extracts of Jaboticaba cultivars [J]. J NW Agric For Univ (Nat Sci), 2018, 46(9): 121-130. doi: 10.13207/j.cnki.jnwafu.2018. 09.016.林寶妹, 邱珊蓮, 張少平, 等. 不同品種嘉寶果葉片提取物的抗氧化活性 [J]. 西北農林科技大學學報(自然科學版), 2018, 46(9): 121- 130. doi: 10.13207/j.cnki.jnwafu.2018.09.016.
[22] ALTSCHUL S F, MADDEN T L, SCH?FFER A A, et al. Gapped BLAST and PSI-BLAST: A new generation of protein database search programs [J]. Nucl Acids Res, 1997, 25(17): 3389-3402. doi: 10.1093/ nar/25.17.3389.
[23] ZHANG S P, HONG J J, QIU S L, et al. Sequencing and analysis of the transcriptome of[J]. Acta Hort Sin, 2016, 43(5): 935- 946. doi: 10.16420/j.issn.0513-353x.2016-0140.張少平, 洪建基, 邱珊蓮, 等. 紫背天葵高通量轉錄組測序分析 [J].園藝學報, 2016, 43(5): 935-946. doi: 10.16420/j.issn.0513-353x.2016- 0140.
[24] YAO Y F, ZHANG S P, LIAN D M, et al. Transcriptome sequencing and differential expression analysis of flavonoid metabolism in flowers and fruits of okra [J]. Acta Bot Boreali-Occid Sin, 2018, 38(11): 2000- 2009. doi: 10.7606/j.issn.1000-4025.2018.11.2000.姚運法, 張少平, 練冬梅, 等. 黃秋葵花和果莢轉錄組測序及類黃酮代謝差異表達分析 [J]. 西北植物學報, 2018, 38(11): 2000-2009. doi: 10.7606/j.issn.1000-4025.2018.11.2000.
[25] WANG S W, FANG Y J, YU X F, et al. The flavonoid-rich fraction from rhizomes ofRoxb. ameliorates renal oxidative stress and inflammation in uric acid nephropathy rats through promoting uric acid excretion[J]. Biomed Pharmac, 2019, 111: 162-168. doi: 10. 1016/j.biopha.2018.12.050.
[26] PETRUSSA E, BRAIDOT E, ZANCANI M, et al. Plant flavonoids: Biosynthesis, transport and involvement in stress responses[J]. Int J Mol Sci, 2013, 14(7): 14950-14973. doi:10.3390/ijms140714950.
[27] DESHMUKH A B, DATIR S S, BHONDE Y, et al.root transcriptome of a medicinally important rare treefor characterization of the flavonoid biosynthesis pathway [J]. Phyto- chemistry, 2018, 156: 201-213. doi: 10.1016/j.phytochem.2018.09.013.
[28] MIERZIAK J, KOSTYN K, KULMA A. Flavonoids as important molecules of plant interactions with the environment [J]. Molecules, 2014, 19(10): 16240-16265. doi:10.3390/molecules191016240.
[29] LLOYD A, BROCKMAN A, AGUIRRE L, et al. Advances in the MYB- bHLH-WD repeat (MBW) pigment regulatory model: Addition of a WRKY factor and co-option of an anthocyanin MYB for betalain regulation [J]. Plant Cell Physiol, 2017, 58(9): 1431-1441. doi: 10.1093/ pcp/pcx075.
[30] ZHANG S P, ZHANG S H, QIU S L, et al. Thetrans- criptome as a source for anthocyanidin gene sequence analysis [J]. J Nucl Agric Sci, 2018, 32(4): 639-645. doi: 10.11869/j.issn.100-8551. 2018.04.0639.張少平, 張少華, 邱珊蓮, 等. 基于轉錄組測序的紫背天葵花青素相關基因分析 [J]. 核農學報, 2018, 32(4): 639-645. doi: 10.11869/j. issn.100-8551.2018.04.0639.
Transcriptome Analysis of Flavonoid Synthesis Related Genes in Different Maturity Leaves of
ZHANG Shao-ping1,2, ZHENG Kai-bin1,2, HONG Jia-min1, LIN Bao-mei1, ZHANG Shuai1, QIU Shan-lian1*
(1. Subtropical Agriculture Research Institute, Fujian Academy of Agricultural Sciences,Zhangzhou 363005, Fujian, China; 2. Crop Sciences Institute, Fujian Academy of Agricultural Sciences,Fuzhou 350013, China)
The flavonoid content in immature leaves was significantly higher than that in mature leaves of. In order to understand the information of differentially expressed genes related flavonoid synthesis in, the transcriptome of 2 kinds of leaves were sequenced by Illumina HiSeq method. The results showed that there were 59 321 Unigenes obtained from young and mature leaves, among which 32 912 unigenes were annotated by 8 databases. There were 77 Unigenes related flavonoid anabolism, and 6 genes were down-regulated significantly in mature leaves, including two, one, one, one 2-hydroxyiso- flavanone dehydratase gene and one. The RT-PCR verified results of five differentially expressed genes were agreed with the transcriptome sequencing. So, it was suggested that there were a large number of family genes related flavonoid anabolism in the leaves of, but the decrease of flavonoid content in mature leaves was due to several down-regulated genes.
; Leaf;Flavonoid; Transcriptomegene
10.11926/jtsb.4040
2019-01-16
2019-03-16
福建省農業科學院創新團隊項目(STIT2017-2-11); 福建省農業科學院青年創新團隊項目(STIT2017-3-14); 福建省公益類科研院所專項(2017R1024-1)資助
This work was supported by the Project for Innovation Team of Fujian Academy of Agricultural Sciences (FAAS) (Grant No. STIT2017-2-11), the Project for Youth Innovation Team of FAAS (Grant No. STIT2017-3-14), and the special Project for Public Welfare Research Institutes in Fujian (Grant No.2017R1024-1)
張少平(1975~ ),男,碩士,高級農藝師,主要從事特色植物功能成分相關研究。E-mail: zspnc@163.com
Corresponding author. E-mail: slqiu79@163.com

