選擇性上調pSmad 3C/3L基因對人肝星狀細胞增殖及α平滑肌肌動蛋白、纖維酶原激活物抑制劑-1和Ⅰ型膠原蛋白表達的影響
徐媛媛,聞廣華,張沖,楊雁
近年來,肝纖維化和肝癌已經逐漸成為一種常見的且危害性極大的疾病。國內外流行病學的相關研究報告均顯示,我國目前是肝癌病人數量最多的國家之一,2012年全球肝癌就新增78.25萬例,其中745 500例死亡,僅中國就占全球肝癌病例和死亡總數的50%左右,且肝癌的高發率和高病死率令廣大醫學研究者擔憂[1-2]。鑒于肝癌的難治愈性,針對早期肝纖維化的逆轉成為廣大學者的研究重點[3-5]。已有文獻報道,轉化生長因子-β1(TGF-β1)是肝纖維化肝癌發生發展的主要調控因子[6],Smad3是TGF-β1在細胞內信號轉導的關鍵信號分子[7-8]。TGF-β1自肝星狀細胞分泌后,可進一步地與細胞膜上的特異性受體產生穩定結合,這種穩定結合的結果是促使Smad3蛋白在胞內的活化,活化后的Smad3蛋白可隨即與胞內的Smad4蛋白進一步結合形成易于轉導入細胞核內的蛋白分子共聚體,最終實現靶基因的激活、轉錄與表達[9]。臨床病例研究表明,在慢性乙型肝炎到肝纖維化、肝癌的發展過程中,肝臟中pSmad3L逐漸升高,而pSmad3C逐漸降低。且在成功的抗肝炎病毒治療后,肝細胞pSmad3C水平恢復正常,同時pSmad3L水平呈現降低趨勢[10]。大量研究均表明Smad3不同位點磷酸化在肝纖維化肝癌的進展中發揮重要作用[11],然而具體作用機制仍未闡明。
本研究于2017年3月至2018年5月采用脂質體轉染的技術向人肝星狀細胞(LX-2)轉染野生型Smad3基因(Smad3 WT)、Smad3連接區磷酸化位點突變的基因(Smad3 EPSM)及Smad3 C末端磷酸化位點突變的基因(Smad3 3S-A)3種質粒,實現選擇性上調LX-2細胞中pSmad 3C/3L基因的表達水平。以蛋白質印跡法(Western Blot)驗證轉染效率,并檢測LX-2細胞中的α平滑肌肌動蛋白(α-SMA)、纖維酶原激活物抑制劑-1(PAI-1)和Ⅰ型膠原蛋白(Collagen-Ⅰ)的表達水平。以四甲基偶氮唑鹽微量酶反應比色法(MTT法)檢測選擇性上調pSmad 3C/3L對LX-2細胞增殖能力的影響。觀察TGF-β1誘導的Smad3不同位點磷酸化對人肝纖維化細胞增殖和肝纖維化關鍵蛋白表達的影響,進一步探究pSmad 3C/3L在肝纖維化進展中的作用機制。
1 材料與方法
1.1 儀器與試劑YJ-1450型醫用凈化工作臺(北京冠鵬凈化設備有限責任公司);Nap-co-6100型二氧化碳培養箱(美國杜邦公司);多功能酶標儀(荷蘭雷勃公司)。DMEM培養基(美國HyClone公司,20170213);新生胎牛血清(杭州四季青生物工程材料有限公司,19070503);TGF-β1(Peprotech 公司,20161015);FuGENE?HD轉染試劑(Promega公司,20161121);選擇培養基(Opti-MEM,20150507);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)(美國Sigma公司產品,20161207);Western及IP細胞裂解液(20170530)、BCA蛋白濃度試劑盒(碧云天生物研究所20170918);3種質粒和pSmad3L抗體(日本關西醫科大學Matsuzaki博士惠贈);Smad3(20170621)、Collagen-Ⅰ、PAI-1(20170309)和α-SMA抗體(Santa Cruz生物技術公司,20170415);pSmad3C抗體(Cell Signaling Technology公司,20170110)
1.2 細胞株LX-2細胞株購于上海康朗生物科技有限公司。
1.3 選擇性上調pSmad3C/L的LX-2細胞系的建立
1.3.1 細胞培養與實驗分組 LX-2細胞于含15%胎牛血清的DMEM培養基中,37℃,5%二氧化碳中常規培養。細胞轉染和蛋白檢測實驗中,普通LX-2細胞和3種質粒轉染組分別設置對照組,TGF-β1刺激1 h組,TGF-β1刺激12 h組。細胞增殖實驗中,LX-2細胞和3種質粒轉染組分別設置對照組和TGF-β1刺激組。
1.3.2 Smad3 WT、Smad3 EPSM和Smad3 3S-A質粒轉染LX-2細胞 將15%的DMEM培養基中培養至95%融合的LX-2細胞接種到6孔板中,待24 h后,6孔板中細胞培養至對數生長期,接近80%融合即可進行質粒轉染。轉染前棄去培養基,用磷酸緩沖鹽溶液(PBS)洗2遍,配制轉染試劑100 μL選擇培養基(Opti-MEM)+2 μg(計算體積)質粒/孔+6 μL/孔Fugene?HD(脂質體轉染試劑),室溫孵15 min,加入FuGENE?HD時注意不要觸碰EP管壁,充分混勻。孵育時間到后貼壁加入6孔板中。對照組加入空質粒和等體積的Opti-MEM+Fugene HD。所有加入無血清無雙抗的培養基放入37℃、5%二氧化碳培養箱中培養。6 h后,更換含血清的完全培養基。
1.4 MTT法檢測轉染3種質粒對細胞增殖能力的影響轉染3種質粒的LX-2細胞接種于96孔板中,種板密度為1×104/L,15%胎牛血清的培養基中培養24 h后,細胞密度接近90%時,饑餓過夜。除對照組外其余各孔分別加入9 pmol/L TGF-β1,而對照組添加等體積的無血清培養基,培養6~8 h。每組設置6個復孔。20 μL MTT加入到每孔中,37℃培養4 h。棄去各組細胞的培養液,每孔加入二甲基亞砜(DMSO)150 μL,吹打,藍紫色充分溶解后,用酶標儀測量各孔490 nm波長處吸光度值。
1.5 蛋白質印跡法檢測LX-2細胞中相關蛋白表達水平 轉染3種質粒的LX-2細胞,吸除培養基,PBS洗1遍,加無血清無雙抗的培養基,細胞饑餓12 h,隨后加入TGF-β1刺激1 h或12 h后,Western及IP細胞裂解液提取細胞總蛋白,BCA蛋白定量試劑盒定量并調平蛋白樣本濃度并變性。用十二烷基硫酸鈉/聚丙烯酰胺凝膠電泳法檢測目的蛋白表達水平,濕轉移法將凝膠上的條帶轉移到膜上。轉膜結束后,用剪刀剪個角標記正反,封閉后依次進行目的蛋白的特異性一抗二抗結合。最后使用Super Signal TM West Femto Trial Kit(賽默飛,中國)顯影。
1.6 統計學方法本研究采用SPSS 17.0軟件。統計結果表示為xˉ±s。多組間比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用LSD法,P<0.05被認為差異有統計學意義。
2 結果
2.1 Smad3 WT、Smad3 EPSM和Smad3 3S-A 3種質粒轉染LX-2細胞的結果TGF-β1(9 pmol/L)刺激1 h后,提取各組細胞總蛋白,蛋白質印跡法結果顯示,與LX-2對照組比較,轉染Smad3 WT、Smad3 EPSM和Smad3 3S-A 3種質粒的LX-2細胞中Smad3蛋白的表達均明顯增加[(0.48±0.02),(0.57±0.03),(0.60±0.02),(0.59±0.03);P<0.05]。與LX-2+Smad3 WT組相比,轉染Smad3 EPSM質粒的LX-2細胞中pSmad3C蛋白表達明顯增加[(0.33±0.02)比(0.44±0.01),P<0.05],轉染Smad3 S-A質粒組pSmad3L蛋白表達明顯增加[(0.36±0.01)比(0.42±0.02),P<0.05]。此結果提示,轉染3種質粒成功地選擇性上調了LX-2細胞中pSmad 3C/3L的表達。見圖1。
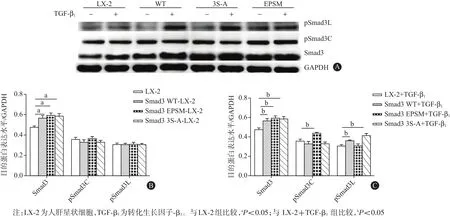
圖1 轉染野生型Smad3基因(Smad3 WT)、Smad3連接區磷酸化位點突變的基因(Smad3 EPSM)及Smad3 C末端磷酸化位點突變的基因(Smad3 3S-A)3種質粒后目的蛋白表達水平(n=3):A為蛋白質印跡法電泳圖,B為無TGF-β1刺激時,目的蛋白表達柱狀圖,C為TGF-β1刺激后,目的蛋白表達柱狀圖
2.2 選擇性上調pSmad 3C/3L對LX-2細胞增殖能力的影響MTT結果顯示,在無TGF-β1刺激情況下,轉染Smad3 WT、Smad3 EPSM和Smad3 3S-A 3種質粒本身對LX-2細胞增殖能力無明顯影響[吸光度值(0.56±0.03),(0.59±0.09),(0.58±0.09),(0.59±0.04);P<0.05]。TGF-β1刺激6~8 h后,對LX-2組,Smad3 WT組、Smad3 3S-A組細胞增殖均有誘導作用,其中Smad3 3S-A質粒組對細胞增殖的促進作用更顯著[吸光度值(0.78±0.06),(0.77±0.08),(0.93±0.05);P<0.05],提示:TGF-β1刺激可誘導LX-2細胞的增殖反應,選擇性高表達pSmad3L可進一步促進TGF-β1誘導的細胞增殖反應。而轉染Smad3 EPSM質粒組則表現出細胞增殖反應較無TGF-β1刺激組減弱[吸光度值(0.58±0.09)比(0.48±0.03),P<0.05],提示:TGF-β1刺激后,選擇性高表達pSmad3C可抑制細胞增殖反應。見圖2。
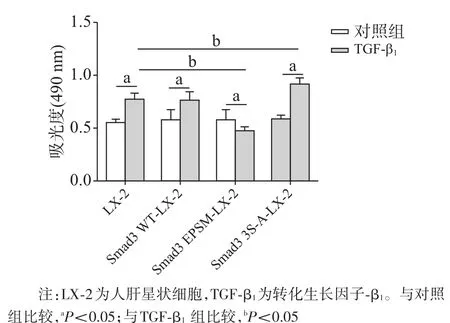
圖2 選擇性上調pSmad 3C/3L對LX-2細胞增殖能力的影響(n=6)
2.3 選擇性上調pSmad 3C/3L對LX-2細胞中α-SMA、PAI-1和Collagen-Ⅰ蛋白表達水平的影響TGF-β1(9 pmol/L)刺激12 h后,提取各組細胞總蛋白,蛋白質印跡法結果顯示,與對照組比較,α-SMA蛋白在Smad3 WT組略有增加,在Smad3 EPSM組明顯降低,而在Smad3 S-A組表達明顯增加[(0.66±0.04),(0.71±0.01),(0.50±0.004),(0.82±0.002);P<0.05]。與對照組比較,PAI-1蛋白在Smad3 WT質粒組無明顯變化,在轉染Smad3 EPSM質粒的LX-2細胞中表達明顯減少,而在轉染Smad3 S-A質粒組表達則明顯增加[(0.30±0.006),(0.32±0.009),(0.20±0.004),(0.34±0.006);P<0.05]。Collagen-Ⅰ蛋白變化趨勢與PAI-1相同[(0.27±0.002),(0.32±0.01),(0.24±0.003),(0.35±0.004);P<0.05]。此結果提示,選擇性上調pSmad3C,可以抑制LX-2細胞中α-SMA、PAI-1和Collagen-Ⅰ的表達;而選擇性上調pSmad3L則可促進α-SMA、PAI-1和Collagen-Ⅰ的表達。見圖3。
3 討論
研究表明,肝纖維化的主要病理機制在于細胞外基質(ECM)的沉積,而肝星狀細胞是分泌ECM的主要細胞,是肝纖維化發生發展的關鍵環節[12]。Collagen-Ⅰ是ECM的主要成分,其含量的高低在一定程度上反應了肝纖維化的嚴重程度。抑制肝星狀細胞的增殖,減少Collagen-Ⅰ的產生可以減輕甚至逆轉肝纖維化[13]。α-SMA被普遍認為是肝星狀細胞活化的標志性蛋白,有研究表明α-SMA含量的高低與肝星狀細胞的增殖和肝纖維化的程度密切相關[12]。課題組前期研究表明,二乙基亞硝胺(DEN)誘導的大鼠肝纖維化-肝癌進展過程中,pS-mad3L和PAI-1蛋白的表達水平逐漸增加,進一步研究發現,復方丹參提取物和丹酚酸B均可通過調控TGF-β/Smad3信號通路的活化發揮抗肝纖維化-肝癌的作用,具體可能涉及到對Smad3不同位點磷酸化的水平的調控[14-15]。本研究通過轉染Smad3 WT、Smad3 EPSM、Smad3 3S-A 3種質粒,選擇性上調LX-2細胞中pSmad 3C/3L的表達,并進一步探討選擇性上調pSmad 3C/3L對LX-2細胞增殖功能的影響,及肝纖維化關鍵蛋白α-SMA、PAI-1和Collagen-Ⅰ表達的影響。
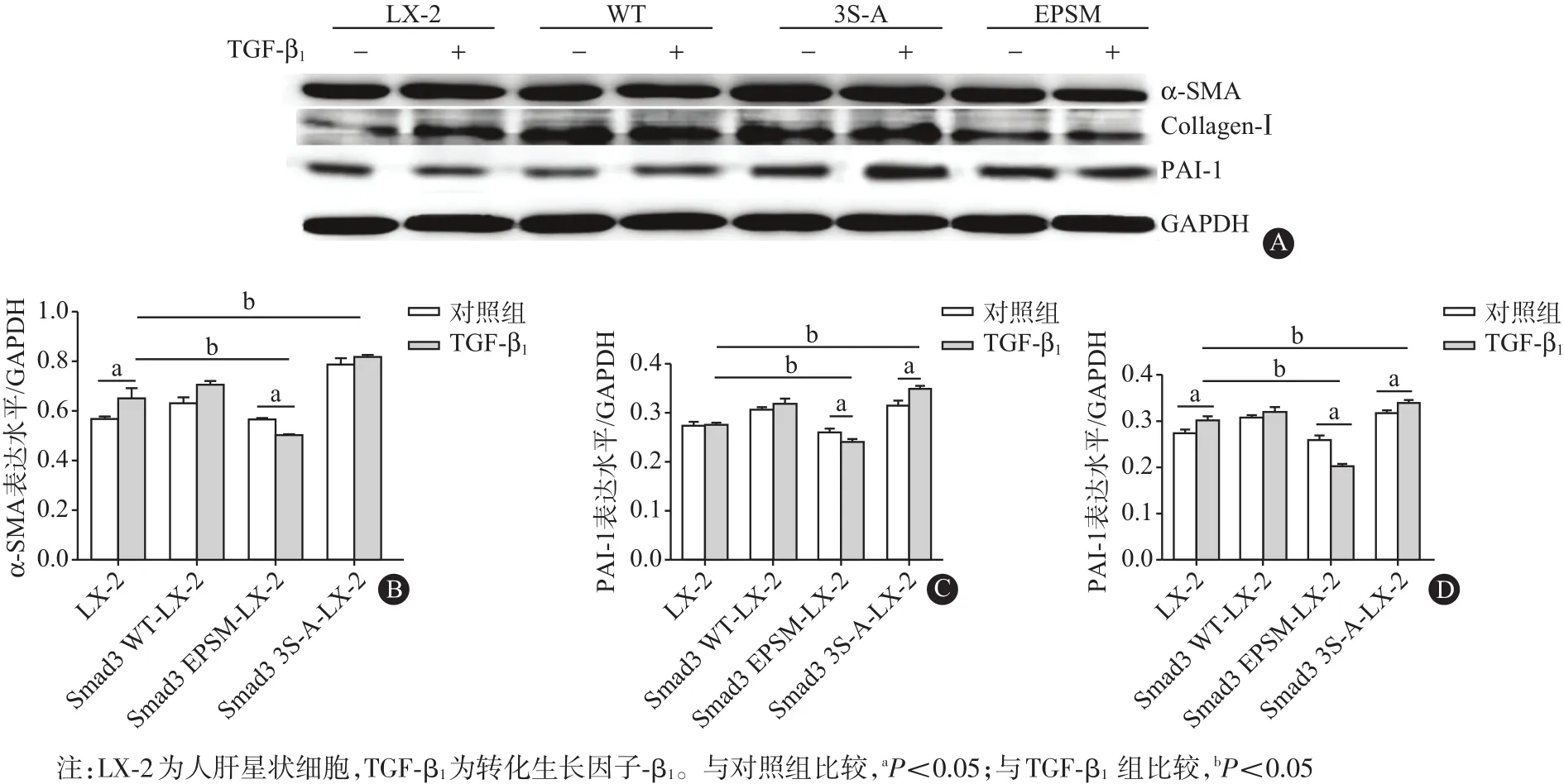
圖3 選擇性上調pSmad 3C/3L對LX-2細胞中α平滑肌肌動蛋白(α-SMA)、纖維酶原激活物抑制劑-1(PAI-1)和Ⅰ型膠原蛋白(Collagen-Ⅰ)表達水平的影響(n=3):A為蛋白質印跡法電泳圖,B、C、D分別為α-SMA、PAI-1和Collagen-Ⅰ蛋白表達柱狀圖
瞬時轉染和穩定轉染是目前常用的質粒轉染技術,瞬時轉染方法由于其具有快速方便,轉染周期較短,轉染效率高等特點,目前在基礎研究中使用越來越廣泛[12-13]。瞬時轉染技術可以在短時間內將攜帶特定外源基因的質粒轉染進入細胞內,利用同源重組的原理整合到細胞染色體DNA上,實現進一步的表達[16-17]。本研究采用性能更優的FuGENE?HD脂質體轉染試劑向LX-2細胞轉染Smad3 WT、Smad3 EPSM及 Smad3 3S-A 3種質粒,選擇性上調LX-2細胞中pSmad 3C/3L的表達水平,在細胞水平研究Smad3不同位點磷酸化在肝纖維化進展中的重要作用,進一步揭示肝病的臨床病例研究中pSmad 3C/3L在肝臟中差異表達的內在分子機制[11],同時在一定程度上為本課題組后續構建的Smad3 C末端磷酸化位點突變的整體動物水平的研究提供了理論支撐。
肝星狀細胞的過度增殖是肝纖維化發生發展的關鍵環節,本研究中,TGF-β1刺激后,選擇性高表達pSmad3L可進一步促進TGF-β1誘導的細胞增殖反應,而選擇性高表達pSmad3C可抑制TGF-β1誘導的細胞增殖反應。進一步的結果表明選擇性上調pSmad3C,可以明顯抑制LX-2細胞中PAI-1、Collagen-Ⅰ和α-SMA的表達;而選擇性上調pSmad3L則可促進α-SMA、PAI-1和Collagen-Ⅰ的表達。上述結果提示,選擇性上調pSmad 3C/3L表達可調控肝星狀細胞的增殖和肝纖維化關鍵蛋白α-SMA、PAI-1和Collagen-Ⅰ表達,為肝纖維化的治療提供新的思路。

