miR-449b多態性位點rs10061133差異調控LHCGR表達
潘虹,陳蓓麗,李騰龑,馬旭*
(1.北京協和醫學院研究生院,北京 100730;2.國家衛生健康委科學技術研究所,北京 100081;3.安徽醫科大學第一附屬醫院生殖醫學中心,合肥 230022)
卵巢功能不全(premature ovarian insufficiency,POI)又稱為卵巢早衰(premature ovarian failure,POF),是一種嚴重影響女性生殖健康的疾病,臨床表現為40歲以前停經并伴隨血漿促性腺激素水平增加[1]。其可能的病理機制包括原始卵泡池的初始減少或原始卵泡未能成熟[2]。多種因素可導致POI的發生,然而,大多數POI病例被認為是特發性的,可能與遺傳因素相關。目前,經過大量工作已經鑒定若干非綜合征型POI相關基因,如FSHR、LHCGR、NR5A1、NOBOX、FOXL2、FIGLA、BMP15、NANOS3、STAG3、ADAMTS19和BMPR2,極大促進了我們對POI發病機制的了解[3]。
微小RNA(miRNA)參與卵母細胞成熟和卵泡發生的過程,其表達改變可能影響POI的發生[4-5]。MIR449B(miR-449b)是miR-449簇的成員,具有強烈的組織表達特異性,在睪丸和卵巢中具有較高水平[6]。目前,已經鑒定了許多miR-449b靶基因,例如SIRT1、CCNE2、MET、GMNN、HDAC1、CDK4、CDC25A和CDK6,在多種生物學過程中發揮重要作用[7]。Rs10061133 A>G是miR-449b成熟區(hsa-miR-449b-5p)一個高度保守的多態性位點,為研究該多態性位點與POI發病的相關性,我們之前通過質譜的方法對miR-449b rs10061133多態位點進行基因分型,關聯分析結果顯示rs10061133 AA基因型攜帶者患POI的風險高[8]。但目前尚不清楚miR-449b參與POI的具體機制,本研究擬通過預測鑒定其與POI相關下游靶基因,了解其參與POI的可能作用方式。
資料與方法
一、預測miR-449b的潛在靶基因
miRWalk(http:∥mirwalk.umm.uni-heidelberg.de/)在線預測miR-449b的潛在靶基因[9]。TargetScanHuman 7.2(http:∥www.targetscan.org/vert_72/)用于預測miR-449b的結合位點。文獻檢索這些潛在靶基因與POI發生發展的相關性,找到可能與POI相關的miR-449b潛在靶基因。
二、質粒構建和定點突變
對照載體、miR-449b(rs10061133 AA基因型)、miRNA抑制劑對照和miR-449b抑制劑購自GeneCopoeia(Rockville,Maryland,美國)。以miR-449b(AA基因型)表達質粒為模板,使用適當的引物通過定點突變獲得miR-449b的rs10061133(GG基因型)表達質粒。黃體生成素/絨毛膜促性腺激素受體(luteinizing hormone/choriogonadotropin receptor,LHCGR)的野生型3’UTR片段通過以人細胞系HEK 293TcDNA為模板進行PCR擴增獲得。將包括預測結合位點的413-bp擴增產物(LHCGR-luc)克隆到pGL3-Control載體(Promega,Madison,美國)luc+基因下游的XbaI位點。用適當的引物通過定點突變獲得miR-449b結合位點區域缺失(AGTGTAGTCTATGACCACTGCCA/-)的突變型LHCGR 3’UTR片段(LHCGR-luc-del)。通過Sanger測序驗證所有構建質粒。所有引物信息見表1,質粒構建和定點突變示意圖如圖1所示。

表1 用于定點突變和質粒構建的引物
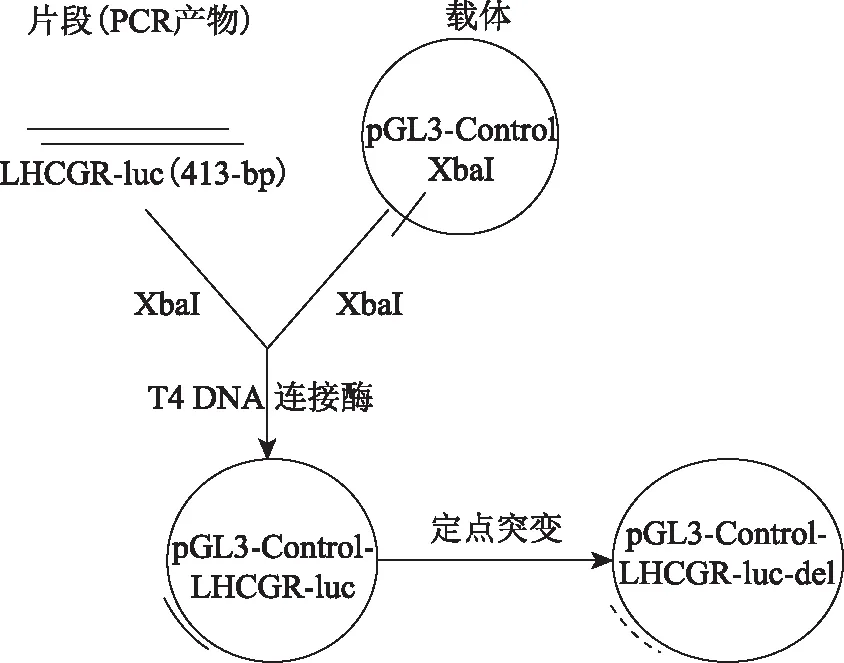
圖1 質粒構建和定點突變示意圖
三、細胞培養,瞬時轉染和雙熒光素酶檢測
HEK293T細胞(本室保存)培養在含有10%胎牛血清的DMEM高糖培養基中,取對數生長期細胞,接種細胞到96孔培養板,待匯合度達到約50%~60%轉染。海腎熒光素酶(pRL-TK)作為內對照,消除每個孔轉染效率不同的影響。使用Lipofectamine 2000(Invitrogen,Carlsbad,CA,美國)進行轉染。轉染后48 h,洗滌并裂解細胞,利用雙熒光素酶報告檢測系統(Promega,Madison,WI,美國)在Promega發光檢測儀上測量熒光素酶活性。操作按照產品說明書進行。
四、統計分析
雙熒光素酶測定值代表3次獨立重復的平均值。所有分析均使用GraphPad Prism 5進行。使用獨立樣本t檢驗計算,以P<0.05為差異有統計學意義。
結 果
一、與POI相關的miR-449b潛在靶基因LHCGR
為了探究miR-449b與POI相關的可能機制,我們使用miRWalk預測其潛在靶基因。我們還搜索了所有已發表的相關文獻,以確定可能的POI相關基因。在軟件預測的miR-449b的所有潛在靶基因中,我們選擇可能與POI相關的基因LHCGR作為miR-449b的潛在靶基因。使用TargetScanHuman 7.2,我們預測LHCGR的3’UTR(人LHCGR NM_000233 3’UTR長度:923 bp)161-168序列作為miR-449b的潛在結合靶點。
二、miR-449b靶向LHCGR的3’UTR
為了確定LHCGR是否是miR-449b的靶基因,在雙熒光素酶測定中使用野生型和突變型LHCGR3’UTR(LHCGR-luc和LHCGR-luc-del)作為報告基因。我們的結果顯示,與對照載體相比,miR-449b顯著減弱野生型3’UTR的熒光素酶活性(圖2A)。相反,突變型3’UTR對miR-449b幾乎沒有應答(圖2B),表明LHCGR可能是miR-449b的直接靶基因。
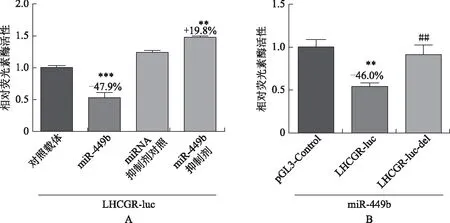
A:對照載體、miR-449b、miRNA抑制劑對照或miR-449b抑制劑分別與LHCGR 3’UTR野生型(LHCGR-luc)共轉染HEK 293T細胞:與miRNA抑制劑對照比較,**P<0.01;與對照載體比較,***P<0.001。B:LHCGR 3’UTR野生型(LHCGR-luc)或突變型(預測靶位點缺失,LHCGR-luc-del)分別與miR-449b共轉染HEK 293T細胞:與pGL3-control比較,**P<0.01;與LHCGR-luc比較,##P<0.01圖2 HEK 293T細胞中雙熒光素酶報告實驗顯示LHCGR是miR-449b的直接靶基因(pRL-TK共轉染作為內參)
三、不同基因型對LHCGR 3’UTR表達的影響
為了確定miR-449b rs10061133不同基因型對LHCGR3’UTR的影響,進行了進一步的雙熒光素酶測定。我們的結果顯示,miR-449b AA基因型的LHCGR-luc表達顯著低于GG基因型(P<0.05)(圖3)。表明miR-449b的rs10061133 AA基因型比GG基因型更明顯地抑制靶基因LHCGR表達。
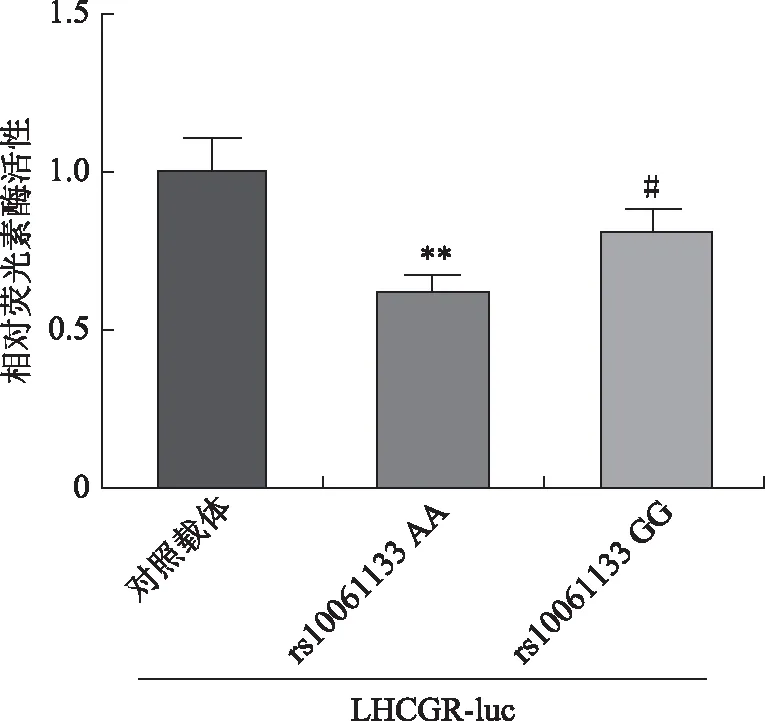
rs10061133 AA或GG基因型分別與LHCGR 3’UTR野生型(LHCGR-Luc)共轉染HEK 293T細胞。pRL-TK共轉染作為內對照。與對照載體比較,**P<0.01;與rs10061133 AA比較,#P<0.05圖3 miR-449b不同基因型對LHCGR-luc表達的影響
討 論
LHCGR基因編碼黃體生成素/絨毛膜促性腺激素受體,主要在睪丸和卵巢中表達[6]。LHCGR在卵泡發育過程中起關鍵作用,通過人卵巢組織的免疫組織化學染色和蛋白質印跡實驗發現該蛋白開始出現在早期竇卵泡的顆粒細胞和卵泡膜細胞中,并且在卵丘細胞中亦有表達[10]。動物模型實驗顯示小鼠Lhcgr基因靶向敲除可以導致小鼠不育,雄性和雌性小鼠的內外生殖器發育均嚴重不足,其中雌性小鼠竇前卵泡生長停滯[11]。LH通過LHCGR在卵泡生長和卵母細胞成熟中起重要作用。在顆粒細胞分化期間誘導LHCGR允許排卵前卵泡對中期LH峰作出應答并且LH是排卵所必需的[12]。LHCGR的異常表達將導致部分卵巢功能衰竭,攜帶LHCGR基因失活突變的女性具有LH增加、卵巢增大、月經稀發和不育的臨床特征[13-14]。Fonseca等[3]通過二代測序在2名POI患者中發現2個LHCGR基因突變位點(c.296A/G和c.526C/T)。因此,LHCGR可能是POI的候選致病基因。總之,較低的LHCGR表達或LHCGR突變可能與POI發生相關。miRNA成熟序列中的多態性位點(SNP)可影響靶基因結合或miRNA成熟過程[15-17]。我們的前期研究結果表明,miR-449b rs10061133 AA基因型可能是POI的風險因素[8]。為了進一步探索miR-449b多態性與POI的相關性,使用生物信息學預測和熒光素酶雙報告基因檢測尋找與POI相關的miR-449b靶基因,軟件預測和實驗結果均表明LHCGR為miR-449b的靶基因并且miR-449b rs10061133不同基因型(AA和GG)對LHCGR抑制作用程度不同。miR-449b與LHCGR3’UTR的結合在AA基因型下可以比GG基因型更穩定和有效,并因此導致更少的LHCGR表達,miR-449b多肽位點rs10061133 A>G與POI的相關性可能通過差異調控其靶基因LHCGR的表達來實現。
綜上所述,我們的結果證實miR-449b可能通過靶向POI相關基因LHCGR參與POI的發生,并且AA基因型可能對其靶基因LHCGR具有比GG基因型更強的抑制作用。更大規模的樣本研究和進一步的功能實驗,將有助于了解miR-449b rs10061133 A>G和POI的相關性。

