馬鈴薯酯酰基水解酶的特性研究
吳喬羽 - 徐姍楠 - 翁 晴 楊丹璐 - 龔盛祥 -張 維 吳金鴻 - 王正武 -
(1. 上海交通大學農業與生物學院,上海 200240;2. 中國水產科學研究院南海水產研究所,廣東 廣州 510300;3. 農業部南海漁業資源開發利用重點實驗室,廣東 廣州 510300)
馬鈴薯(SolanumtuberosumL.)為茄科屬一年生草本植物,塊莖含有豐富的碳水化合物、蛋白質、膳食纖維、維生素等營養成分,除可供人類食用外,工業用途也十分廣泛。作為全球第四大糧食作物,馬鈴薯廣泛分布在世界各大地區,其加工業發展十分迅速[1]。馬鈴薯工業的發展造成數量龐大的馬鈴薯廢液(potato fruit juice,PFJ)被排放。PFJ中干物質含量為20~50 g/kg,其中粗蛋白含量占1/3[2]。目前,利用超濾膜處理馬鈴薯廢液,能夠從中回收馬鈴薯蛋白及低聚糖;采用“冷凍催化氧化絮凝吸附”工藝可以使馬鈴薯廢液中有機物沉淀,所產生的沉淀有作為飼料或飼料添加劑的潛力[3]。然而這些處理馬鈴薯廢液的方法均存在耗時耗力、不適合進行大規模工業應用的缺點。
馬鈴薯塊莖中的蛋白質一般分成三類:Patain(分子量39~45 kDa)、蛋白酶抑制劑(分子量5~25 kDa)、其他蛋白(分子量50 kDa以上)。Patain是一組特異性存在于馬鈴薯塊莖中的球類糖蛋白,占塊莖總蛋白的40%左右,自然條件下以二聚體的形式存在,其等電點的范圍為pH 4.45~5.17[4]。作為馬鈴薯塊莖貯藏類蛋白,Patain除具有抗氧化活性[5]外,還具有良好的乳化性、發泡性和凝膠性[6]。這些特性使其能作為一種良好的食品添加劑應用于食品加工[7]。此外,與其他塊莖貯藏蛋白質有所不同的是,Patain具有非特異性酯酰基水解酶活性(LAH),對于磷脂、糖酯、單酰基和二酰基甘油、長鏈脂肪酸酯等都具有一定的特異性[8]。與脂肪酶在油水界面發揮作用不同,酯類酰基水解酶對于脂類的作用是在溶液中進行。Patatin具備的這種酶活性與植物的生長過程有著密切關聯,其可以水解細胞內的多種底物,釋放出大量的脂肪酸,為三羧酸循環和β-氧化作用提供能源[9]。
目前雖然已有較多關于馬鈴薯酯酰基水解酶提取純化的方法:膨脹床吸附法[10]、基因表達法[11]、磁性殼聚糖微球法[12]、凝膠色譜法[13]等,但是這些方法需要多個純化步驟,或者在預處理階段引入了化學試劑,導致蛋白質容易變性且純化效率低不利于后續研究及工業化應用。同時,目前對于馬鈴薯酯酰基水解酶的研究主要集中于分子水平[14],解釋Patatin作為酯酰基水解酶(LAH)的特性、活性機理以及影響因素的研究相對較少,關于其在食品工業領域中的應用還十分有限。試驗擬從馬鈴薯汁水(PFJ)中提取純度較高的Patatin,并且以單分散態脂肪作為底物,深入且系統探討Patatin作為酯酰基水解酶(LAH)的酶學特性,為今后將Patatin作為新型天然酶制劑應用在食品加工領域提供一定的理論指導。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
馬鈴薯全粉(凍干粉末):克新1號,上海綠晟實業有限公司;
Q-Sephrose Fast Flow:生化級,美國GE Healthcare公司;
電泳上樣緩沖液:分析純,上海碧云天生物技術有限公司;
考馬斯亮藍G-250:分析純,北京索萊寶科技有限公司;
對硝基苯乙酸酯(p-Nitrophenylacetate,PNP-acrtate):分析純,美國Sigma公司;
其他試劑均為國產分析純。
1.1.2 主要儀器設備
pH計:FE20型,梅特勒—托利多儀器(上海)有限公司;
恒溫混勻器:THERMOMIXER C型,艾本德中國有限公司;
電泳儀:EPS300型,上海天能科技有限公司;
GeneGenius紫外凝膠圖像儀:TANON 3500型,美國Synegene公司;
離心機:J6-MI型,美國貝克曼庫爾特有限公司;
紫外—可見分光光度計:UV-2802S型,上海UNIC公司;
純水系統:Milli-Q Biocel型,美國Millipore公司。
1.2 試驗方法
1.2.1 模擬馬鈴薯汁水(PFJ)的制備 取適量馬鈴薯全粉,按照1 g/10 mL的比例溶解于去離子水中,并添加0.5 g/100 mL 的NaHSO3,置于恒溫混勻器上攪拌1 h,然后離心取上清液,保存備用。
1.2.2 馬鈴薯粗蛋白的提取 根據崔竹梅等[15]的試驗方法做適當修改:將制備得到的上清液pH調至4.0,靜置10 min后,攪拌1 h,在6 000 r/min轉速下離心15 min,取沉淀,復溶于20 mmol/L磷酸鹽緩沖液(pH 7)中,0.45 μm 濾膜過濾后得粗蛋白液。
1.2.3 離子交換柱層析 根據孫瑩等[16]的試驗方法做適當修改:Q-Sepharose Fast Flow(2.6 cm×20 cm)柱子用5倍柱體積清水清洗,5倍柱體積pH 7的20 mmol/L磷酸鹽緩沖液平衡后,取5 mL粗蛋白液上柱,用20 mmol/L 磷酸鹽緩沖液淋洗5倍柱體積,收集離子交換穿透峰,然后用含有1 mol/L NaCl的20 mmol/L磷酸鹽緩沖液(pH 7)洗脫,在280 nm波長下檢測吸光度值,收集離子交換洗脫液。透析后冷凍干燥,保存于-20 ℃冰箱中,備用。
1.2.4 SDS-PAGE電泳分析 取10 mg冷凍干燥后的樣品配制成5 mg/mL蛋白液,從中取40 μL于EP管中,并加入10 μL上樣緩沖液,混合后將EP管置于沸水中孵育5 min,然后用12%聚丙烯酰胺凝膠分離蛋白樣品,電泳緩沖液為1×Tris-甘氨酸電極緩沖液,濃縮膠電壓80 V,分離膠電壓120 V。電泳結束后,取出分離膠,用考馬斯亮藍染液染色30 min,隨后用脫色液脫色至透明。在全自動化學發光圖像分析系統上拍照分析[17-18]。
1.2.5 馬鈴薯酯酰基水解粗酶液的制備 取冷凍干燥后得到的樣品粉末用去離子水配制成6 mg/mL的蛋白液,轉移至離心管中,3 000 r/min離心5 min,收集上清液作為試驗用粗酶液。
1.2.6 酯酰基水解酶活性測定 參照Racusen[19]的方法,稍作修改。稱取63 mg PNP-acrtate,溶解于10 mL乙醇中,從中取1 mL加99 mL去離子水定容至100 mL。反應體系包括:2.5 mL 0.1 mol/L Tris-HCl (pH 8.2)、2.5 mL PNP-acrtate稀釋液和1 mL酶液。在37 ℃水浴中保溫25 min后,加入6 mL 95%乙醇終止反應,冷卻至室溫后用紫外分光光度計在波長410 nm下測定吸光值(A410 nm)。每組試驗獨立重復3次,以每分鐘A410 nm變化0.01為一個酶活力單位(U),按式(1)計算酶比活。
(1)
式中:
U——酶比活,U/(min·mg·蛋白);
△A——反應時間內吸光值的變化值;
W——樣品蛋白質的含量,mg;
T——反應時間,min。
1.2.7 酶反應溫度對酯酰基水解酶的影響 固定pH為8.2,酶反應時間25 min,考察酶反應溫度(25,30,35,37,40,45,50,55,60 ℃)對馬鈴薯酯酰基水解酶活性的影響。
1.2.8 酶反應時間對酯酰基水解酶的影響 固定pH為8.2,酶反應溫度37 ℃,考察酶反應時間(5,10,15,20,25,30,35,40,45 min)對馬鈴薯酯酰基水解酶活性的影響。
1.2.9 pH對酯酰基水解酶活性的影響 固定酶反應溫度37 ℃,酶反應時間25 min,考察pH(4.0,5.0,6.0,7.0,8.0)對馬鈴薯酯酰基水解酶活性的影響。
1.2.10 酯酰基水解酶熱穩定性的測定 固定pH為8.2,將酶液分別在40,50,60,70,80,90 ℃水浴中保溫10,30,60,90,120,180 min,然后測定酶活性。
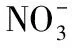
(2)
式中:
c——相對酶活,%;
m——試驗測定酶活,U;
n——最大酶活,U。
1.3 數據處理
使用SPSS數據統計軟件對試驗數據進行單因素方差分析,采用Graphpad Prism 6.0軟件繪圖。每個試驗重復3次,取平均值作為試驗結果。計算顯著性P(取α=0.05),以P<0.05為差異有顯著性。
2 結果與分析
2.1 馬鈴薯粗蛋白的色譜分離及Patatin鑒定
馬鈴薯粗蛋白按照1.2.2方法提取制備后,再經過Q-Sepharose Fast Flow陰離子交換色譜柱分離,得到3個色譜分離峰(見圖1)。與孫瑩等[16]得出的馬鈴薯粗蛋白離子交換色譜圖進行對比分析,初步判斷3號峰是目的蛋白所在峰。收集3號峰洗脫液,濃縮并對其進行電泳分析,結果見圖2。由圖2可知,峰3在41~42 kDa 相對分子量位置有一條主要的蛋白質條帶,與文獻[20]中所得到的馬鈴薯Patatin的蛋白分子量基本一致,說明經過Q-Sepharose Fast Flow陰離子交換色譜柱分離并用1 mol/L NaCl的20 mmol/L磷酸鹽緩沖液(pH 7)洗脫液洗脫下來的組分中含有Patatin這一目的蛋白,并從條帶的相對灰度來看,該蛋白的相對含量達到90%以上。因此,后續以該組分為主要研究對象進行馬鈴薯酯酰基水解酶的特性分析。
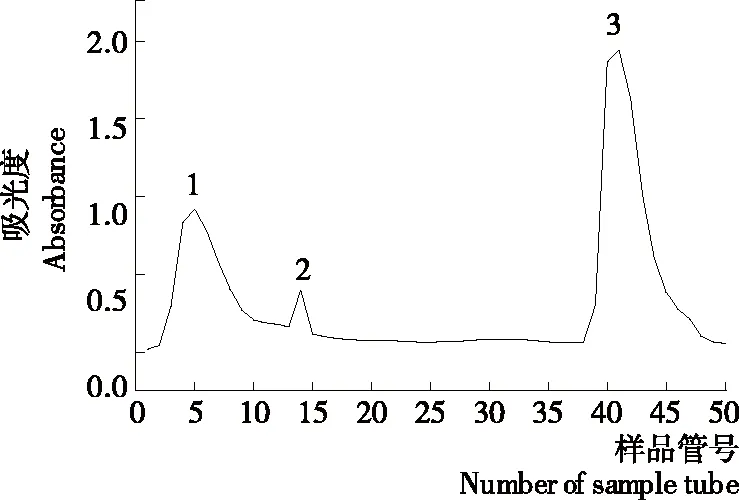
圖1 馬鈴薯粗蛋白離子交換色譜

1. 標記Marker 2~3. 馬鈴薯粗蛋白 3~4. 陰離子柱層析蛋白
圖2 Q-Sepharose fast flow離子交換層析組分的SDS-PAGE圖譜
Figure 2 SDS-PAGE of the fraction by Q-Sepharose fast flow ion-exchange chromatography
2.2 酶反應溫度對馬鈴薯酯酰基水解酶活性的影響
圖3結果表明,馬鈴薯酯酰基水解酶在25~37 ℃時,其活性隨著溫度的升高逐漸提高(P<0.05),在37 ℃時活性達到最大,之后酯酰基水解酶的活性隨著溫度升高呈現下降的趨勢(P<0.05)。因此,馬鈴薯酯酰基水解酶的最適反應溫度為37 ℃。在Racusen等[21]的研究中,馬鈴薯酯酰基水解酶的最適酶反應溫度為25~35 ℃,與試驗結果有稍許差異,可能是由于使用了不同的馬鈴薯品種和提取方式得到了亞基組成不同的Patatin。馬鈴薯酯酰基水解酶本質是一類活性蛋白質,溫度過高導致蛋白變性,從而部分或全部失去水解活性。在常態下,天然Patatin的二級結構中含有46%的β-折疊和33%的α-螺旋,并且Patatin在原始狀態下是一種三級結構穩定的球狀蛋白,色氨酸包埋在其疏水內核中。當Patatin所處體系中溫度低于45 ℃時,其二級結構保持不變。當體系溫度在45~55 ℃時,Patatin中α-螺旋含量下降,三級結構開始發生變化,內部的色氨酸逐漸向外暴露[22]。當體系溫度超過55 ℃時,α-螺旋含量迅速下降,無規則卷曲結構占據主導地位[23]。Creusot等[24]研究表明,Patatin的變性溫度為59 ℃,比其他蛋白例如β-乳球蛋白、大豆蛋白的低20 ℃,可能是因為Patatin分子內缺乏穩定的二硫鍵。
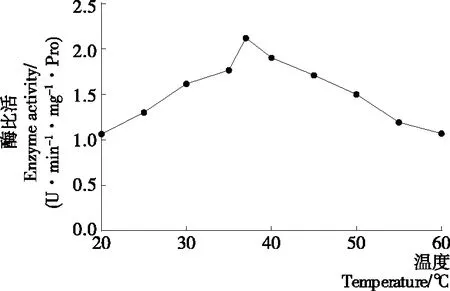
圖3 溫度對馬鈴薯酯酰基水解酶活性的影響
2.3 酶反應時間對馬鈴薯酯酰基水解酶的影響
從圖4可以看出,隨著酶反應時間的增加,馬鈴薯酯酰基水解酶的活性呈現增加的趨勢(P<0.05),當時間超過25 min以后,底物與酶的作用趨于飽和狀態,酶的活力保持平緩,甚至略有下降(P>0.05)。因此馬鈴薯酯酰基水解酶水解底物的最適酶反應時間應為25 min。
2.4 pH對馬鈴薯酯酰基水解酶活性的影響
從圖5可以看出,前期馬鈴薯酯酰基水解酶的水解活力隨著pH的增大而增大(P<0.05),當pH達到8.2時,酶水解活力達到最大值,之后隨著pH的增大而減小(P<0.05),因此最適pH為8.2。Pots等[25]研究表明,酸性條件下,Patatin的蛋白結構不可逆變性從而導致酶活性部分損失。當pH<4.5,即低于等電點時,由于天冬氨酸和谷氨酸殘基質子化,Patatin的凈電荷變為陽性,這種靜電相互作用的改變造成了Patatin的部分去折疊,此時Patatin二級結構的α-螺旋和β-折疊含量比較低。當pH為5時,Patatin的三級結構發生不可逆轉的改變。pH為6~8時,其構象是最穩定的。當pH>8時,Patatin二級結構中的α-螺旋含量低于20%,無規則卷曲結構含量逐漸上升[26]。酶分子的活性中心與可解離基團的結合狀態一般隨著體系溶液pH的變化而變化,影響酶和底物的結合,最適pH條件下,酶分子部位的活性基團可以與底物結合,發揮出最大的酶效力。當pH過高或者過低時,酶的構象會在一定程度上發生改變,導致酶活性的部分或全部喪失。Gambuti等[27]將Patatin作為一種澄清劑添加到葡萄酒中,研究其去除澀味的能力。由于等電點值低于紅酒的pH值,Patatin在葡萄酒中的溶解度較低,其在發揮澄清劑的作用后,易于分離且不造成影響。通過研究pH值對馬鈴薯酯酰基水解酶活性的影響,可以為將Patatin作為食品添加劑應用于食品工業中提供理論指導。
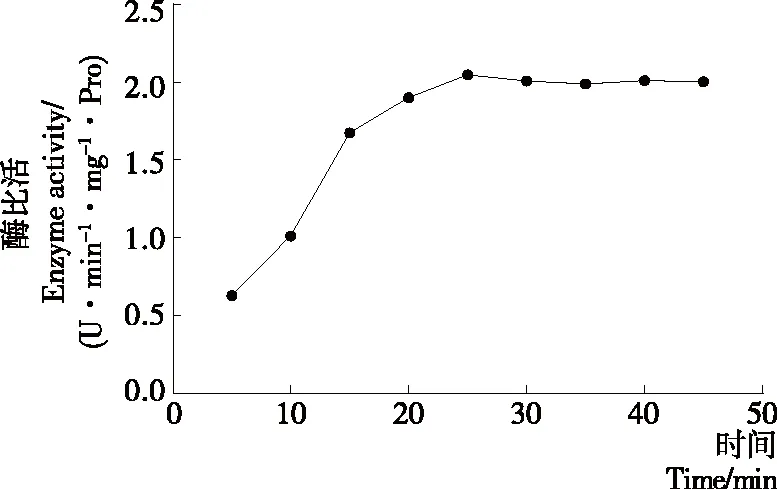
圖4 時間對馬鈴薯酯酰基水解活性的影響
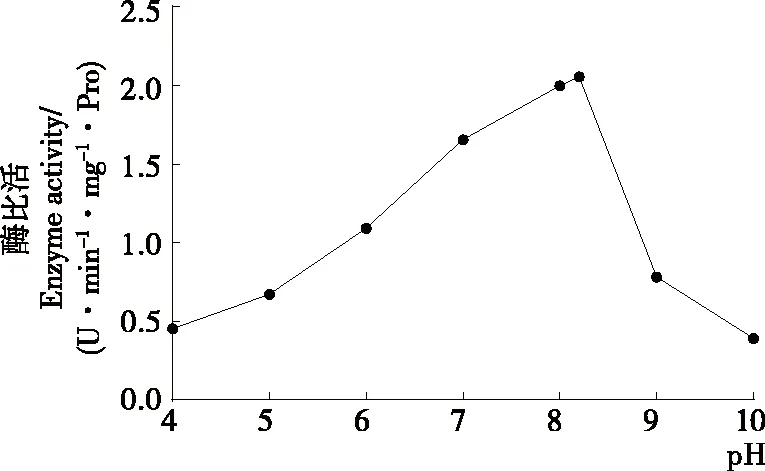
圖5 pH對馬鈴薯酯酰基水解酶活性的影響
2.5 馬鈴薯酯酰基水解酶的熱穩定性
從圖6中可以看出,在40 ℃下酯酰基水解酶的活性未出現明顯的下降(P>0.05);在50,60,70,80,90 ℃保溫10 min后,酶活性均顯著下降(P<0.05)。其中,在50 ℃下處理10 min時酶活力為未處理的56%,處理180 min 后酶活力為未處理的13%;在60 ℃下處理10 min 時酶活力僅為未處理的29%,處理180 min后酶活力僅為未處理的13%;在70 ℃下處理120 min、80 ℃下處理90 min、90 ℃下處理60 min后,酶的活性接近于喪失。說明熱處理溫度對于酯酰基水解酶的活性有較大的影響,并且當熱處理溫度低于50 ℃時有較好的穩定性。馬鈴薯酯酰基水解酶的活性不僅與熱處理溫度有關,與熱處理時間也有著密切的關聯。Patatin的變性溫度在59 ℃左右,當處理溫度低于40 ℃時,馬鈴薯酯酰基水解酶的結構與溫度的變化之間沒有明顯的相關性,低溫長時間處理不會大幅度降低馬鈴薯酯酰基水解酶的活性;當處理溫度超過50 ℃以后,短時間的處理也會大大降低馬鈴薯酯酰基水解酶的活性。Patatin可以水解奶酪中水溶性強、疏水性小的甘油三酯,釋放可以提高風味的游離脂肪酸。研究[28]發現,使用巴氏殺菌法來處理成熟后奶酪,Patatin會失去活性,并且能產生較低水平的副反應。

圖6 馬鈴薯酯酰基水解酶的熱穩定性
2.6 金屬離子對馬鈴薯酯酰基水解酶活性的影響
從圖7可以看出,不同類型的金屬離子對酰基水解酶的活性影響是不同的。在反應體系中添加Fe2+、Fe3+、Mg2+可以提高酶的活性,其中Fe2+可以明顯提高酯酰基水解酶的活性。在反應體系中添加Na+對酯酰基水解酶的活性沒有促進或抑制作用。添加K+、Ca2+能降低酯酰基水解酶的活性,其中5 mmol/L K+的抑制作用是10 mmol/L K+的兩倍;低濃度和高濃度的Ca2+均明顯降低了酯酰基水解酶的活性。不同濃度的Al3+和Zn2+對酯酰基水解酶呈現出不同的影響作用,5 mmol/L Al3+對于酶活性有促進作用,而10 mmol/L Al3+對酶活則沒有明顯影響。5 mmol/L Zn2+對于酶活有促進作用,而10 mmol/L Zn2+則抑制了酶的水解活力。金屬離子通過與酶活性部位的結合來影響酶的活力,不同種類和濃度的金屬離子對酶的結構和功能起到不同的作用[29],因此對酶解過程的影響不同。一般來說,低濃度的金屬離子與酶通過非特異性的靜電相互作用,而高濃度的金屬離子對酶結構的穩定性通常會產生不利的影響[30]。Fe2+、Fe3+、Mg2+、5 mmol/L Al3+、5 mmol/L Zn2+對馬鈴薯酯酰基水解酶的活性有促進作用,可能是因為這些金屬離子能與Patatin的特定部位結合,改變了酶催化反應平衡性質和馬鈴薯酯酰基水解酶的表面電荷。K+、Ca2+抑制了馬鈴薯酯酰基水解酶的活性,可能是由于這兩種金屬離子使Patatin活性中心的空間結構發生改變,降低了其分解底物的能力[31]。10 mmol/L Zn2+降低了馬鈴薯酯酰基水解酶的活性,可能是由于過量的Zn2+與Patatain活性中心發生了相互作用,并且與活性中心的金屬離子發生了置換反應,生成了新的配位化合物,從而影響了馬鈴薯酯類酰基水解酶對底物的分解[32]。

圖7 金屬離子對馬鈴薯酯酰基水解酶活性的影響
3 結論
試驗從模擬生產廢水中提取分離馬鈴薯粗蛋白,對影響馬鈴薯酯酰基水解酶活性的因素進行研究。結果表明,馬鈴薯酯酰基水解酶在37 ℃時具有較高的活性,且在pH為8.2的條件中維持水解反應10 min時,水解活性較高;馬鈴薯酯酰基水解酶在40~50 ℃時具有一定的熱穩定性,溫度高于60 ℃以后,酶的活性開始陸續出現較大的損失;外源添加的不同金屬離子對馬鈴薯酯酰基水解酶表現出不同的影響,例如K+和Ca2+對馬鈴薯酯酰基具有水解抑制作用,低濃度的Al3+和Zn2+促進了馬鈴薯酯酰基水解酶的水解作用,相反地,高濃度的Al3+和Zn2+對馬鈴薯酯酰基水解酶具有活性抑制作用。試驗選取了單分散態脂肪對硝基苯乙酸酯為底物,探討了不同酶反應條件對馬鈴薯酯酰基水解酶活性的影響。今后,可以從其他不同脂肪底物種類(單酰基或二酰基磷酸脂肪、單酰甘油、二酰甘油、半乳糖脂肪)入手,探討不同酶反應條件對馬鈴薯酯酰基水解酶活性的影響,同時分析酶催化反應的動力學及熱力學特征,為馬鈴薯酯酰基水解酶的深度研究和工業化應用提供更有力的理論依據。

