遠隔缺血適應治療對腦卒中復發預防作用
王心穎 丁文婷 高倩 魏琰 崔永健 王曉莉
(哈勵遜國際和平醫院神經內二科,河北 衡水 053000)
缺血性腦卒中是世界范圍內致死和致殘的主要原因〔1,2〕,而導致缺血性腦卒中的關鍵是腦供血動脈狹窄。據文獻報道,未經治療的顱內動脈狹窄患者年腦卒中率可達8%~10%〔3〕,而即使在內科治療的基礎上,顱內動脈狹窄的年復發率仍可達10%~12%。目前,以血管重建為目的的外科手段有頸動脈內膜剝脫術(CEA)及頸動脈支架置入術(CAS),兩者均作用于頸內動脈,近年開展的大腦中動脈支架置入術及基底動脈支架置入術因其風險高、技術要求高很難被廣泛接受。相較而下最有效的內科手段是超早期靜脈溶栓,但也因時間窗嚴格限制而獲益較少。并且上述手段都可能面臨嚴重的缺血再灌注損傷(IRI)。在缺血腦組織恢復血供及血管再通后挽救瀕死神經元的過程中,身體會產生快速級聯的反應對神經細胞造成損傷,最終導致神經元的凋亡及壞死〔4〕。所以尋求安全有效的內源性治療是目前的研究熱點。遠隔缺血后適應(RIPostC)指在重要器官遭受缺血損害后對遠端非重要器官的短暫快速重復的缺血刺激,多項研究〔5~7〕已證實RIPostC可顯著降低缺血再灌注風險,對缺血腦組織起到神經保護作用。本研究旨在探討RIPostic治療對缺血性腦卒中患者復發預防及神經保護作用。
1 對象與方法
1.1研究對象 2016年1月至2017年6月就診于哈勵遜國際和平醫院神經內科且符合以下納入及排除標準的缺血性腦卒中患者200例,均告知試驗內容并自愿簽署知情同意書。納入標準:①年齡40~80歲、性別不限;②符合缺血性腦卒中和短暫性腦缺血發作(TIA)診斷標準〔8〕,并行頭顱CT或頭顱磁共振成像(MRI)確診;③缺血性腦梗死或TIA發病30 d內;④有癥狀性顱內責任動脈粥樣硬化性狹窄,且狹窄程度為50%~90%。排除標準:①受試前接受溶栓治療者;②受試前神經系統癥狀加重者;③患有嚴重高血壓、心臟病者;④非動脈粥樣硬化所致顱內責任動脈狹窄;⑤肝腎功能明顯異常者;⑥既往顱內或內臟出血或有出血傾向者;⑦預施壓肢體已有病變者;⑧試驗期間預計接受血管成形術治療者;⑨預期壽命<3年或依從性較差者。隨機分為試驗組與對照組各100例,其中試驗組男69例,女31例,平均年齡(61.33±9.21)歲,對照組男65例,女35例,平均年齡(62.15 8.32)歲。兩組在年齡、性別無顯著差異(P>0.05)。
1.2試驗處理 兩組嚴格按照2014年美國腦卒中與TIA二級預防指南〔9〕控制潛在危險因素,同時所有患者不限制伴隨疾病的常規用藥及治療(如抗血小板藥物、降脂穩斑藥物及胰島素注射等)。在此基礎上,試驗組給予遠端肢體循環加壓缺血處理,具體方法為:患者端坐,將加壓袖套固定在雙側上臂,加壓至200 mmHg,每次持續5 min,泄壓5 min,循環5回,以達到遠端肢體缺血復流效果,每日1次,持續12個月。每3個月隨訪一次,了解患者一般狀況,對治療安全性評估。
1.3觀測指標
1.3.1臨床評價 本試驗給予試驗組患者連續12個月雙上肢反復加壓缺血刺激,不干預所有患者的基礎治療。每3個月對所有參與者進行隨訪,統計患者復發情況,并進行改良Rankin量表(mRS)Barthel指數評價患者神經功能恢復情況。
1.3.2影像學檢查 兩組患者在入組前及12個月時行經顱多普勒超聲(TCD)檢查,經TCD采用德國DWL公司生產的TCD儀,由1名具有2年以上操作經驗的醫師,根據操作規范及指南〔10〕檢測顱內各血管。特別說明大腦中動脈檢測,取2 MHz脈沖多普勒探頭,經顳窗/眼窗探測深度為45~65 mm,選擇最佳信號測量(MCA)的收縮期峰值血流速度(Vs)、平均血流速度(Vm)、患側搏動指數(PI)及健側搏動指數(PIo)。大腦中動脈狹窄>50%的TCD診斷標準為MCA收縮期Vs大于160 cm/s,Vm大于100 cm/s〔10〕,并根據局部腦血流喪失指數(rCBFLI)公式〔11〕計算rCBFLI=(1-PI÷PIo)×100%。
1.3.3實驗室化驗 所有受試者入組前及12個月復查留取晨間空腹靜脈血標本4 ml,室溫放置2 h后1 000 r/min離心20 min,提取血清,于-80℃冰箱儲存待檢。利用Beckman DXI800 自動化學發光免疫分析儀,嚴格按照說明書,采用酶聯免疫吸附試驗(ELISA)進行血清血管內皮生長因子(VEGF)檢測。試劑盒購自美國R&D公司。
1.4統計學方法 采用SPSS17.0軟件行t、χ2檢驗。
2 結 果
2.1臨床評價 在試驗期間,試驗組8例復發,對照組15例復發,試驗組復發率較對照組顯著降低(P<0.05)。治療前兩組患者mRS評分及BI比較差異無統計學意義(P>0.05)。治療后,兩組mRS評分明顯降低,BI明顯升高,且試驗組較對照組mRS顯著降低及BI顯著升高。見表1。
2.2影像學檢查 試驗組中患側大腦中動脈狹窄患者69例,對照組中大腦中動脈狹窄患者65例。其中試驗組男39例,女30例,平均年齡(60.5±4.51)歲,對照組男34例,女31例,平均年齡(61.42±5.37)歲,兩組性別、年齡差異均無統計學意義(P>0.05)。兩組治療前rCBFLI無顯著差異,經12個月遠端肢體缺血后適應治療后試驗組rCBFLI較治療前明顯降低,且較對照組顯著降低(P<0.05)。見表2。
2.3實驗室化驗 兩組治療前VEGF水平無顯著差異,治療后兩組患者VEGF均上升,試驗組明顯高于對照組(P<0.05)。見表3。

表1 兩組治療前后mRS評分和BI比較
與治療前比較:1)P<0.05,表3同
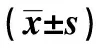
表2 治療前后兩組rCBFLI比較

表3 兩組治療前后VEGF水平的比較
3 討 論
缺血后適應(IPostC)是相對于缺血預適應(IPC)而言的,兩者均被認為是保護機體應對缺血事件的強有力的內源性方法。1986年,Murry等〔12〕發現犬心臟冠脈短暫結扎后可顯著減少隨后長時間缺血引發心肌能量耗竭,從而首次提出來“IPC”的概念。2003年,Zhao等〔13〕發現于缺血再灌注開始時給予缺血刺激同樣可以減輕IRI,從而提出“IPostC”。但以上都不能直接用于重要器官如心臟及腦。2005年Kerendi等〔14〕發現對腎動脈的缺血刺激可以減輕心肌的缺血再灌注損傷,由此提出了“RIPostC”的概念。這種對生命重要器官的保護對于臨床治療意義重大。本試驗通過對遠隔肢體的缺血再灌注刺激,觀察其對神經中樞的保護作用,并探討其可能機制。
本研究結果提示RIPostc治療對腦卒中復發具有明顯的預防作用。mRS是衡量腦卒中患者神經功能恢復狀況的評分,其分值越低,代表神經功能恢復越好。BI用于評價患者日常生活自理能力,其評分越高,代表日常生活自理能力越強。本研究結果說明肢體遠隔缺血后處理能有效改善患者神經功能損傷,提高患者生活質量。
TCD檢測技術由挪威神經外科學家Rune Aaslid于1982年創建,是將多普勒效應與低頻脈沖超聲波結合起來,通過測定腦血流速度、阻力指數等指標,綜合分析顱內主要大血管血流動力學指標的檢查技術。自創建始諸多研究〔15~18〕肯定了TCD在診斷顱內動脈狹窄及判斷狹窄的嚴重程度的作用。吳鋼等〔11〕利用血管搏動指數推導出 rCBFLI計算公式,并發現此公式不僅在數理邏輯上合理,而且與99mTc ECD SPECT的相對腦血流量喪失的測量值有良好的相關性〔19〕,遂推薦rCBFLI作為評估顱內某支動脈狹窄后該動脈供血區局部腦血流量下降程度的指標之一。何潔等〔20〕使用SPECT觀察遠隔缺血預適應治療患者側支循環與腦缺血關系發現丘腦血流灌注變化與側支代償有關,無側支代償患者治療后丘腦對缺血產生顯著耐受性,有側支代償者則變化不明顯。本試驗結果考慮與肢體遠端反復缺血再灌注刺激患側大腦中動脈側支循環有關。
盡管RIPostc對腦保護作用的機制仍不清楚,但一般認為涉及3個環節:遠隔部位保護介質觸發,傳達至靶器官和引發神經保護效應,此前研究確定了可能涉及的2個機制:神經機制及體液機制〔21〕。神經機制中,遠隔器官(肢體)因缺血適應產生內源性物質,激活傳入神經通路,進而激活傳出神經通路,作用于靶器官(腦)〔22〕。體液機制中,遠隔器官(肢體)因缺血適應產生體液介質,釋放入血,與靶器官(腦)的受體結合,觸發細胞內信號通路,產生保護作用〔22〕。主要的信號通路有n-甲基-d-天冬氨酸(NMDA) 的活化、調節蛋白激酶細胞信號轉導途徑(如絲裂原活化蛋白激酶(MAPK) 和 Akt 及蛋白激酶(PK)C 途徑)、脂筏與質膜微囊信號調節及轉錄因子的激活。研究〔23,24〕發現,缺血適應處理可以激活缺血誘導因子(HIF),其HIFα在缺氧環境下不能降解,繼而積累并反式激活下游百余種基因,包括編碼VEGF的基因。本試驗發現試驗組經肢體缺血后處理VEGF水平較對照組明顯升高,考慮VEGF可能參與遠隔肢體缺血后處理神經保護機制,介導新生血管生成,進而提高大腦對缺血缺氧耐受。此假設有待進一步研究。
綜上,遠端肢體IPostC治療可有效預防缺血性卒中復發,提高腦缺氧耐受,具有神經保護作用。由于一些患者在隨機化后排除在外,有必要進一步擴大研究樣本;另外雖遠端肢體IPostC治療可運用于臨床,但持續時間、施壓范圍、循環次數等對療效影響仍有待進一步研究。

