血清OxA、Aβ1~42對缺血性腦卒中后認知障礙的影響及診斷的預測價值
張填 陳薪旭 邢夢蕓 王埮
(海南醫學院第一附屬醫院神經內科一病區,海南 海口 570102)
腦卒中后認知障礙(PSCI)是腦卒中事件引起的認知障礙及腦退行性病變(如阿爾茨海默病等)在腦卒中后進展引起的認知障礙〔1〕。PSCI發病率高,不僅增加患者病死率、加重患者功能殘疾,而且嚴重影響腦卒中患者的日常生活能力和社會功能,加重患者家庭及照料者的負擔。PSCI發病機制較為復雜,尚未十分明確。有效的血液生物學標志物對PSCI的臨床診斷、治療及預后具有重要意義。食欲素(Ox)〔2〕是一種由下丘腦外側區、背內側區及穹隆區神經元合成和分泌為主的具有調節機體攝食及能量平衡作用的小分子神經多肽,包括OxA和OxB。OxA為脂溶性,可以通過血腦屏障,其在組織或血液中的含量顯著高于OxB,而OxB在血液中很快被降解,不能被完整發現并檢測到。Ox參與調節多種生理機制,如飲食與能量代謝、睡眠與覺醒、炎癥反應、血壓調節、學習與記憶、腫瘤細胞凋亡等。β淀粉樣蛋白(Aβ)可刺激血小板聚集,在體內觸發血栓形成,在動脈粥樣硬化血栓形成和腦淀粉樣血管病的發病機制中起重要作用〔3〕。由單側頸動脈狹窄引起的人局灶性腦缺血可引起腦內Aβ積累增加,這提示缺血性腦卒中與阿爾茨海默病相關淀粉樣蛋白之間存在聯系〔4〕。國外一項通過比較五種神經退行性疾病中Aβ沉積物的空間模式研究發現,Aβ沉積物都聚集在一起,并且在一定比例的大腦區域中,這表明通過神經解剖途徑傳播的Aβ可能是多種疾病的共同原因〔5〕。然而,上述指標對急性腦梗死(ACI)后認知功能的影響,目前鮮有報道。本研究旨在探討OxA、Aβ1~42與缺血性PSCI的關系,以期為臨床協助缺血性PSCI的早期診斷、早期治療、延緩其進展提供參考。
1 對象與方法
1.1研究對象 選取2017年4~12月于海南醫學院第一附屬醫院神經內科住院的ACI患者117例為研究對象,男77例,女40例,平均年齡(59.97±8.99)歲,平均受教育年限(9.25±3.21)年。全部病例符合中國急性缺血性腦卒中診治指南2014的診斷標準〔6〕,并經頭部計算機斷層掃描(CT)或磁共振成像(MRI)證實,發病72 h內就診,且能夠配合完成相關量表及神經系統檢查者。排除應用溶栓或微創治療者及死亡的患者,并排除嚴重的心、肝、腎疾病及感染者,排除腦梗死發病前即有認知障礙者,排除甲狀腺功能減退、意識障礙、嚴重失語、失用、視力及聽力障礙、嚴重神經功能缺損〔美國國立衛生研究院腦卒中量表(NIHSS)評分>10分〕等影響認知功能評估者,排除有嚴重焦慮或抑郁癥、有酒精、藥物濫用及嚴重精神疾病(如精神分裂癥、躁狂癥等)者。
1.2研究方法
1.2.1分組 ACI患者于發病90 d時完成蒙特利爾認知評估(MoCA)量表測評,按照MoCA量表評分標準分組,MoCA量表評分<22分,為腦梗死后認知障礙組(PSCI組)共30例,男19例,女11例,平均年齡(59.23±9.64)歲,平均受教育年限(7.10±3.20)年。MoCA量表評分≥22分,為腦梗死后認知功能正常組(非PSCI組)共87例,男58例,女29例,平均年齡(60.23±8.80)歲,平均受教育年限(9.98±2.88)年。兩組在性別、年齡、吸煙史、飲酒史、高血壓病史、糖尿病史、冠心病史、梗死部位(前、后循環)等方面比較差異均無統計學意義(P>0.05),但與非PSCI組比較,PSCI組受教育年限比較低(t=4.60,P=0.000)。
1.2.2神經心理學檢查及判斷標準 腦卒中后3個月,是認知功能評估的最佳時間〔7〕。在ACI患者發病90 d時,由同一位經過專門培訓的神經內科醫師進行MoCA測評,總分30分,包括視空間與執行功能5分、命名3分、記憶(不計分)、注意力6分、語言3分、抽象思維2分、延遲回憶5分、定向力6分等8個方面的內容。若受教育年限≤12年,總分加1 分。總分<22分為存在認知障礙〔8〕。
1.2.3實驗室指標檢測 所有觀察對象于入院后第2天清晨空腹采集肘靜脈血,采用酶聯免疫吸附試驗(ELISA)檢測血清OxA、Aβ1~42、磷酸化tau蛋白(P-tau)水平的表達,同時由我院檢驗科生化分析儀檢測一般生化項目,包括同型半胱氨酸(Hcy)、超敏C反應蛋白(hs-CRP)、尿酸(UA)、胱抑素C(Cys)-C、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)水平。
1.3統計方法 采用SPSS20.0統計軟件進行t檢驗、秩和檢驗及χ2檢驗。相關性分析采用Spearman相關分析。缺血性PSCI的危險因素分析采用Logistic回歸分析。
2 結 果
2.1血清學指標比較 與非PSCI組比較,PSCI組血清OxA、Aβ1~42水平明顯下降,而Hcy水平明顯升高,差異均有統計學意義(P<0.05)。見表1。
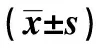
表1 PSCI組與非PSCI組血清學指標比較
2.2腦梗死發病90 d時MoCA量表評分與血清OxA及相關實驗室指標的相關性 經Spearman相關分析發現,腦梗死患者3個月后MoCA評分與OxA、Aβ1~42、入院時MoCA量表評分呈正相關(均P<0.05),而與Hcy呈負相關(P=0.033)。見表2。
2.3缺血性PSCI危險因素的Logistic回歸分析 導入可能影響缺血性PSCI的因素,經Logistic逐步回歸分析,最后篩選出4個主要的影響因素:教育年限、Aβ1~42、OxA及Hcy。見表3。

表2 腦梗死患者90 d后MoCA量表評分與血清OxA及相關實驗室指標的Spearman相關分析

表3 腦梗死危險因素的Logistic回歸分析
2.4受試者工作特征(ROC)曲線分析 以ACI發病90 d時MoCA量表評分結果作為診斷認知障礙的標準,繪制Aβ1~42、P-tau、OxA分別診斷缺血性PSCI的ROC曲線。結果顯示,三種指標診斷的最佳臨界值分別為70.89 pg/ml、214.33 pg/ml和445.62 pg/ml,其曲線下面積(AUC)分別為0.92、0.56和0.77,均大于0.50,其中指標Aβ1~42的AUC最高,其對缺血性PSCI的診斷準確性最高,它的敏感度和特異性分別為0.90和0.93,其次為OxA,它的敏感度和特異性分別為0.81和0.73,同樣對缺血性PSCI具有較高的診斷價值;而P-tau蛋白的診斷價值有限(敏感度0.30,特異性1.00,約登指數0.30)。聯合Aβ1~42、P-tau、OxA來預測MoCA量表標準下PSCI發生的敏感度和特異性分別為0.93和0.87,三種指標聯合作用ROC曲線的AUC高達0.92,約登指數為0.81,提示聯合檢測三種指標,對PSCI發生的預測具有很高的準確性。
3 討 論
OxA是最初在下丘腦中發現的一種神經肽,存在于周圍器官及中樞神經系統中,并參與食物攝入,能量穩態和心血管功能的調節。Ox神經元是調節重要身體功能的“多任務”神經元,這些功能包括睡眠/蘇醒狀態、進食行為、能量穩態、獎勵系統、認知和情緒〔9〕。研究發現,基底前腦是一種與注意力有關的結構,將OxA注入大鼠基底前腦后可減輕注意力分散〔10〕。Ox可增強海馬神經發生并改善空間學習和記憶能力及情緒,Ox缺乏會導致學習和記憶不足及抑郁〔11〕。本研究發現,OxA為影響缺血性PSCI的主要因素,與上述研究結論相符。
Aβ是由淀粉樣前體蛋白經過水解作用產生的多肽,可循環于血液、腦脊液和腦間質液中,最常見的亞型是Aβ1~40和Aβ1~42。其中,Aβ1~42的毒性更強,更易聚集。進行性Aβ沉積為阿爾茨海默病的主要特征,現已把腦脊液Aβ1~42與 P-tau等生物標志物納入其診斷標準中〔12〕;Aβ1~42不單與神經退行性變發生相關,而且與腦血管病關系十分密切。缺血和再灌注導致腦損傷后,Aβ水平升高,大腦中高水平Aβ的存在會增加神經炎癥反應和神經元損傷〔13,14〕。腦缺血再灌注損傷會以Aβ依賴性的方式在海馬和顳葉皮質誘發神經元損傷〔15〕。柯莉等〔16〕臨床研究發現,ACI患者組血漿Aβ1~42水平較健康對照組水平顯著增高,且血漿Aβ1~42水平隨腦梗死體積的增大及NIHSS評分的增加而升高。另有研究顯示〔17〕,低血清Aβ1~42濃度是缺血性PSCI的獨立危險因素,血清Aβ1~42水平與腦卒中后認知功能水平呈正相關。本研究發現,PSCI患者血清Aβ1~42水平明顯下降,且腦梗死患者3個月后MoCA評分與Aβ1~42呈正相關,Aβ1~42為影響缺血性PSCI的主要因素。考慮其原因為,ACI后Aβ水平升高,隨后在組織中沉積,導致神經元損傷及認知功能下降,而使血清中Aβ水平降低。且有研究證實,血腦屏障微血管周圍空間的Aβ沉積表明Aβ起源于血清〔18〕。
Tau蛋白是微管相關蛋白,與細胞有絲分裂、細胞內物質轉運等多種功能有關,正常情況下人腦中的Tau蛋白以磷酸化和去磷酸化兩種形式存在。過度磷酸化后Tau蛋白可影響微管形成及促進微管崩解,并形成各種沉積物在神經元細胞內,引起神經元損害,影響認知功能〔19〕。有研究發現,個體出現最早可檢測到的癡呆臨床癥狀時,至少在某些脆弱的大腦區域中會逐漸積累異常磷酸化的tau和神經元死亡〔20〕。
本研究顯示,Aβ1~42對缺血性PSCI的診斷準確性最高,其次為OxA,同樣對缺血性PSCI具有較高的診斷價值;而Tau蛋白的診斷價值有限。因有研究發現〔21〕,Ox信號過表達改變了睡眠-覺醒周期,并間接誘導Aβ的積累和tau介導的神經變性。Ox可以通過抑制小膠質細胞的吞噬作用和自噬通量來阻止Aβ的清除〔22〕。本研究根據結果推薦單獨檢測Aβ1~42來預測缺血性PSCI的診斷,既有較高的敏感度、特異性,又有較好的經濟效益。
盡管最近在腦缺血后Aβ的神經致病性研究方面取得了重要進展,但是尚不清楚由缺血后Aβ引起的不可逆神經變性再灌注的基本途徑及機制。未來的研究應該集中在防止與阿爾茨海默病特征蛋白及其基因相關的局部缺血后大腦中阿爾茨海默病神經病理學變化的發展〔5〕,這可能會導致缺血性發作后神經功能改善。

