苦酸通調方對HepG2細胞胰島素抵抗模型中脂代謝及AMPK、ACC、SREBP-1蛋白的影響
米佳 閆冠池 朱浩宇 王國強 王秀閣 李香艷
(1長春中醫藥大學附屬醫院,吉林 長春 130021;2長春中醫藥大學)
胰島素抵抗(IR)是糖耐量異常及2型糖尿病(T2DM)的重要發病機制,且貫穿于糖尿病(DM)的整個病程,因此改善IR是治療T2DM及減輕靶器官損害的重要策略〔1〕。據“國際糖尿病聯盟(IDF)糖尿病地圖”中流調顯示,中國DM患病人數達到1.144億,居全球首位〔2〕。肝臟是能量代謝的主要場所,同時是胰島素作用的重要效應器官,糖酵解、糖異生及脂質合成等過程是通過攝取葡萄糖及游離脂肪酸(FFA)而達到的,進而維持能量穩態。當肝臟儲能作用失衡,肝糖輸出增加,促使高胰島素血癥進一步加重,進而形成T2DM。AMP活化蛋白激酶(AMPK)是細胞內的能量感受器,通過絲氨酸/蘇氨酸殘基的磷酸化控制細胞的葡萄糖和脂質代謝。AMPK的激活影響脂質代謝中多個酶的表達及活性水平,并能影響轉錄因子表達,例如通過增強脂肪酸氧化,抑制脂質合成和抑制糖異生,是降低肝臟中脂質積累水平的重要步驟。
前期研究證實,苦酸通調方在臨床應用和動物實驗中具有改善糖代謝作用,其可通過改善胰島素受體底物-1/磷脂酰肌醇3-激酶/蛋白激酶B(IRS-1/PI3K/Akt)信號通路傳導,增加葡萄糖消耗,減少肝糖原合成,從而增強肝臟糖異生〔3,4〕。其中主要藥物黃連、丹參、大黃等具有增強胰島素敏感性、減輕炎癥反應等作用,可用于T2DM的治療〔5~7〕。還有研究顯示大黃黃連合劑能夠改善T2DM大鼠模型的糖代謝情況〔8〕。本實驗旨在已有的前期研究基礎上,進一步探討苦酸通調方對棕櫚酸聯合高糖誘導HepG2胰島素抵抗細胞胰島素抵抗狀態、脂質代謝及AMPK/ACC/SREBP-1的影響。
1 材料與方法
1.1材料
1.1.1細胞株 HepG2細胞人肝癌細胞株,購于中國科學院細胞庫。
1.1.2藥物及試劑 苦酸通調方(長春中醫藥大學附屬醫院藥房提供);二甲雙胍(HY-17471A,MCE公司);DMEM低糖培養基、胎牛血清(12100061、16140071,Gibco公司);細胞裂解液、噻唑藍(MTT)細胞增殖及細胞毒性檢測試劑盒(P0013、C0201,武漢碧云天生物公司);棕櫚酸(MB7088,大連美侖生物技術有限公司);油紅O染色試劑盒、三酰甘油(TG)檢測試劑盒、膽固醇檢測試劑盒(D027、A110、A111,南京建成生物工程研究所);兔抗人單克隆抗體AMPKα,單克隆抗體p-AMPK(Thr172),單克隆抗體乙酰輔酶A羥化酶(ACC),多克隆抗體p-ACC(Ser79)(美國Cell Signaling公司,批號分別為5832,50081,9272,9336);兔單克隆抗體SREBP-1(557036,美國BD公司);辣根過氧化物酶標記山羊抗兔多克隆抗體免疫球蛋白(Ig)G、辣根過氧化物酶標記山羊抗小鼠單克隆抗體IgG(BA1054、BA1050,武漢博士德生物工程有限公司);二喹啉甲酸(BCA)蛋白濃度測定試劑盒(A0216,碧云天生物技術研究所)。
1.1.3儀器 濕化型CO2恒溫培養箱(3111,Thermo);YZ-875超凈工作臺(江蘇蘇州凈化設備廠);低溫高速離心機(5804R,德國Eppendorf);DK-S2微型振蕩器(浙江金華實驗儀器廠);鼓風干燥箱(上海博迅醫療生物儀器公司);M200 PRO酶標儀(瑞士Tecan公司);電泳儀(美國Bio-Rad公司);濕轉系統(美國Bio-Rad公司);超低溫冰箱(900,美國Thermo Fisher);ECL發光儀(美國Protein Simple公司)。
1.2細胞培養 HepG2細胞培養在37℃,5%CO2濕化條件中,給予10%胎牛血清(FBS)、青霉素100 U/ml和鏈霉素100 μg/ml的低糖DMEM培養基培養,待細胞融合度約80%時進行傳代。各干預組加入無血清低糖DMEM培養基培養細胞24 h,使各組細胞生長同步化后再進行下一步實驗。
1.3MTT比色法檢測細胞活力 將MTT溶于磷酸鹽緩沖液(PBS)為5 mg/ml過濾除菌后備用,選擇細胞融合度約80%的HepG2細胞,胰酶消化后,以8 000個細胞/孔的密度接種于96孔板。細胞貼壁生長24 h,吸棄原培養基,加入不同的干預液100 μl,培養24 h,每孔加入MTT溶液10 μl,置細胞于培養箱內避光孵育4 h。震蕩混勻,490 nm處測定吸光度。以對照組細胞的存活率為100%計算不同組別細胞存活率。
1.4高糖聯合棕櫚酸孵育建立HepG2 IR模型 稱取9.165 mg棕櫚酸標準品溶于0.25 ml無水乙醇中,將溶解后的棕櫚酸加入11.88 ml高糖DMEM培養〔其中含有0.12 ml FBS,0.25 g牛血清白蛋白(BSA)〕,55℃水浴15 min,冷卻后過濾除菌即為3 mmol/L棕櫚酸溶液,造模時稀釋至0.25 mmol/L,孵育細胞24 h,建立HepG2 IR模型。
1.5分組及處理 正常組加入正常培養液,模型組及苦酸通調方低、中、高劑量組均加入造模液,孵育24 h,建立IR模型。吸棄培養液,正常組、模型組加入無血清DMEM培養液,苦酸通調方組加入藥物溶液(50、100、200 μg/ml),37℃、5%CO2培養箱內孵育24 h。
1.6細胞葡萄糖攝取量的檢測 分組干預處理后,吸棄培養液,PBS洗滌2次,每孔加入2 ml無糖DMEM培養液饑餓4 h,胰酶消化,收集細胞,加入含或不含100 nmol/L胰島素的2-NBDG處理,細胞培養箱內避光孵育30 min,吸棄上清,預冷PBS洗滌,1 000 r/min離心5 min,流式細胞儀檢測。
1.7三酰甘油含量檢測 HepG2培養于含10%FBS DMEM低糖培養液,以30 000個細胞/孔的密度接種于6孔板中,培養24 h后,將造模液作用于HepG2細胞24 h,苦酸通調方組孵育24 h,吸取上清,10 000 r/min,離心5 min,檢測上清中三酰甘油含量;收集細胞,1 000 r/min,離心5 min,留細胞沉淀;用PBS清洗3次,同1 000 r/min,離心5 min,棄上清液,留細胞沉淀。加入0.2 ml的PBS充分混勻,低溫條件下超聲(功率:200 W,超聲4 s,間隔2秒,重復5次),制備好的勻漿液測定蛋白濃度及三酰甘油含量。
1.8油紅O染色 細胞給予不同處理24 h后,吸棄原培養基,PBS洗滌。4%多聚甲醛固定。油紅O染液染色15 min,復染液染色5 s,水洗30 s,重復3次。
1.9Western印跡檢測AMPK,p-AMPK,ACC,p-ACC,SREBP-1蛋白水平 吸棄各處理組上清,預冷PBS沖洗2次,每孔加入預冷RIPA細胞裂解液,冰上裂解,刮取細胞,4℃下10 000 r/min離心10 min。BCA法測定細胞蛋白濃度。制備十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離膠(10%)和濃縮膠(5%)。上樣總蛋白40 μg,加入電泳緩沖液,電泳電壓及時間(濃縮膠為80 V,30 min;分離膠為100 V,1 h)。再將蛋白轉移至聚偏氟乙烯(PVDF)膜上(110 V,90 min)。5%BSA封閉1 h,加入相應一抗(1∶1 000),4℃搖床孵育過夜。TBST洗膜3次,辣根過氧化物酶標記的山羊抗兔或山羊抗小鼠第二抗體(1∶5 000),室溫孵育1 h。洗膜5次后,電化學發光(ECL)顯色,拍照。
1.10統計學處理 采用SPSS22.0軟件進行單因素方差分析及t檢驗。
2 結 果
2.1對HepG2細胞葡萄糖攝取量的影響 與正常組〔(1.00±0.02)mmol/L〕比較,模型組細胞的葡萄糖攝取量明顯下降〔(0.63±0.02)mmol/L,P<0.05〕;與模型組相比,苦酸通調方高劑量組、陽性對照組顯著增多HepG2 IR細胞葡萄糖攝取量〔(0.84±0.05)mmol/L,(0.93±0.02)mmol/L,P<0.05〕,且增加細胞葡萄糖攝取量的效果呈劑量依賴性。苦酸通調方低、中劑量組攝取量為〔(0.66±0.03)mmol/L,(0.72±0.03)mmol/L〕與模型組無差異(P>0.05)。
2.2油紅O染色 造模液作用后細胞內脂滴明顯增多,隨著苦酸通調方濃度的增加,細胞脂滴逐漸減少。見圖1。
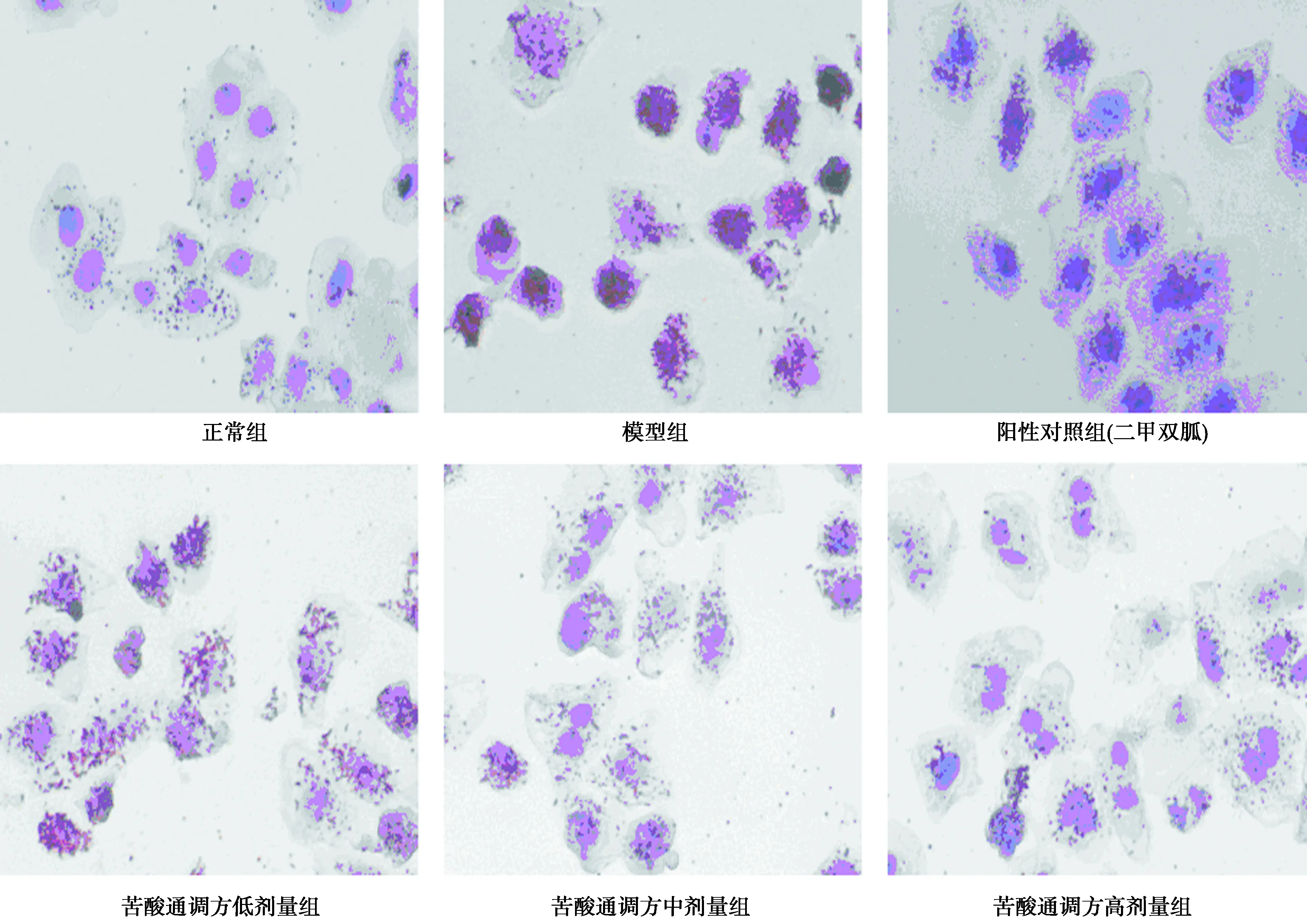
圖1 苦酸通調方對HepG2 IR脂類物質積累情況的影響(油紅O染色,×40)
2.3對HepG2 IR細胞內TG含量的影響 與正常組細胞中TG的含量〔(0.07±0.02)mg/g〕相比,模型組細胞中的含量均明顯增加〔(0.27±0.05)mg/g,P<0.05〕;與模型組相比,苦酸通調方各劑量組的細胞中TG的含量均有所降低,且降低效果呈劑量依賴性〔低劑量組(0.23±0.07)mg/g、中劑量組(0.21±0.03)mg/g、高劑量組(0.20±0.02)mg/g〕。其中中、高劑量組、陽性對照組(二甲雙胍)〔(0.210±0.02)mg/g〕TG含量較模型組明顯降低(P<0.05)。
2.4HepG2細胞AMPK,p-AMPK,ACC,p-ACC,SREBP-1的蛋白表達的影響 與正常組比較,模型組p-AMPKα,p-ACC水平顯著降低,SREBP-1、ACC表達顯著增加(P<0.05),與模型組比較,陽性對照組、苦酸通調方中、高劑量組p-AMPKα明顯增加,苦酸通調方高劑量組、陽性對照組p-ACC水平表達明顯增加,陽性對照組、苦酸通調方各劑量組SREBP-1表達顯著降低,陽性對照組、苦酸通調方中、高劑量組ACC表達顯著降低(均P<0.05)。見圖2,表1。
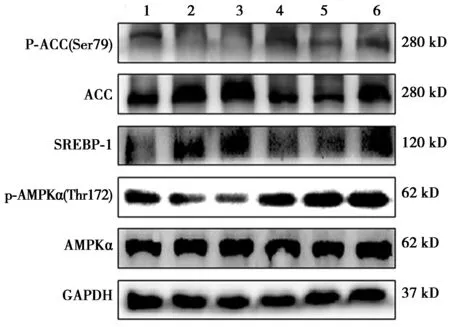
1~6:正常組、模型組、苦酸通調方低劑量組、苦酸通調方中劑量組、苦酸通調方高劑量組、陽性對照組圖2 各組HepG2 IR細胞中AMPK,p-AMPK,ACC,p-ACC,SREBP-1蛋白表達
表1 苦酸通調方對HepG2細胞中p-AMPK,ACC,p-ACC,SREBP-1蛋白表達
與正常組比較:1)P<0.05;與模型組比較:2)P<0.05
3 討 論
中醫認為T2DM屬“消渴”“脾癉”范疇,苦酸通調方依據六郁和絡滯病機,確立“苦酸制甜”、“辛開苦降”、“活血通絡”、“解毒通絡”為基本治法,選用丹參、黃連、黃芪、知母、天花粉、制紅曲、肉桂、烏梅、生地、酒大黃組成本方。諸藥辛苦酸并用,寒溫相佐,達到了苦酸制甜,辛開苦降,通達絡脈之功。
脂代謝紊亂是胰島素抵抗發生的始動因素。TG是人體主要供能脂類之一,肝臟及脂肪在胰島素的刺激下可進行TG的合成。TG合成增加、異常累積為肝細胞胰島素抵抗的重要病理改變之一。FFA增加使TG在脂肪、肌肉和肝臟中過度累積,超過各組織的儲存及代謝能力,最終引起IR。肝臟是脂肪酸代謝的主要場所,通過進行糖異生、脂肪酸合成及分解等過程調節脂代謝。肝細胞攝取FFA主要通過兩種途徑進行代謝,一是合成膽固醇、TG和磷脂等,二是進入線粒體進行氧化供能。肝臟脂質合成增加是IR脂質代謝紊亂的關鍵環節〔9〕。AMPK是細胞能量感受器,調節細胞脂代謝及胰島素信號傳遞,活化的AMPK抑制脂質合成進程的相關基因,如:SREBP-1。SREBP1是調節TG合成的重要轉錄因子,調節大多數涉及脂質合成過程中的必要基因的表達,肝臟中的SREBP-1表達增加,轉錄活性升高,上調脂質合成相關基因(如ACC)的表達〔10〕。同時SREBP-1c介導胰島素對脂肪生成基因的誘導,在葡萄糖刺激下,SREBP-1c和ChREBP協同誘導糖酵解和脂肪合成mRNA表達〔11〕。此外SREBP-1負調控肝細胞內IRS-1/PI3K/Akt途徑為主的胰島素信號傳導通路,減少肝糖原合成。同時增加葡萄糖轉化為脂質,促進IR的形成。因此,抑制肝臟SREBP-1的表達不僅可以減少脂質的合成,同時能夠改善IRS-1/PI3K/Akt的信號傳導,有效的抑制肝臟IR〔12,13〕。ACC是脂肪酸合成的第一個限速酶,包含ACC1和ACC2亞型,ACC1可催化脂肪酸合成,ACC2能夠抑制脂肪酸的氧化分解。激活AMPK可促進ACC1磷酸化,從而抑制ACC的活性及脂質合成,增加脂肪酸氧化〔14〕。前期預實驗提示苦酸通調方50、100、200 μg/ml的濃度對IR HepG2細胞的細胞活性無明顯抑制作用。在本研究中,苦酸通調方作用HepG2 IR細胞后,糖攝取能力明顯增加,AMPK,ACC磷酸水平增加,SREBP-1,ACC蛋白表達減少。據此,提出假說,苦酸通調方調節胰島素抵抗模型HepG2細胞脂質代謝可能是通過調節AMPK、ACC、SREBP-1通路實現的。

