酸、鎘脅迫對金絲草種子萌發、幼苗生長及亞顯微結構的影響
趙雅曼,陳順鈺,李宗勛,李啟艷,侯曉龍,2,3*,蔡麗平,2,3
(1.福建農林大學林學院,福建 福州 350002;2.海峽兩岸紅壤區水土保持協同創新中心,福建 福州 350002;3.南方紅壤區水土保持國家林業和草原局重點實驗室,福建 福州 350002)
土壤酸化和重金屬污染是社會和人民群眾關注的主要環境問題之一,而一些金屬礦開采廢棄地土壤酸化和重金屬污染往往同時存在[1-4]。不論土壤酸化還是重金屬污染均會導致土壤結構變差、肥力降低,影響作物、林木等植物的生長發育,甚至導致其枯萎、死亡,同時也嚴重威脅到人類的身體健康,因此,土壤酸化和重金屬污染的治理成為當前亟須解決的重大課題[5]。植物修復不僅可以快速增加植被覆蓋,而且可以改良土壤,減少土壤污染,相比物理化學治理方法具有生態環保、經濟實用等優點,受到人們的普遍青睞[6]。
植物修復的前提是富集和耐性植物的篩選,在此方面國內外學者做了大量研究,篩選出了不少適合酸性土壤或重金屬污染廢棄地應用的植物[7-9]。金絲草(Pogonatherumcrinitum)是從鉛鋅(Pb,Zn)礦區篩選出的一種Pb超富集植物,可以在土壤Pb含量小于20000 mg·kg-1的環境中正常生長,對Pb有強的耐性和富集能力[10]。金絲草為多年生草本植物,具有耐貧瘠、生長速度快、分布范圍廣等特點,在土壤Pb污染植物修復上有廣泛的應用前景[11]。
種子萌發是植物生長的初始階段,也是最關鍵和最脆弱的環節,容易受到病害、機械損傷和環境脅迫的影響,是進行抗逆性研究的重要時期之一[12]。低Pb濃度(50 mg·L-1)對金絲草種子萌發有一定促進作用,Pb脅迫對金絲草根長和芽長無顯著影響[13]。金絲草生長的鉛鋅礦區土壤除了鉛污染嚴重外,同時還存在土壤酸化和鎘污染的問題[14],但是,金絲草是否對酸和鎘脅迫具有一些特殊的響應策略尚不清楚。
鑒于此,以超富集植物金絲草種子為試驗材料,設計不同pH(5.5、4.5、3.5)和Cd2+濃度(5、10、20 mg·L-1)的脅迫試驗,在人工氣候培養箱中開展金絲草種子對酸和鎘脅迫的響應研究,測定不同酸和鎘脅迫條件下金絲草種子萌發、幼苗生長、生物量、質膜完整性和細胞超微結構等指標,揭示金絲草種子萌發對酸和鎘脅迫的響應,分析金絲草幼苗生長、生物量分配、質膜變化、細胞結構對酸和鎘脅迫的響應策略,以期為植物修復復合土壤污染技術提供更多的科學依據。
1 材料與方法
1.1 試驗設計
試驗所用金絲草種子于2017年夏采自福建尤溪鉛鋅礦區的金絲草植株,種子采集后存于4 ℃冰箱。將采集的金絲草種子置于0.3%的高錳酸鉀溶液中,室溫條件下浸泡30 min后用純水沖洗數遍,然后置于純水中浸泡24 h。試驗中酸和Cd脅迫溶液分別采用分析純試劑CH3COOH和Cd(CH3CO2)2配制,試驗處理分別為pH 5.5、4.5、3.5和Cd 5、10、20 mg·L-1,同時采用pH值為6.1的純水作為對照。2018年1月在LT-ACC400人工氣候箱中進行種子萌發試驗,培養條件為溫度25 ℃,空氣濕度75%,光照強度10000 Lx,晝/夜光照時間為(14/10) h·d-1[15]。試驗采用培養皿濾紙法進行,在9 cm培養皿中鋪放兩層濾紙并加入5 mL相應處理的脅迫液,選取50粒長勢飽滿、均一的種子于每個培養皿中,每個處理3個重復。試驗期間每48 h更換一次濾紙和脅迫液以保證脅迫環境的穩定,以胚根突破種皮1 mm為發芽標志,每24 h統計一次發芽數,以連續5 d萌發數一致為種子發芽結束的標志。試驗第4天統計發芽勢,第13 天統計發芽率。
1.2 測定指標
1.2.1種子萌發指標測定[15]
發芽率=(萌發種子數/種子總數)×100%
發芽勢=(發芽高峰期發芽的種子數/種子總數)×100%
發芽指數(germination index,GI)=∑(Gt/Dt)
活力指數(vigor index,VI)=GI×g
式中:Gt為在t時間內萌發數;Dt為相應的萌發天數;g為芽長度+根長度。
1.2.2胚根長、胚芽長和生物量的測定 萌發結束后,每盤選取20株長勢相似的幼苗,參考魯如坤[16]的方法測量其胚根長、胚芽長。并快速測量胚根和胚芽的鮮重,然后在105 ℃殺青30 min,80 ℃烘干至恒重后稱量其干重。
1.2.3萌發抑制指數[15]
抑制指數(restrain index,RI)=(對照指標值-處理指標值)/對照指標值
當RI<0,酸、Cd脅迫對種子萌發和幼苗生長起促進作用;當RI>0,酸、Cd脅迫對種子萌發和幼苗生長起抑制作用;當RI=0,酸、Cd脅迫對種子萌發和幼苗生長無明顯作用。
1.2.4測定質膜完整性和細胞相對活性 采用Evans blue染色的方法檢測金絲草幼苗根尖質膜完整性[17]。從各處理組中分別取長度為2 cm左右的金絲草幼苗根尖,在4 ℃冷處理pH 4.5的 0.5 mmol·L-1CaCl2溶液中浸泡5 min后純水洗凈吸干,在4 mL 伊文思藍溶液(0.025% 伊文思藍溶于pH 5.6 的100 μmol·L-1CaCl2溶液中)中浸泡30 min,洗凈吸干后在純水中浸泡15 min,在LEICA M205 FA全電動熒光立體顯微鏡下觀察拍照。
利用Image-J軟件對根尖照片進行處理,細胞相對活性計算公式如下[18]:
V=A/At×100%
式中:V為細胞相對活性,A為根尖非染色區域面積,At為全根尖面積。
1.2.5胚芽超顯微結構的測定 發芽試驗結束后,在各處理組中各選取長勢相似的3株幼苗,用4 ℃預冷的PBS(pH 7.4)溶液清洗1~2次,去除殘留的雜質,然后將樣品放入1 mL 2.5% 戊二醛溶液(用PBS配制)中,充分浸沒組織,在 4 ℃固定過夜后立即用干冰保存,送于上海秉新生物科技有限公司使用透射電子顯微鏡(Tecnai G2 Spirit)對金絲草胚芽組織進行檢測,并采用能譜儀(EDS)對胚芽組織選定區域(圖中紅色圓圈區域)進行掃描,對重金屬含量進行定性分析。
1.3 數據處理
采用Microsoft Excel 2013和SPSS 19.0對數據進行統計分析,使用單因素方差分析(One-way ANOVA)和Duncan’s法在0.05水平上對數據進行多重比較分析,圖表中數據以平均值±標準差表示,并用Origin 8.5作圖。
采用隸屬函數法對不同處理下的金絲草種子萌發和幼苗生長指標進行綜合評價[19],計算公式如下:如指標與抗逆性呈正相關時:
指標與抗逆性呈負相關時,則用反隸屬函數計算:
綜合隸屬函數值:
2 結果與分析
2.1 酸、鎘脅迫對金絲草種子萌發指標的影響
由表1可知,酸脅迫下金絲草種子的各萌發指標均隨pH的減小呈現先增后減的趨勢,但不同酸脅迫處理金絲草種子的發芽率均與對照無顯著差異(P>0.05);pH 5.5處理金絲草種子的發芽勢與對照無顯著差異(P>0.05),但發芽指數和活力指數均顯著大于對照(P<0.05);pH 3.5處理,金絲草種子的發芽勢、發芽指數和活力指數均顯著小于對照(P<0.05);隨Cd脅迫濃度的增大,金絲草種子的活力指數呈減小趨勢,且不同處理均顯著小于對照(P<0.05);Cd 5處理下金絲草種子發芽率、發芽勢和發芽指數均與對照無顯著差異(P>0.05),Cd 20處理下各萌發指標則均顯著小于對照(P<0.05)。
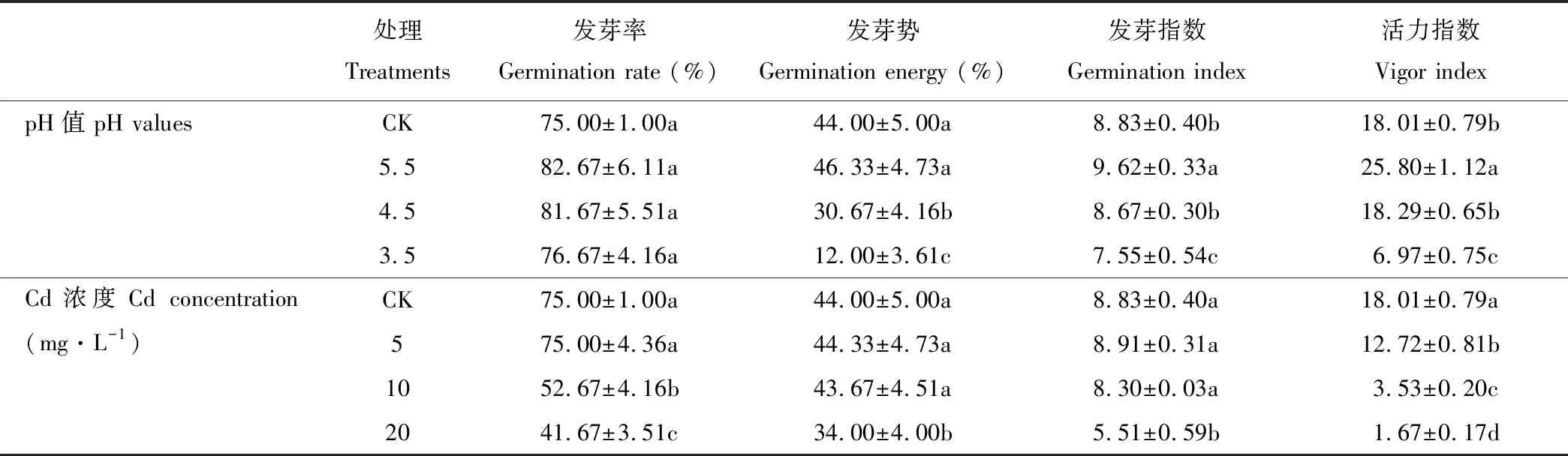
表1 不同酸、鎘脅迫下金絲草種子的萌發指標
注:同列不同小寫字母表示不同處理間差異顯著(P<0.05)。
Note: The different lowercase letters in the same column indicate significant differences among different treatments atP<0.05 levels.
2.2 酸、鎘脅迫對金絲草幼苗胚根長、胚芽長和根冠比的影響
由圖1可知,pH 5.5和4.5處理金絲草幼苗的胚根長和根冠比均與對照無顯著差異(P>0.05),pH 5.5處理顯著大于pH 4.5處理(P<0.05),pH 3.5處理的金絲草幼苗的胚根長和根冠比均顯著小于對照(P<0.05);酸脅迫對金絲草幼苗胚芽長無顯著影響(P>0.05);隨著Cd濃度的增大,金絲草幼苗胚根長、胚芽長和根冠比均呈減小趨勢,不同Cd脅迫處理金絲草幼苗的胚根長、根冠比均顯著小于對照(P<0.05),Cd 5處理的胚芽長與對照無顯著差異(P>0.05)。
2.3 酸、鎘脅迫對金絲草幼苗生物量的影響
由圖2可知,酸脅迫下金絲草幼苗胚根鮮重呈減小趨勢,且不同處理均顯著小于對照(P<0.05);pH 4.5處理下金絲草幼苗的胚芽鮮重顯著小于對照(P<0.05),其他處理則與對照無顯著差異(P>0.05);pH 3.5處理金絲草幼苗胚根干重顯著小于對照(P<0.05),胚芽干重則與對照無顯著差異(P>0.05),但顯著大于其他酸脅迫處理(P<0.05)。說明pH 3.5處理會抑制胚根干重,但會促進胚芽干重增加。 Cd脅迫條件下,金絲草幼苗的胚根重量呈減小趨勢,Cd 5處理下胚根鮮重、干重均顯著小于對照(P<0.05),胚芽鮮重、干重呈先增后減趨勢,Cd 5處理下均顯著大于對照(P<0.05);Cd 5處理下金絲草幼苗根系生物量受到抑制,但胚芽生物量則被促進;Cd 10和20處理下金絲草幼苗胚根和胚芽的生物量均顯著小于對照(P<0.05)。
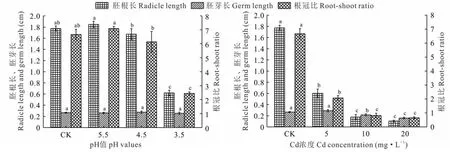
圖1 不同酸、鎘脅迫下金絲草幼苗胚根長、胚芽長和根冠比
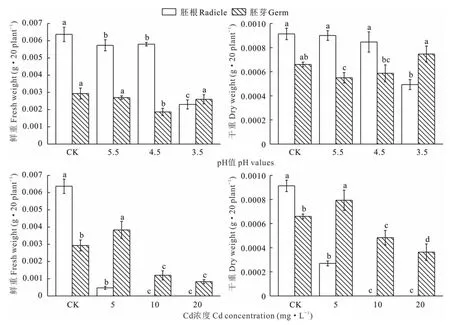
圖2 不同酸、鎘脅迫下金絲草幼苗胚根和胚芽鮮重、干重
2.4 酸、鎘脅迫對金絲草萌發指標和生長指標的抑制作用分析
由表2可知,酸脅迫可提高金絲草種子的發芽率,其中pH 5.5處理作用最明顯;pH 5.5處理對金絲草的各萌發指標均為促進作用,而pH 3.5處理則對除發芽率外的其他萌發指標均有抑制作用;除了pH 5.5處理的胚根長、pH 4.5處理的胚芽長和pH 3.5處理的胚芽干重外,金絲草各生長指標均受到抑制作用,其中,胚根干重隨pH值的減小受到的抑制作用逐漸增加,而胚芽干重則相反。
隨著Cd濃度的增加,金絲草種子萌發指標和幼苗生長指標受到的抑制作用均逐漸增強,Cd 5處理對金絲草的發芽勢、發芽指數、胚芽長、胚芽鮮重和胚芽干重具有一定促進作用,其他處理各指標均表現出抑制作用。
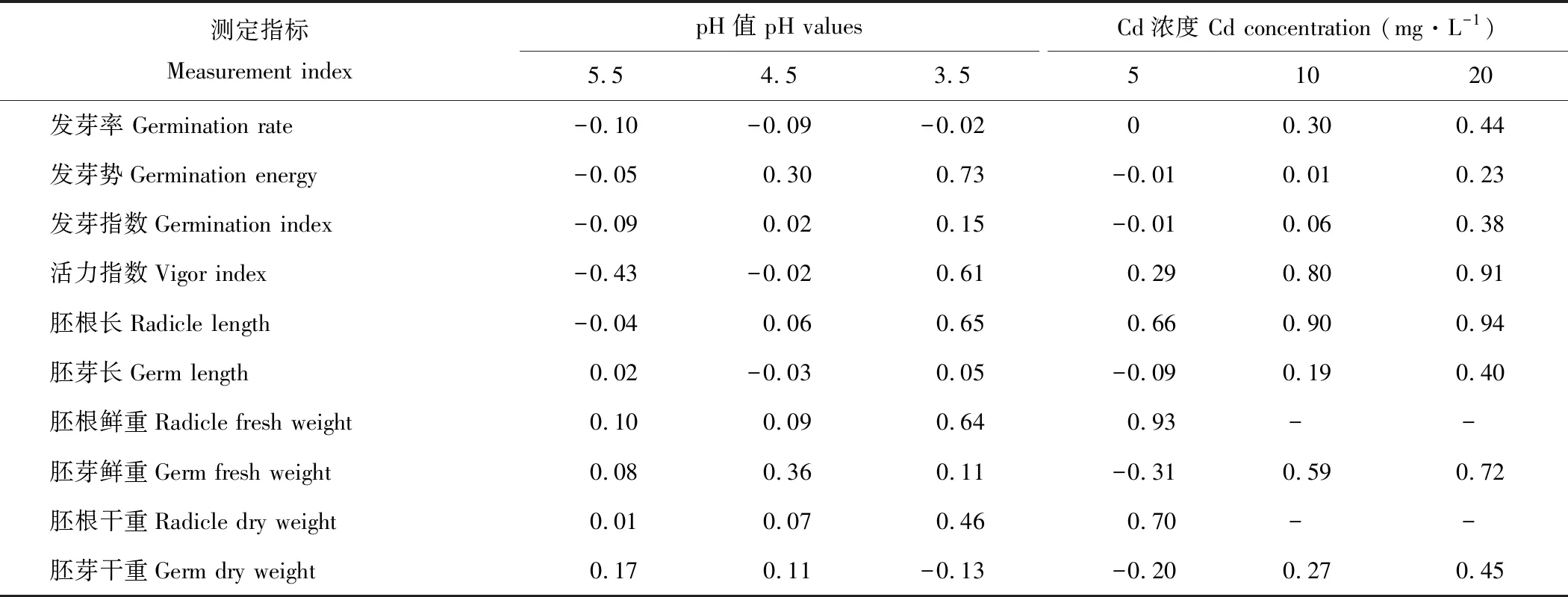
表2 酸、 鎘脅迫處理金絲草萌發指標和生長指標的抑制指數
2.5 酸、鎘脅迫對金絲草幼苗根尖質膜完整性的影響
由圖3可知,對照組根尖無明顯著色,隨著酸、Cd脅迫程度的增加,根尖著色逐漸加深,在pH 3.5和Cd 20處理下的根尖質膜受到嚴重損傷,染色最深(細胞相對活性僅為10%左右),說明根尖細胞膜的破損程度逐漸增加。
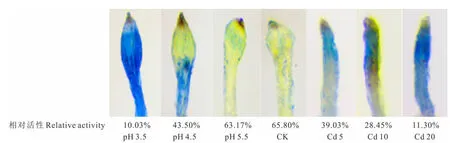
圖3 酸、鎘脅迫下金絲草幼苗根尖質膜完整性
2.6 酸、鎘脅迫下金絲草幼苗胚芽細胞亞顯微結構
2.6.1酸脅迫對金絲草幼苗胚芽細胞亞顯微結構的影響 由圖4可知,對照組金絲草胚芽細胞形態結構完整,細胞核核膜完整清晰,圓球形線粒體數量較多,內部管狀嵴分布均勻,清晰可見,葉綠體基粒和類囊體結構清晰,排列整齊(圖4-1,4-2)。pH 5.5處理下的部分胚芽細胞葉綠體外膜斷裂,產生髓樣結構(圖4-3,4-4)。pH 4.5處理部分葉綠體內膜破損,基粒出現彎曲變形,線粒體數量減少,管狀嵴密度降低(圖4-5,4-6)。pH 3.5處理下細胞膜斷裂,細胞核出現空泡化現象,部分葉綠體和線粒體等細胞器嚴重破裂,內部蛋白質和酶類等物質外流,細胞受損嚴重(圖4-7,4-8)。
2.6.2鎘脅迫對金絲草胚芽細胞亞顯微結構的影響 由圖5可知,相較于對照,Cd 5處理細胞出現明顯的質壁分離現象,葉綠體變形皺縮成近球形,外膜斷裂,基粒排列混亂,類囊體扭曲變形,細胞基質中開始出現大量黑色顆粒(圖5-9, 5-10)。Cd 10處理下細胞受損加劇,葉綠體內膜破裂,基質外流,部分細胞細胞器破損嚴重,開始出現細胞空泡化現象,并且同樣存在大量黑色顆粒(圖5-11, 5-12)。Cd 20處理下細胞核、線粒體、葉綠體和內質網等細胞器皆破裂消失,細胞空泡化現象加劇,細胞壁周圍沉積大量黑色顆粒(圖5-13, 5-14)。對Cd脅迫下的金絲草胚芽細胞進行能譜分析發現(圖6),胚芽細胞內均沉積了一定量的重金屬Cd,其峰值低于Cl,且均吸附于0.3~0.6 keV和2.5~4 keV位點間,證明了Cd是存在于細胞壁和細胞基質中的黑色顆粒物的主要成分之一。
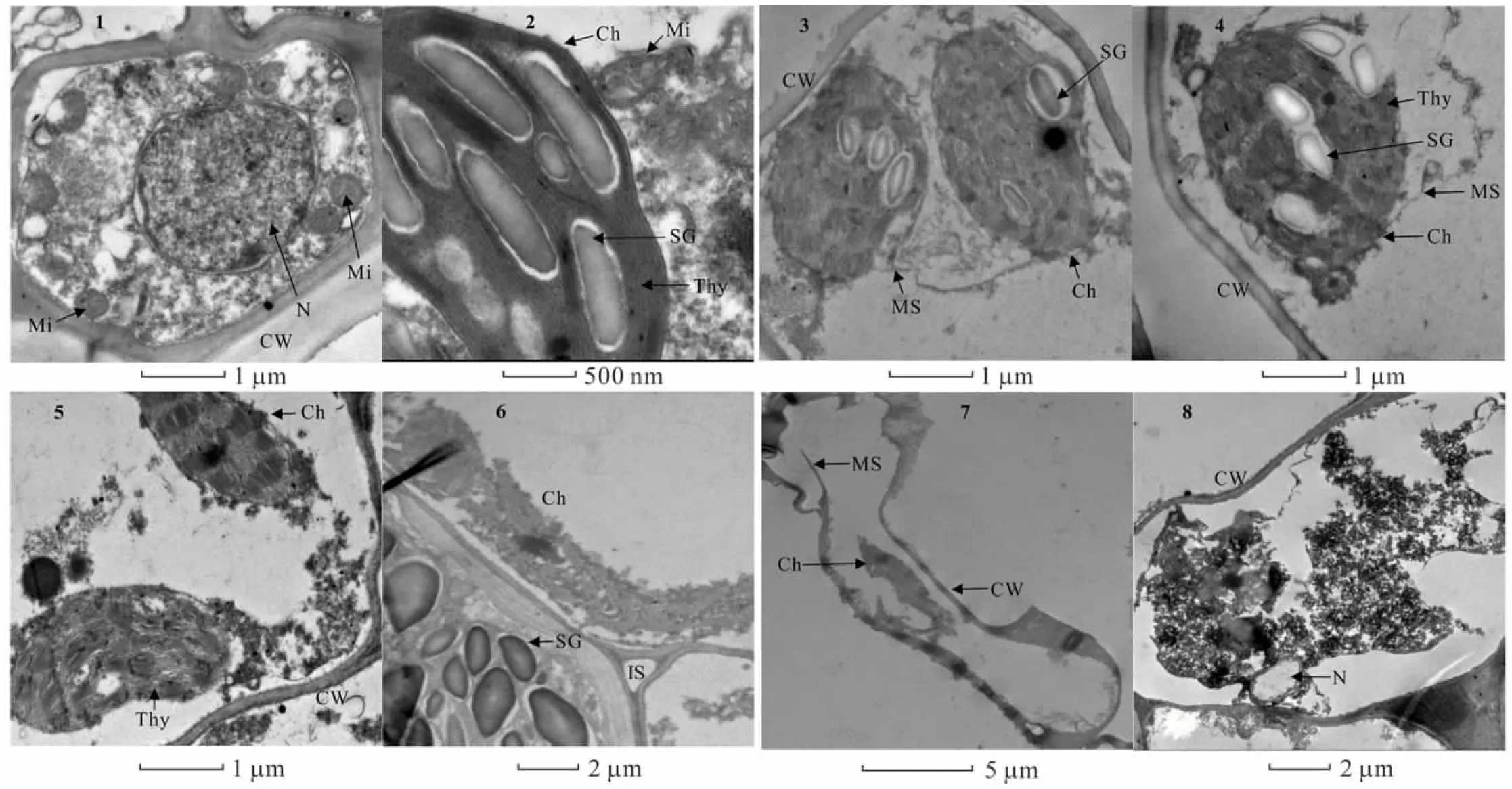
圖4 酸脅迫下金絲草幼苗胚芽細胞亞顯微結構
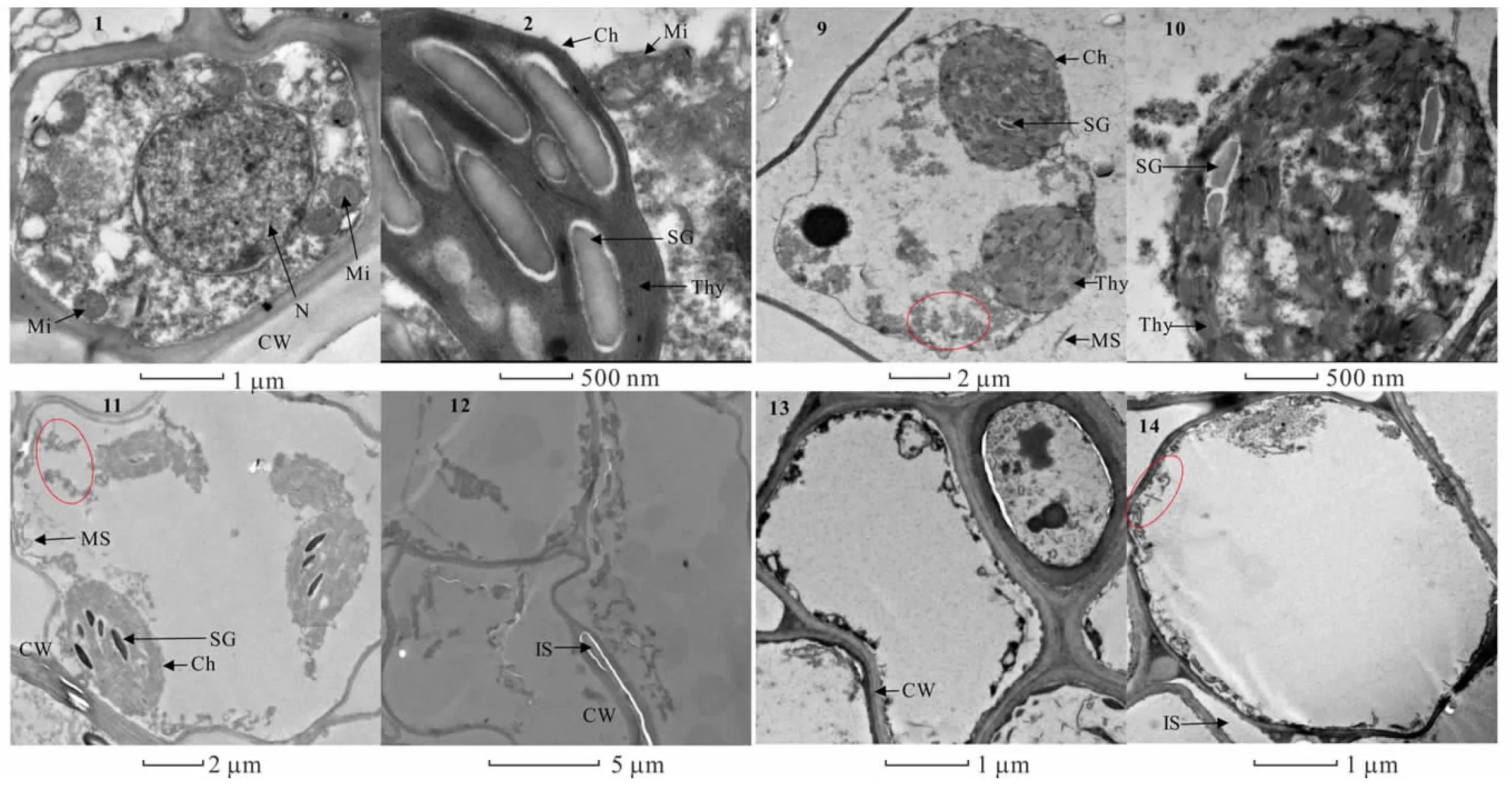
圖5 Cd脅迫下金絲草幼苗胚芽細胞亞顯微結構
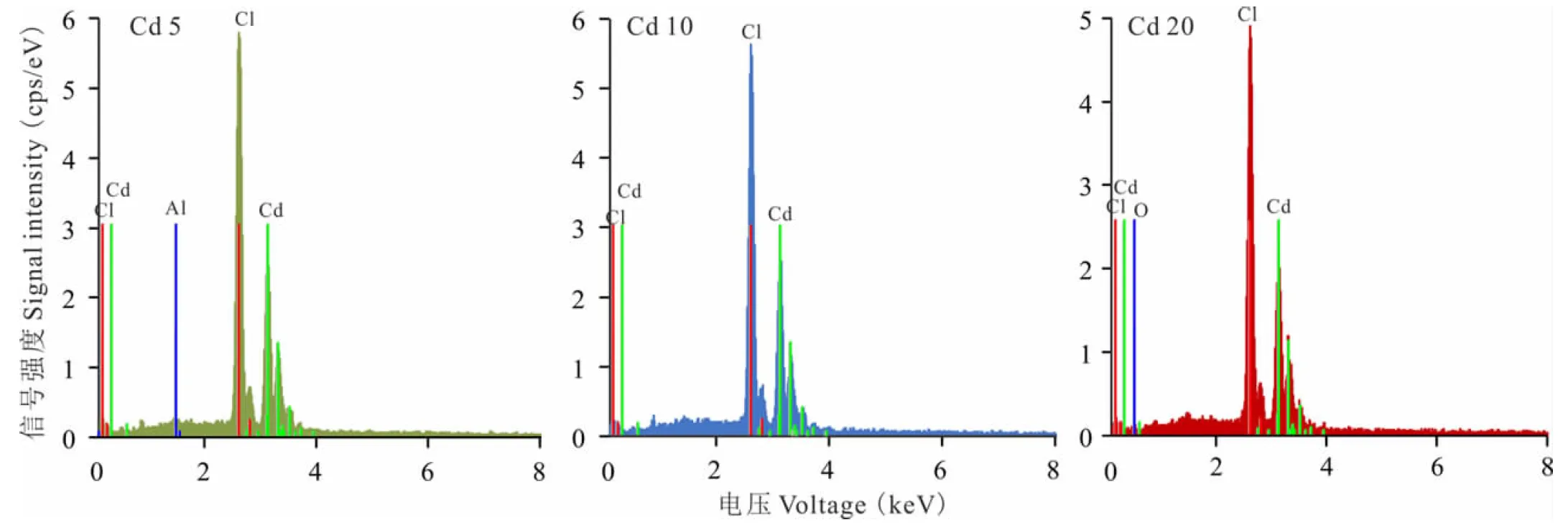
圖6 Cd脅迫下金絲草幼苗胚芽細胞能譜圖
2.7 金絲草種子萌發和幼苗生長對酸和鎘脅迫的耐性評價
2.7.1酸、鎘脅迫處理下金絲草各萌發和幼苗生長指標的相關性分析 由表3可知,各形態指標之間、指標和處理之間均存在不同程度的相關性,其中發芽率、發芽指數、芽長、芽干重和處理間均有顯著相關性(P<0.05),且發芽率和芽長與處理間為極顯著負相關(P<0.01);另外,發芽率和芽長呈極顯著正相關,活力指數和根長、根干重極顯著正相關,根長和根鮮重、根干重極顯著正相關(P<0.01)。而發芽勢與處理和其他各指標間均無顯著相關性(P>0.05)。發芽率和芽長可作為判斷金絲草耐酸和Cd脅迫程度的關鍵指標。

表3 酸、鎘處理下金絲草種子萌發和幼苗生長各形態指標之間的相關性
注:** 表示在 0.01 水平(雙側)上顯著相關,* 表示在 0.05 水平(雙側)上顯著相關。
Note: ** indicates significant correlation at 0.01 level (both sides), * indicates significant correlation at 0.05 level (both sides).
2.7.2酸、鎘脅迫下金絲草各形態指標的隸屬函數值 根據相關性分析的結果,運用隸屬函數法對有顯著相關性的萌發和生長指標進行綜合評價。由表4可知,不同處理下的金絲草萌發和幼苗生長指標的綜合隸屬函數值大小為pH 5.5>CK>pH 4.5>Cd 5>pH 3.5>Cd 10>Cd 20。酸、Cd脅迫下的綜合隸屬函數值均隨脅迫的增強而減小,且僅有pH 5.5處理的綜合隸屬函數值大于對照,是對照的1.034倍,說明弱酸處理有助于金絲草的種子萌發和幼苗生長;Cd處理的綜合隸屬函數值均小于對照,其中Cd 20處理對金絲草的種子萌發和幼苗生長的抑制作用最大。
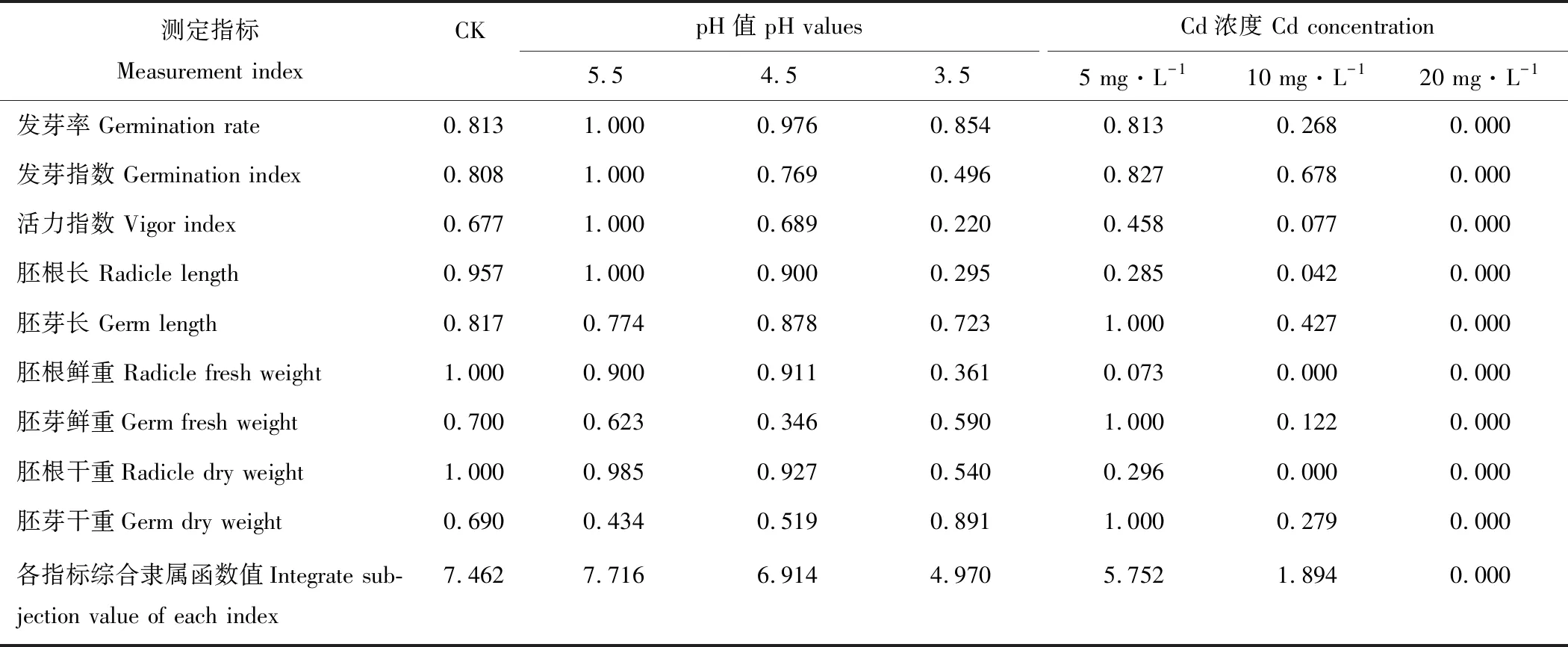
表4 不同酸和鎘脅迫下金絲草各萌發和生長指標的隸屬函數值
3 討論
逆境脅迫環境會對植物的生長發育產生一定的影響,本試驗采用不同pH和Cd溶液對金絲草種子進行脅迫處理,結果發現,酸處理均會促進種子的萌發,且脅迫下金絲草種子萌發指標呈先增后減趨勢,均在pH 5.5達到最大值, 呈現“低促高抑”現象;酸脅迫對萌發指標的抑制作用表現為pH 3.5>pH 4.5>pH 5.5。歐陽玲[20]研究發現白三葉(Trifoliumrepens)種子的萌發指標均隨酸度的增加(pH 7.0~2.0)呈先增加后減小趨勢,在pH 6.0達到萌發指標的最大值,本試驗研究結果與其一致。楊舒貽等[21]對強酸脅迫下大葉相思(Acaciaauriculiformis)幼苗的抗性生理機制進行研究發現,在pH值為3.0和2.0環境下,幼苗丙二醛(MDA)含量無顯著變化,且谷胱甘肽-S-轉移酶和谷胱甘肽過氧化物酶在pH 2.0脅迫下無顯著變化,但在pH 3.0脅迫下會顯著上升等,pH 3.0可能是大葉相思幼苗耐強酸脅迫的生理調節閾值。另外,本研究中發現pH 6.1~4.5處理對金絲草幼苗胚根長、胚芽長、胚根干重無顯著影響(P>0.05),但胚根長隨酸度的增加呈先增后減趨勢,在pH 5.5達到最大值;且胚根長、胚根干重隨pH值的減小(pH 5.5~3.5)受到的抑制作用逐漸增強,胚芽干重則相反。張玉秀等[22]研究發現,紫穗槐(Amorphafruticosa)根長在pH 3.0~4.5 處理間迅速增加,然后隨著pH的升高逐漸減小,且在pH 4.5~5.0達到最大值,pH 3.0脅迫明顯抑制根生長。張海艷[23]研究發現,pH 5.0~2.0脅迫環境對玉米幼苗生長沒有顯著抑制作用,pH 1.0脅迫對玉米幼苗根系的抑制作用大于地上部分,本試驗研究結果與其一致。這可能是因為在弱酸處理下金絲草將有限的養分資源優先分配到根部來適應逆境,使根長得到補償增長來維持根系正常的生理功能,而低pH值可能導致根尖細胞分裂速度減慢或無法正常分裂,從而對根的伸長產生抑制。
Cd脅迫對金絲草的種子萌發指標和幼苗生長指標的抑制作用均表現為Cd 20>Cd 10>Cd 5,其中Cd 5處理會促進種子的發芽勢、發芽指數、胚芽長、胚芽鮮重和胚芽干重。徐雅梅等[24]對野生垂穗披堿草(Elymusnutans)種子在Mn、Pb處理下的響應研究發現隨著Mn、Pb溶液濃度的升高,種子發芽指標和胚根、胚芽長出現了不同程度的減小趨勢;孫金金等[25]研究發現黑麥(Secalecereale)、燕麥(Avenasativa)、高丹草(Sorghumbicolor×Sorghumsudanense)和無芒雀麥(Bromusinermis)等禾本科草類的相對發芽率、發芽指數和活力指數,以及幼苗的相對芽長、根長、芽重和根重均隨Cu、Cd和Pb脅迫濃度的增大呈降低趨勢,黑麥草(Loliumperenne)和高羊茅(Festucaarundinace)在高濃度脅迫下甚至出現“無根苗”現象,本研究結果與其一致。這可能是因為過量的重金屬離子會造成種子和幼苗產生過氧化毒害,造成細胞膜脂過氧化,甚至導致植物體內活性氧自由基的產生和抗氧化防御系統之間的失衡,影響植物的正常生長發育[26-27]。
伊文斯藍染色通過植物染色深淺來評價其質膜完整性,植物在受到逆境脅迫后積累的活性氧會導致植物MDA含量升高,而MDA 是細胞膜脂過氧化的主要產物,也是判斷植物細胞膜破損程度的重要指標之一[28]。李黎等[29]研究發現,細莖柱花草(Stylosanthesguianensisvar.intermedia)體內的丙二醛含量隨低溫處理時間的增加而逐步升高。羅潔文等[30]研究發現,類蘆(Neyraudiareynaudiana)根系體內的MDA含量隨Cd、Pb 脅迫濃度的增加呈增長趨勢,其根系質膜的著色變化與MDA含量變化相同,且在Cd、Pb濃度為100 μmol·L-1時著色最深。本試驗對金絲草幼苗根尖進行染色發現,隨著脅迫濃度的增加,染色程度逐漸加深,說明根尖細胞膜的破損程度逐漸增加,進一步在組織化學的層面上證明了酸、Cd處理對金絲草幼苗根系的影響,與以上研究結果一致。另外,有研究發現,植物在逆境環境下會對體內細胞器產生一定的損傷,特別是葉綠體、線粒體、細胞核等細胞器,導致細胞壁被破壞,葉綠體基粒膨脹、溶解、數量減少,線粒體膜破損,內嵴斷裂等現象發生[31-32]。本研究發現,在CK處理下,葉肉細胞組織結構完好,隨著脅迫濃度的增加,細胞質壁分離嚴重,葉綠體膜破裂,出現髓狀物質,基粒彎曲變形,線粒體管狀嵴排列混亂甚至消失,且在Cd 20處理下出現細胞空泡化現象,且Cd脅迫下的葉肉細胞的細胞壁、細胞質中均可檢測出重金屬Cd顆粒,可能是細胞壁固持作用達到了飽和或受到了破壞,使Cd離子進入到細胞內[33]。
4 結論
不同酸脅迫均對金絲草種子發芽率具有促進作用,pH 5.5處理對金絲草種子萌發和幼苗生長具有促進作用,但pH 3.5處理則表現出較大抑制作用;5 mg·L-1Cd處理下金絲草種子發芽率、發芽勢和發芽指數與對照無顯著差異,生物量顯著大于對照,但隨Cd脅迫濃度的增加,金絲草種子萌發和幼苗生長指標表現出抑制作用且呈逐漸增大趨勢;pH 大于3.5,Cd濃度小于10 mg·L-1對金絲草根尖質膜和胚芽超微結構影響較小,反之則破損嚴重,為金絲草耐受酸和Cd脅迫的閾值。

