二參湯對(duì)心力衰竭大鼠模型AngII 通路的干預(yù)與影響
王亞萍,王 萌,周麗雅
(1.吉林工程技術(shù)師范學(xué)院校醫(yī)院,長(zhǎng)春 130000;2.長(zhǎng)春中醫(yī)藥大學(xué)附屬醫(yī)院傳統(tǒng)診療中心,長(zhǎng)春 130022;3.長(zhǎng)春中醫(yī)藥大學(xué)基礎(chǔ)醫(yī)學(xué)院,長(zhǎng)春 130117)
近年來(lái),大量研究證明炎性反應(yīng)是導(dǎo)致CHF病理及生理的重要機(jī)制之一,且對(duì)于其炎癥通路及炎性細(xì)胞因子的研究也成為目前的研究熱點(diǎn)。當(dāng)前各項(xiàng)研究證實(shí),AngII本身是一種強(qiáng)大的促炎癥因子,它能夠激活循環(huán)中的白細(xì)胞,并通過(guò)合成黏附分子、趨化因子等參與白細(xì)胞黏附至活化的內(nèi)皮細(xì)胞[1-2]。同時(shí)AngⅡ還是 RAAS系統(tǒng)的主要活性物質(zhì),體內(nèi)的RAAS系統(tǒng)被激活,導(dǎo)致血管緊張素II(Ang II)的釋放增加,激活核因子-κB(NF-κB),進(jìn)一步激活 TLR4,觸發(fā)細(xì)胞信號(hào)級(jí)聯(lián)反應(yīng),而最終導(dǎo)致NF-κB 轉(zhuǎn)錄因子依賴(lài)的信號(hào)途徑的整體激活,進(jìn)而形成各種炎性因子對(duì)血管壁的浸潤(rùn),使得CRP等炎性因子的過(guò)度表達(dá),最終產(chǎn)生炎癥反應(yīng)。因此,促炎癥因子AngII、核轉(zhuǎn)錄因子NF-κB和非特異性炎癥反應(yīng)物CRP的測(cè)定可以作為CHF病理、生理狀態(tài)及預(yù)后評(píng)價(jià)的一種標(biāo)志物。
1 實(shí)驗(yàn)材料與方法
1.1 實(shí)驗(yàn)動(dòng)物 清潔級(jí)雄性Wistar大鼠160只,體質(zhì)量(250±20)g,由長(zhǎng)春中醫(yī)藥大學(xué)實(shí)驗(yàn)中心提供。
1.2 藥物 1)藥物二參湯:黨參20 g,丹參20 g,川芎15 g,麥冬10 g,五味子10 g,木香10 g,降香10 g,薤白15 g,元胡15 g。生藥由長(zhǎng)春吉林省中醫(yī)院制劑中心提供,由其中藥房代煎,長(zhǎng)春中醫(yī)藥大學(xué)實(shí)驗(yàn)研究室濃縮而成,其中藥液含生藥量為3. 36 g/mL,4℃冰箱保存。2)成藥:纈沙坦,北京諾華制藥有限公司,規(guī)格: 80 mg×7粒/盒,批號(hào):201604。
1.3 試劑 兔抗鼠NF-κB p65單克隆抗體(C-20):ZS-372,北京中杉金橋生物技術(shù)有限公司;辣根過(guò)氧化物酶標(biāo)記的山羊抗兔二抗,北京中杉金橋生物技術(shù)有限公司;CRP ELIsA試劑盒,R&D system公司;碘[125I]血管緊張素II(AII)放射免疫分析藥盒,北京北方生物技術(shù)研究所。
1.4 主要儀器 旋渦混合器(上海XW-80A);超聲器(MODELCV188);數(shù)顯恒溫水箱 (金壇HH-W-420);震蕩培養(yǎng)箱(哈爾濱HZQ-X100);酶聯(lián)免疫檢測(cè)儀(上海DG5031)。
1.5 動(dòng)物造模與分組 160只雄性Wistar大鼠隨機(jī)分出10只為假手術(shù)組,僅穿線不結(jié)扎冠狀動(dòng)脈左前降支(全部存活) ;余下的150只大鼠參照文獻(xiàn)[3-4]采用結(jié)扎冠狀動(dòng)脈左前降支的方法來(lái)建立急性心肌梗死大鼠模型,使用心臟彩超測(cè)定其心臟射血分?jǐn)?shù)(ejection fraction, EF)<60% 為造模成功,共43只,進(jìn)而值篩選出EF指數(shù)最低的30只,隨機(jī)分為纈沙坦組、中藥組、模型組各10只。
1.6 給藥 假手術(shù)組和模型組給予滅菌蒸餾水每只2 mL/d,中藥組給藥量每只2.085 g/kg,纈沙坦組給藥量每只20 mg/kg。1次/d,連續(xù)灌胃28 d。
1.7 觀測(cè)項(xiàng)目
1.7.1 觀測(cè)各組心肌組織形態(tài)學(xué)變化 灌胃28 d后,實(shí)驗(yàn)大鼠采用眼球取血法,并摘取心尖部部分心肌組織,于10% 福爾馬林溶液中固定一部分心肌組織;另一部分心肌組織于-80℃冰箱低溫保存。經(jīng)Masson染色法處理取部分心肌組織,觀測(cè)其形態(tài)學(xué)的變化。
1.7.2 檢測(cè)各組心肌NF-κB的蛋白表達(dá) 采用Western blot實(shí)驗(yàn)檢測(cè)其心肌NF-κB的蛋白表達(dá)。于實(shí)驗(yàn)大鼠左心室處提取50 mg心肌,同時(shí)提取總蛋白,電泳先以60 V電壓開(kāi)始,至溴酚藍(lán)指示劑進(jìn)入分離膠后,再將其電壓調(diào)整到120 V直至電泳結(jié)束。再于100 V恒壓轉(zhuǎn)膜60 min,隨后將膜移入含有5% 脫脂奶粉的0.1%Tween20的TBST溶液的自封袋中,在室溫下于搖床內(nèi)封閉l h。加一抗TLR4(1:200)、NF-κB p65(1:500),4℃冰箱過(guò)夜。次日再用TBST洗膜3次;再加入二抗(1:5000)于室溫內(nèi)在搖床內(nèi)搖動(dòng)1 h。TBST洗膜3次,將A、B發(fā)光液以1:1的比例均勻混合,1 min后將混合液滴加于膜上,并使用保鮮膜封包。于暗室內(nèi)使用X光片曝光后常規(guī)方法顯影、定影,隨后用Image J軟件分析。
1.7.3 檢測(cè)各組血清中CRP的濃度 使用大鼠血清因子ELISA試劑盒,檢測(cè)各實(shí)驗(yàn)組大鼠血清標(biāo)本中CRP的濃度。
1.7.4 檢測(cè)各組 AngⅡ濃度 采用放射免疫分析分析藥盒測(cè)定組織、血漿AngⅡ的放射性計(jì)數(shù)(cpm);之后用log-logit處理數(shù)據(jù),得出結(jié)果(CONC)。
1.8 統(tǒng)計(jì)學(xué)分析 運(yùn)用SPSS 15.0數(shù)據(jù)分析軟件分析處理各項(xiàng)數(shù)據(jù)。結(jié)論得出每組實(shí)驗(yàn)數(shù)據(jù)均為正態(tài)分布,方差齊,計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差()表示,采用單因素方差分析(one-way ANOVA),組間兩兩比較采用LSD分析,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 實(shí)驗(yàn)大鼠心肌組織形態(tài)學(xué)改變 1)假手術(shù)組:大鼠心臟Masson染色以紅色的心肌細(xì)胞為主,且心肌組織間分布均勻,結(jié)構(gòu)清晰,細(xì)胞排列整齊,細(xì)胞間隙窄,且心肌細(xì)胞間質(zhì)與周?chē)苤g無(wú)明顯綠色膠原纖維。2)模型組:CHF大鼠心肌細(xì)胞間質(zhì)、血管周?chē)梢?jiàn)大量的綠色膠原纖維沉積,并有瘢痕形成,部分心肌組織已被膠原纖維組織所取代,心肌細(xì)胞肥大,且圍繞于心肌細(xì)胞的膠原纖維出現(xiàn)斷裂、排列紊亂,細(xì)胞間隙增寬,血管壁增厚,纖維化程度重。3)給藥組:各給藥組CHF大鼠心肌間質(zhì)纖維化程度介于上述2組之間,但較模型組均有不同程度的減輕,其中二參湯組與纈沙坦組無(wú)明顯差異。見(jiàn)圖1。
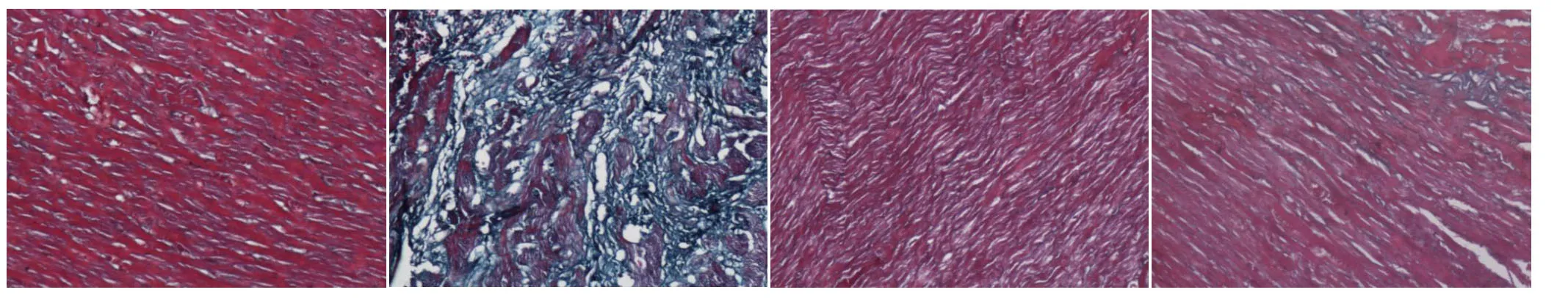
圖1 各組心肌組織形態(tài)學(xué)改變
2.2 各組藥物對(duì)CHF 大鼠心肌NF-κB 表達(dá)的影響 見(jiàn)圖2、表1。
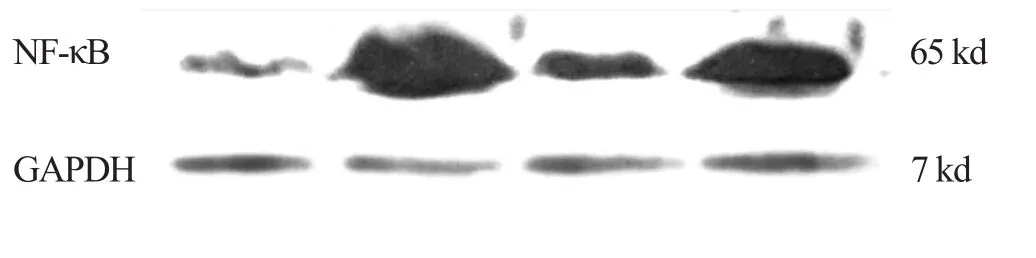
圖2 各組藥物對(duì)CHF 大鼠心肌NF-κB 表達(dá)的影響
表1 各組藥物對(duì) CHF 大鼠心肌NF-κB蛋白表達(dá)量的比較( ) pg/mL
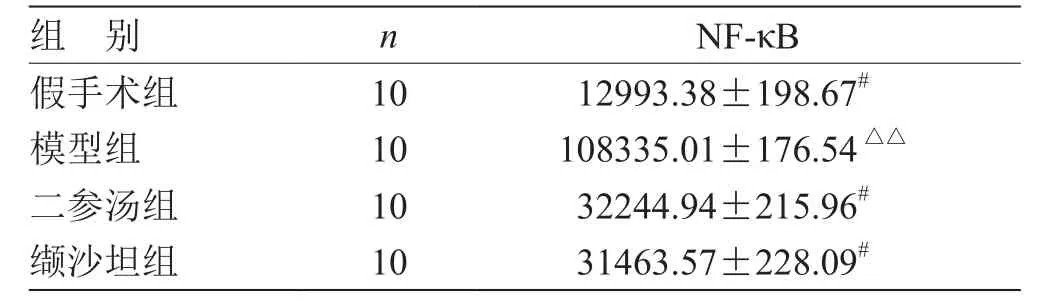
表1 各組藥物對(duì) CHF 大鼠心肌NF-κB蛋白表達(dá)量的比較( ) pg/mL
注:與模型組比較,# P<0.05;與假手術(shù)組比較,△△P<0.01
組 別 n NF-κB假手術(shù)組 10 12993.38±198.67#模型組 10 108335.01±176.54△△二參湯組 10 32244.94±215.96#纈沙坦組 10 31463.57±228.09#
2.3 各組血清中CRP含量比較 見(jiàn)表2。
表2 各組血清中CRP含量比較( ) pg/mL
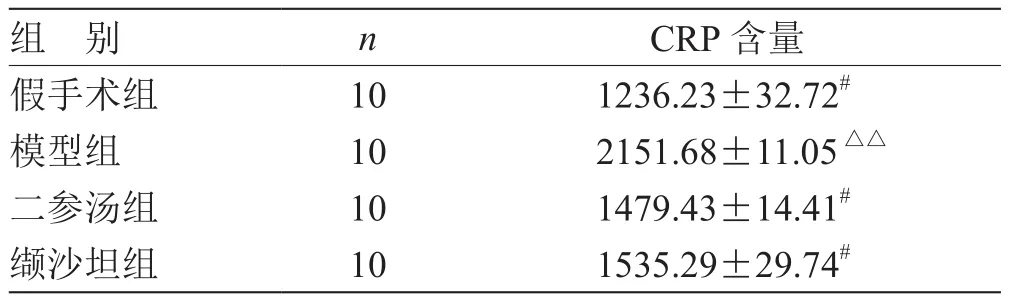
表2 各組血清中CRP含量比較( ) pg/mL
注:與模型組比較,# P<0.05;與假手術(shù)組比較,△△P<0.01
組 別 n CRP含量假手術(shù)組 10 1236.23±32.72#模型組 10 2151.68±11.05△△二參湯組 10 1479.43±14.41#纈沙坦組 10 1535.29±29.74#
2.4 各組 AngⅡ濃度比較 見(jiàn)表3。
表3 各組 AngⅡ濃度比較( ,n = 10) pg/mL
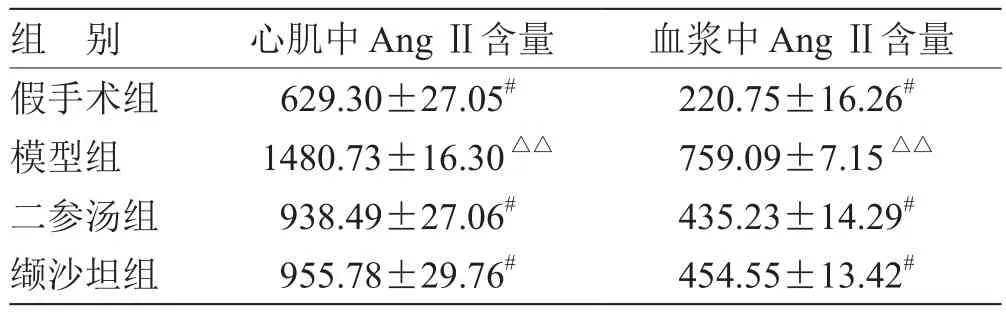
表3 各組 AngⅡ濃度比較( ,n = 10) pg/mL
注:與模型組比較,# P<0.05;與假手術(shù)組比較,△△P<0.01
組 別 心肌中 AngⅡ含量 血漿中 AngⅡ含量假手術(shù)組 629.30±27.05# 220.75±16.26#模型組 1480.73±16.30△△ 759.09±7.15△△二參湯組 938.49±27.06# 435.23±14.29#纈沙坦組 955.78±29.76# 454.55±13.42#
3 討論
研究證實(shí),AngII本身是一種強(qiáng)大的促炎癥因子,它能夠激活循環(huán)中的白細(xì)胞,并通過(guò)合成黏附分子、趨化因子等參與白細(xì)胞黏附至活化的內(nèi)皮細(xì)胞。通過(guò)對(duì)RAAS系統(tǒng)的深入研究,已經(jīng)發(fā)現(xiàn)一條心衰的炎癥反應(yīng)鏈,即體內(nèi)的RAAS系統(tǒng)被激活,導(dǎo)致Ang II的釋放增加,激活NF-κB,形成各種炎性因子對(duì)血管壁的浸潤(rùn),使得TNF-α、IL-6及CRP等炎性因子的過(guò)度表達(dá),最終產(chǎn)生炎癥反應(yīng)。有研究證實(shí),Ang II可以上調(diào)TLR4的表達(dá),這可能是Ang II的致炎作用之一[5],并且它通過(guò)TLR4/NF-κB通路介導(dǎo)血管平滑肌細(xì)胞的炎性反應(yīng)[6]。研究證明,AngⅡ是 RAAS系統(tǒng)的主要活性物質(zhì),在正常生理狀態(tài)下,心肌局部的AngⅡ水平基本保持在10~8 mol/L左右,調(diào)節(jié)血管收縮及水鹽代謝;但在高血壓、心肌缺血或心力衰竭等病理?xiàng)l件下,心肌組織局部的AngⅡ水平便能上升到10~7 mol/L以上,而此時(shí)則能夠?qū)е滦募》蚀蠹把苤貥?gòu)。近些年通過(guò)對(duì)RAAS系統(tǒng)的深入研究,人們已經(jīng)發(fā)現(xiàn)一條心衰的炎癥反應(yīng)鏈,即Ang II釋放→激活NF-κB→啟動(dòng)細(xì)胞因子CRP最終導(dǎo)致炎癥反應(yīng)。所以Ang II無(wú)論是從RAAS系統(tǒng),還是從炎癥通路,均能促使心力衰竭的進(jìn)一步發(fā)展和惡化,所以抑制Ang II的升高,便能夠切段該反映鏈,進(jìn)而在一定程度上控制心衰的發(fā)展。
本次實(shí)驗(yàn)結(jié)果顯示,模型組AngII含量最高,假手術(shù)組含量最低,各給藥組含量均較模型組有所降低,其中以二參湯組最為顯著。說(shuō)明二參湯、纈沙坦均能抑制AngII的生成,在一定程度上阻斷Ang II在CHF中的傳導(dǎo)途徑,對(duì)控制CHF的進(jìn)一步發(fā)展起到了作用。

