磁共振增強特征和ADC值與乳腺癌分子分型相關性的logistic分析
賈桂靜, 龔靜山, 陳超, 胡錦濤, 丁暉, 徐堅民
乳腺癌為一種高度異質性病變,有多種分子分型[1],且其治療反應和預后也不同,因此明確乳腺癌的分子分型對于為患者進行個性化治療至關重要[2]。目前乳腺癌的分子分型主要依賴組織病理學檢查,需要通過有創的手段,如手術或切檢,獲得足夠量的組織細胞來進行免疫組化或基因檢測,但是組織病理學檢查耗時和昂貴,不適合反復進行;此外,依賴組織病理學檢查獲得的分子分型可能會存在抽樣誤差(sampling error),尤其是穿刺活檢獲得的組織學標本。MRI已成為乳腺癌術前診斷、分期和術后或治療后評價的首選影像學檢查。利用乳腺癌MRI特征預測腫瘤的分子分型和治療反應,已成為國內外研究的熱點[3-10]。由于對乳腺癌分子特征和治療反應的認識水平逐漸深入,2015年起《St. Gallen早期乳腺癌國際專家共識》將HR+/Herb-2+組從Lumia B型中單獨分出,指明其需進行靶向治療[11]。本研究中依據免疫組化結果及臨床診治需求,將乳腺癌分為HR+組(HR+/Herb-2-)、Herb-2+組(HR±/Herb-2+)和三陰性乳腺癌(TN)組(HR-/Herb-2-),探討乳腺癌MRI增強特征和ADC值與分子分型的相關性。
材料與方法
1.一般資料
將2013年1月-2017年6月在本院收治且經病理證實為浸潤性乳腺癌、臨床和MRI資料完整的99例患者納入分析,其中3例增強檢查失敗、6例腫塊最大徑<1 cm而被剔除,最終共90例患者納入本研究,其中26例為多灶或多中心性乳腺癌(4例為雙側乳腺癌),同側多發病灶形態相同時選取最大病灶進行測量,雙側乳腺癌或同側病灶形態不同時則分開測量,同一例患者只記錄1個層面的背景實質強化(background parenchymal enhancement,BPE)狀態。90例患者共分析和記錄了95個病灶的數據。患者年齡23~68歲,平均(43.69±9.10)歲。
2.設備及檢查方法
將2013年1月-2017年6月在本院收治且經病理證實為浸潤性乳腺癌、臨床和MRI資料完整的99例患者納入分析,其中3例增強檢查失敗、6例腫塊最大徑<1 cm而被剔除,最終共90例患者納入本研究,其中26例為多灶或多中心性乳腺癌(4例為雙側乳腺癌),同側多發病灶形態相同時選取最大病灶進行測量,雙側乳腺癌或同側病灶形態不同時則分開測量,同一例患者只記錄1個層面的背景實質強化(background 使用Siemens 1.5T Avanto及3.0T Skyra磁共振掃描儀和乳腺專用線圈。受檢者取俯臥位,雙側乳腺盡量包于線圈內,利用固定裝置適當加壓固定。平掃序列包括橫軸位SE序列T1WI、T2WI及壓脂T2WI;動態增強掃描采用橫軸位3D FLASH T1WI序列,行6期橫軸位動態掃描及1期矢狀位延遲掃描,掃描參數:TR 5.16 ms,TE 2.38 ms,翻轉角10°,視野340 mm×340 mm,層厚1.10 mm;多b值橫軸位DWI掃描(b值分別為50、500、1000和1500 s/mm2);總掃描時間約30 min。
3.圖像分析和數據測量
ADC值測量:由1位具有10年乳腺影像診斷經驗的醫師對病灶進行測量,選取病灶擴散受限最明顯的層面, 在病灶實質內勾畫ROI,直徑0.2~0.5 cm,盡量避開腫瘤內的囊變、壞死區,ROI大小根據病灶適當調整,同一病灶不同區域反復測量3次,取最低ADC值。
MRI增強特征:依據MRI BI-RADS第5版標準[12],評價內容包括背景實質強化(BPE)、強化方式及動態增強血流動力學指標。在增強后第2期減影圖像上,根據乳腺正常實質強化程度,將BPE分為4級:1級,幾乎沒有強化;2級,有少量強化;3級,呈中等強化;4級,有顯著強化。增強方式分為腫塊樣強化及非腫塊樣強化兩類。血流動力學評估包括時間-信號強度曲線(TIC曲線)類型、早期強化率及強化峰值。本研究中對早期強化率及峰值的測量均在增強后第2個序列的增強圖像上進行。
分子分型:參考2015年St.Gallen早期乳腺癌國際專家共識[11],根據乳腺癌免疫組化檢測結果,將患者分為HR+組(HR+/Herb-2-)、Herb-2+組(HR±/Herb-2+)和TN(三陰性乳腺癌)組(HR-/Herb-2-);本研究中Ki-67的臨界值為20%。
4.統計學方法
本研究采用SPSS 19.0軟件進行統計分析。符合正態分布的定量資料,以均數±標準差格式表示,組間差異的比較采用單因素方差分析;定性資料以樣本量(百分比)的形式表示,組間差異的比較采用交叉表卡方檢驗,期望頻數不滿足要求時采用確切概率法。最終以單因素方差分析篩選出的有統計學意義的變量作為自變量,以3組分子分型(HR,TN,Herb-2)作為因變量,建立多分類Logistic回歸方程 。所有統計學檢驗結果以P<0.05為差異有統計學意義。
結 果
1.分子分型和分組
95個病灶經免疫組化法檢測,HR陽性且Herb-2陰性病灶(HR組)61個,三陰型乳腺癌(TN組)13個(其中浸潤性導管癌12個,小葉癌1個),Herb-2陽性而HR陰性或陽性病灶(Herb-2組)21個。

表1 三組間計量指標的比較
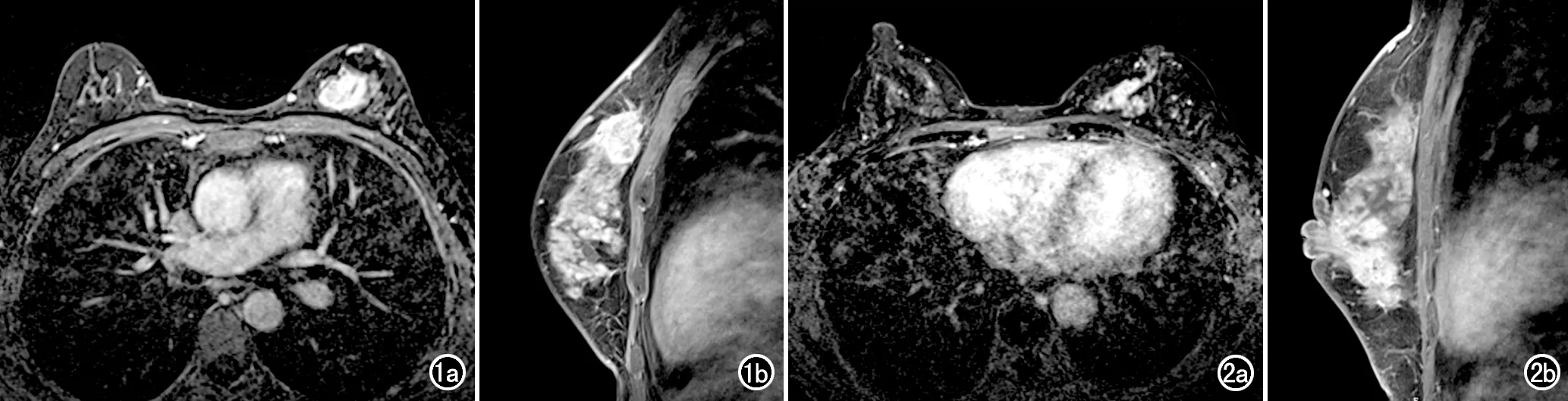
圖1 女,43歲, HR陽性乳腺癌患者。a)增強掃描第2期橫軸面圖像,顯示左乳內上不規則形腫塊,強化不均勻,BPE 4級;b)增強掃描延遲期矢狀面圖像,顯示腫塊邊緣有毛刺。 圖2 女,48歲,Herb-2陽性、HR陽性乳腺癌患者。a)增強掃描第2期橫軸面圖像,顯示左乳內下象限病灶呈非腫塊樣強化,BPE 3級;b)增強掃描延遲期矢狀面圖像,顯示乳腺內非腫塊樣強化病灶呈段狀分布。
2.MRI特征與分子分型的相關性
MRI特征與分子分型的相關性的單因素方差分析結果見表1,χ2檢驗結果見表2,典型圖像見圖1~4。強化方式(腫塊和非腫塊樣強化)和BPE在不同分子分型間的差異有統計學意義(P<0.05)。
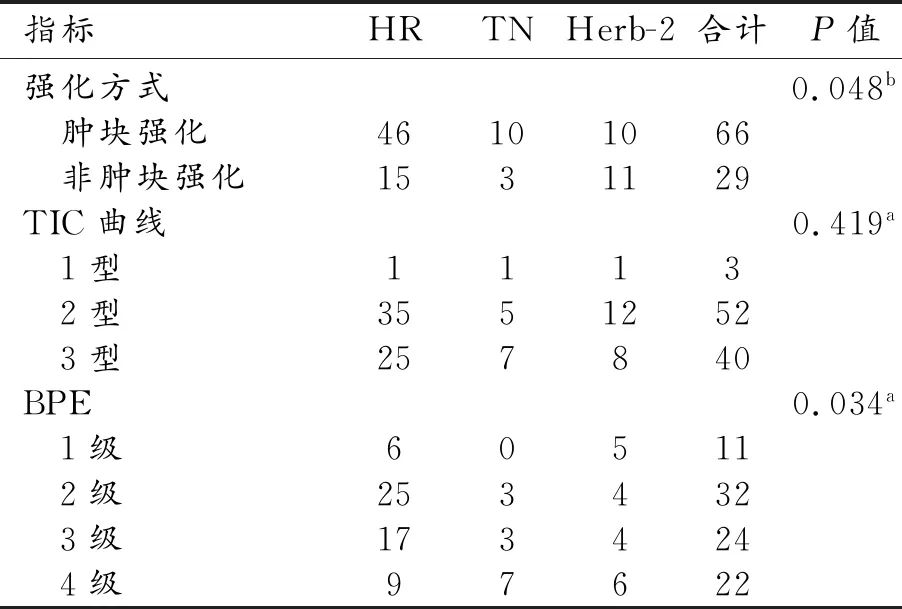
表2 三組間增強特征相關指標的比較
注:a采用“確切概率法”進行組間比較。b采用卡方檢驗。
多分類logistic回歸分析結果見表3。與Herb-2組比較,HR組傾向表現為腫塊樣強化(OR=4.594,95%CI:1.368~15.427;P=0.014);且兩組間BPE差異有統計學意義(P=0.036),BPE為2級時,乳腺癌分子分型為HR+的概率增加。與Herb-2組比較,TN組傾向于腫塊樣強化(OR=6.984,95%CI:1.208~40.37,P=0.030)。最終建立多分類logistic回歸方程:logit(P1/P3)=-0.441+1.525×強化方式-0.299×BPE1級+1.719×BPE2級+1.139×BPE3級。logit(P2/P3)=-2.028+1.944×強化方式,其中p1/p3是HR型相對于Herb-2型發生的概率,p2/p3是TN型相對于Herb-2型發生的概率。
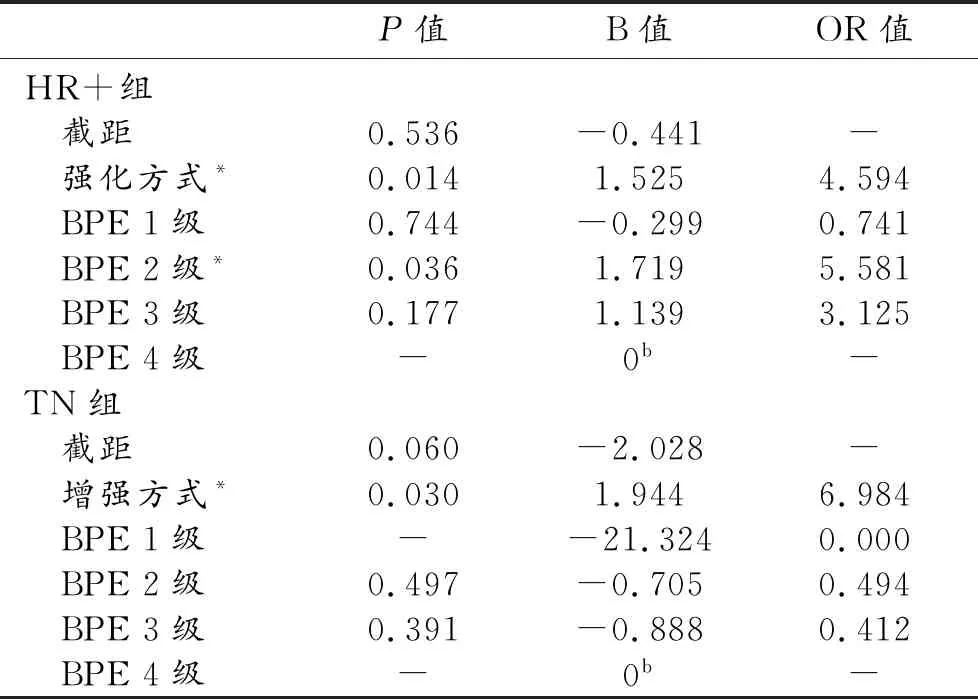
表3 多分類logistics分析結果
注:*與Herb-2組之間的差異有統計學意義(P<0.05);b因為此參數冗余,所以將其設為0。
討 論
近年來隨著DNA芯片技術的廣泛開展和臨床應用,使得臨床對腫瘤的分子特征有更深入的認識[13]。由于乳腺癌具有較高的異質性,相同組織病理學類型和分期的腫瘤可能具有不同的預后和治療反應,而腫瘤的分子特征是影響患者預后和對治療反應的重要因素,因此,明確腫瘤的分子分型有利于臨床開展個性化治療。腫瘤的基因檢測不僅費時和價格昂貴,而且不能克服組織學標本帶來的抽樣誤差和反映異質性較高的乳腺癌的全貌,因此,在臨床應用中存在一定的局限性。MRI以其無創、無輻射和優良的軟組織和空間分辨力等優點,成為乳腺癌術前診斷和分期、術后隨訪及治療反應評價的首選影像學手段。因此,利用MRI特征探索乳腺癌的分子特征,為臨床個性化治療提供決策支持具有重要意義。
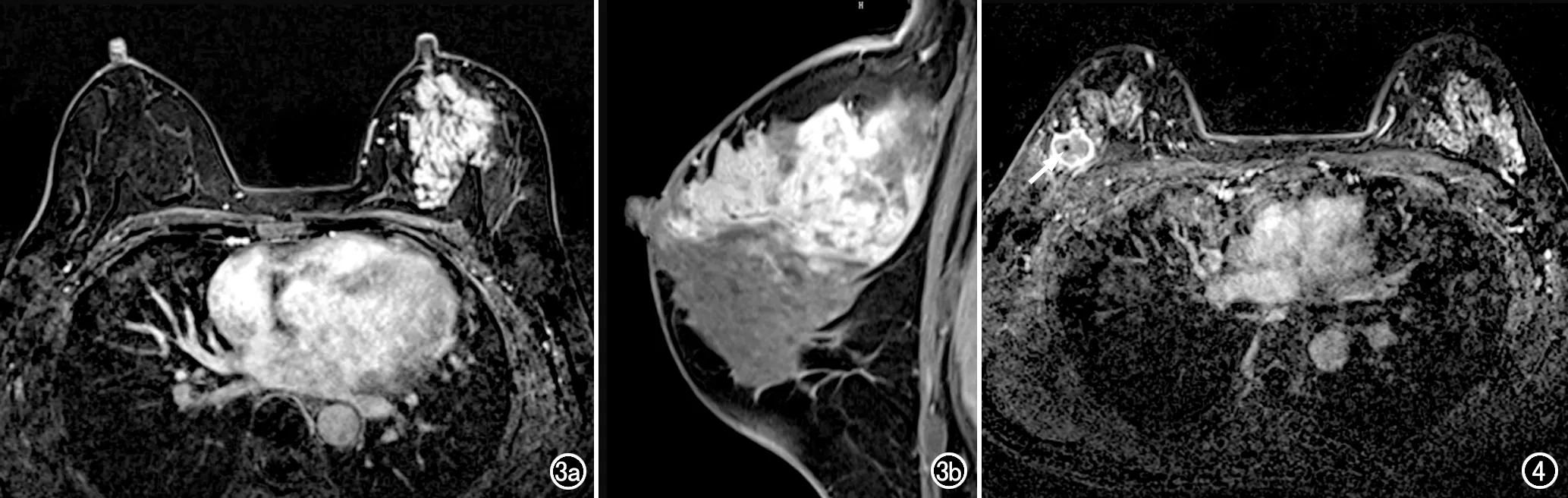
圖3 女,53歲,Herb-2陽性/HR陰性乳腺癌患者。a)增強掃描第2期橫軸面圖像,顯示左乳上部非腫塊樣強化病灶,BPE 1級;b)增強掃描延遲期矢狀面圖像,顯示非腫塊樣強化病灶呈段狀分布。圖4 女,40歲,TN型乳腺癌患者。增強掃描第5期橫軸面圖像,顯示右乳外上象限內腫塊,邊緣明顯環形強化,內部強化均勻、因對比劑流出呈較低信號,腫塊內點樣低信號(箭)為穿刺后該變,BPE 3級。
本研究通過采用對臨床治療方案具有指導意義的HR+型、Herb-2+型及TN型乳腺癌三種分組方法,比較不同組間乳腺癌的MRI特征,95個病灶中,早期強化率、強化峰值及TIC曲線在各組間的差異均無統計學意義,而增強后表現為腫塊或非腫塊樣強化的比例,在三組間的差異有統計學意義(P<0.05)。本研究結果表明,與Herb-2+型乳腺癌比較,HR+型主要表現為腫塊強化和2型BPE,TN型乳腺癌主要表現為腫塊樣強化;與HR型及TN型乳腺癌相比,Herb-2+乳腺癌多表現為非腫塊強化。本組結果與文獻報道基本一致[14-15]。上述結果可能與不同類型的腫瘤生長方式不同有關。Tot[16]認為早期Herb-2陽性乳腺癌為典型的小葉生長模式,通常呈彌漫性生長,且更易伴隨導管內原位癌(ductal carcinoma in situ,DCIS),而DCIS的典型表現即為非腫塊樣強化,以此方法區分Herb-2陽性與陰性腫瘤簡單有效。
本研究中,另一MRI增強特征BPE在Herb-2+組與HR+組的差異有統計學意義。Herb-2組中BPE 1級的例數為5例,高于2和3級BPE的例數(分別為4例),而HR組中BPE 1級的例數(6例)明顯少于2和3級BPE(分別為25和17例)。BPE實際是腺體組織活動性的反應,BPE程度與激素水平關系密切。有學者推測BPE程度的增加可能提示患激素受體陽性腫瘤的風險增加,本研究結果支持這一推測。與Herb-2組比較,當BPE的級別升高,乳腺癌分子分型為HR的概率增加[17-19]。
此外,雖然本研究中ADC值在不同分子分型組間的差異無統計學意義,但TN組的ADC值低于其它2組,與kato等[20]的結果相似,他進一步將TN組患者又分為導管型及特殊型乳腺癌2個亞組,發現導管型的最小ADC值明顯低于特殊型及其它各型,認為這與導管型TN惡性程度高有關。本研究中TN組中除1例為特殊型外,其余均為導管癌,因此基本就是反映了導管型TN的ADC水平,符合kato等[20]的研究結果。
本研究為回顧性研究,有一定不足之處:樣本量較小,可能存在病例選擇的偏倚;其次,對于其它強化特征(形狀、邊緣、內部強化特征等)未進行研究,尚有待在今后的研究中進一步深入;最后,本研究中TN型乳腺癌患者的例數較少,可能是導致3組間ADC值差異無統計學意義的原因,有待今后擴大樣本量進一步深入研究。
綜上所述,不同乳腺癌分子分型間的MRI增強特征存在差別,用腫塊或非腫塊增強方式鑒別Herb-2型及非Herb-2型乳腺癌簡單有效,與Herb-2+型相比,高級別BPE與HR+乳腺癌相關;雖然本研究中ADC值在不同分子分型組間的差別無統計學意義,但TN組的ADC值低于其它2組。MRI特征與乳腺癌的分子特征之間可能有一定相關性,有助于HR+型、Herb-2+及三陰性乳腺癌的鑒別,能為臨床乳腺癌患者的個性化治療的決策提供指導。

