基于MR增強圖像肝細胞癌直方圖紋理分析
宋文龍,郭大靜,陳倩羽,張靜,劉倩,唐茁月
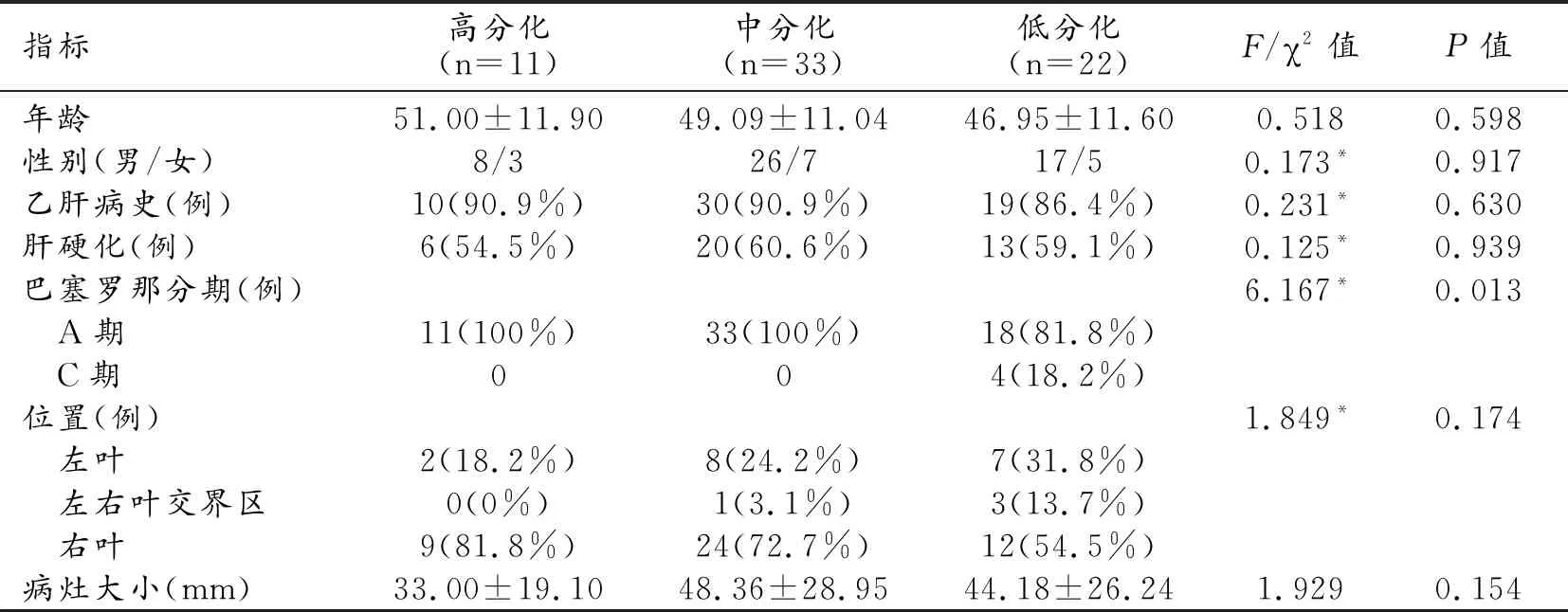
表1 患者的基本臨床資料
注:括號內為組內占比;*卡方統計量。
肝細胞癌(hepatocellular carcinoma,HCC)的組織學分化程度是術后復發的主要因素,低分化HCC具有更高的復發率及更差的預后[1,2]。因此,術前準確判斷HCC的分化程度,對臨床治療方案的選擇進而提高療效具有重要意義。目前公認的HCC術前評估方法是經皮肝穿刺活檢,但易出現取樣部位的差異性及創傷性并發癥等問題,具有一定的局限性[3]。
近年來,基于圖像的紋理分析作為一項非侵入性技術,已成為術前定量評估腫瘤異質性的一種方法[4],并已廣泛應用于肺、乳腺和腦等諸多部位腫瘤的診斷、療效評估及預后預測[5-9]。直方圖特征能精確反映圖像體素的異質性,并且在影像圖像上更具有優勢[10-11]。筆者查閱了迄今的國內外文獻,探討基于增強MRI的直方圖特征與HCC的組織學分化程度的相關性的研究比較少,本研究對這一問題進行了初步研究和分析,旨在為HCC患者臨床治療方案的選擇提供重要的參考依據。
材料與方法
1.臨床資料
將2011月12月-2018年1月在本院經手術病理證實且符合本研究要求的66例單發HCC患者納入研究。其中高分化HCC11例(A組),中分化33例(B組),低分化22例(C組)。納入標準:① MRI檢查及外科手術前未接受過任何其它方式的治療;②MRI檢查前未行肝臟穿刺活檢;③所有病例術前1周內行MRI平掃及三期增強掃描;④根據BCLC分期方法[12],A、C期且病灶為單發的患者;⑤腫瘤直徑>1 cm。排除標準:①圖像質量差,不能滿足診斷要求;②有磁共振檢查禁忌證。本研究通過我院醫學倫理委員會批準,所有患者知情同意并簽署知情同意書。
搜集所有患者的基本臨床信息,來自于本院臨床病例系統,詳見表1。除巴塞羅那分期外,其它指標在三組間的差異均無統計學意義(P>0.05)。
2.MRI掃描方法
使用GE HDx 1.5T超導磁共振儀和8通道體部相控陣線圈。橫軸面T1WI采用雙回波快速擾相梯度回波序列:TR 220 ms,TE 4.7/2.1 ms,層厚7 mm,層間距1 mm,視野42 cm×33.6 cm,矩陣288×160;冠狀面T2WI采用三維穩態進動快速成像(FIESTA)序列:TR 3.2 ms,TE 1.4 ms,層7 mm,層間距1 mm,視野42.0 cm×37.8 cm,矩陣192×224;橫軸面壓脂單次激發FSE T2WI:TR 6316 ms,TE 90.9 ms,層厚7 mm,層間距1 mm,視野44.0 cm×35.2 cm,矩陣288×224;肝臟快速容積采集(LAVA)成像:TR 4.2 ms,TE 2.0 ms,層厚4.8~5.4 mm,層間距-1.4~-2.7 mm,視野42.0 cm×33.6 cm,矩陣320×192。增強掃描使用對比劑GD-DTPA,劑量0.2 mmol/kg,注射流率2.0 mL/s;平掃、動脈期、門脈期和平衡期延遲時間分別為0、20~23、50和90 s。
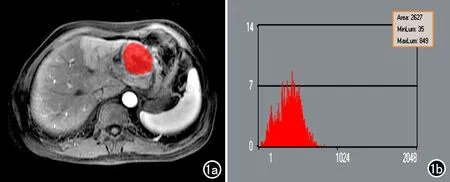
圖1 紋理參數測量方法。a)將圖像導入MaZda軟件,選取病灶最大層面,在病灶實質內勾畫ROI;b)經軟件運算獲得的ROI的灰度直方圖。

表2 MaZda軟件中提取的各直方圖參數的意義
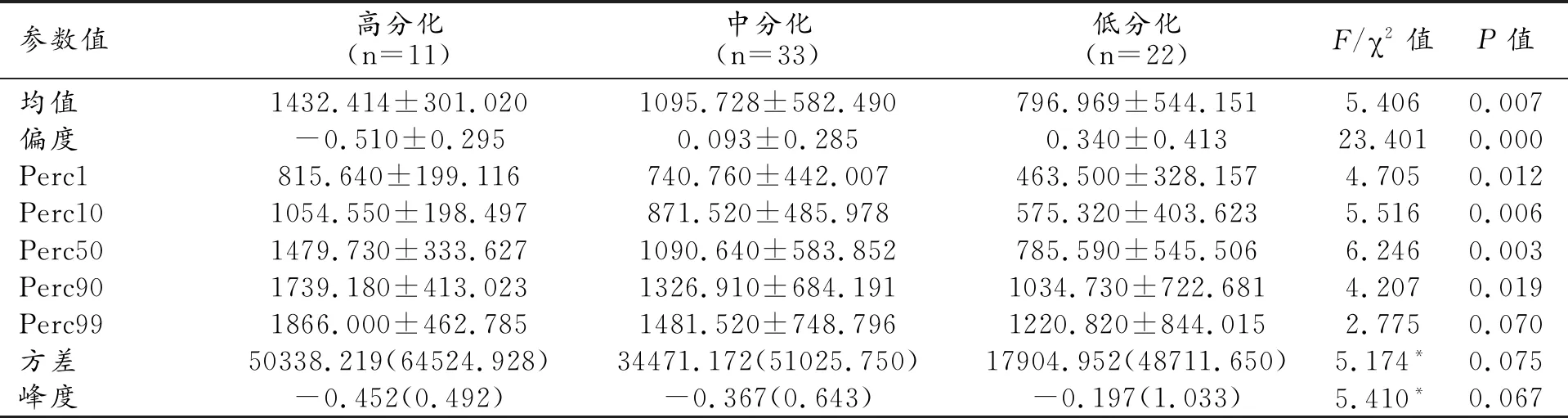
表3 動脈期各參數值的三組間比較
注:*卡方統計量。
3.圖像分析及后處理
所有圖像由高年資腹部組診斷醫師進行后處理和閱片分析。將動脈期及門脈期病灶最大層面(層面保持一致)的圖像數據以DICOM格式導入MaZda軟件,在病灶實性部分勾畫ROI,經軟件處理后即可提取病灶的直方圖紋理參數(圖1),本研究中主要分析均值、方差、 偏度、 峰度、以及第1、10、50、90和99百分位數值(記錄為Perc1、Perc10、Perc50、Perc90和Perc99)共9個紋理參數,各參數的計算公式和意義見表2。
4.統計學方法
使用SPSS 22.0軟件進行統計學分析。患者基本臨床資料的比較采用單因素方差分析或卡方檢驗。連續型變量采用Kolmogorov-Smirnov檢驗進行組內正態性檢驗;采用Levene檢驗進行組內方差齊性檢驗。符合正態分布且方差齊性的參數以均值±標準差表示,采用單因素方差分析進行組間比較,進一步組間兩兩比較采用LSD檢驗;不滿足正態分布和方差不齊的參數以中位數及四分位間距表示,使用非參數Kruskal-Wallis檢驗。對差異有統計學意義的參數值進行Spearman相關性分析。并進行ROC曲線分析,分析其診斷效能。雙側檢驗,以P<0.05為差異具有統計學意義。
結 果
1.動脈期直方圖參數與病理分化程度的關系
動脈期圖像上不同分化組間HCC的各項紋理參數測量值及組間比較結果見表3。除Perc99、峰度和方差外(P>0.05),其它6個紋理參數在3組間的總體差異具有統計學意義(P<0.05);對這6個參數進一步進行組間兩兩比較,結果見表4。偏度和Perc50在組間兩兩比較時,差異均具有統計學意義(P<0.05);而均值、Perc1、和Perc10僅在低分化組分別與高分化組、中分化組比較時,差異具有統計學意義(P<0.05);而Perc90僅在高分化組與低分化組比較時,差異具有統計學意義(P<0.05)。相關性分析結果表明:偏度與分化程度呈正相關(r=0.600,P=0.000),而均值(r=-0.407,P=0.001)、Perc1(r=-0.408,P=0.001)、Perc10(r=-0.427,P=0.000)和Perc50(r=-0.422,P=0.000)與分化程度呈負相關。

表5 門脈期各紋理參數值及3組間比較
注:*卡方統計量。
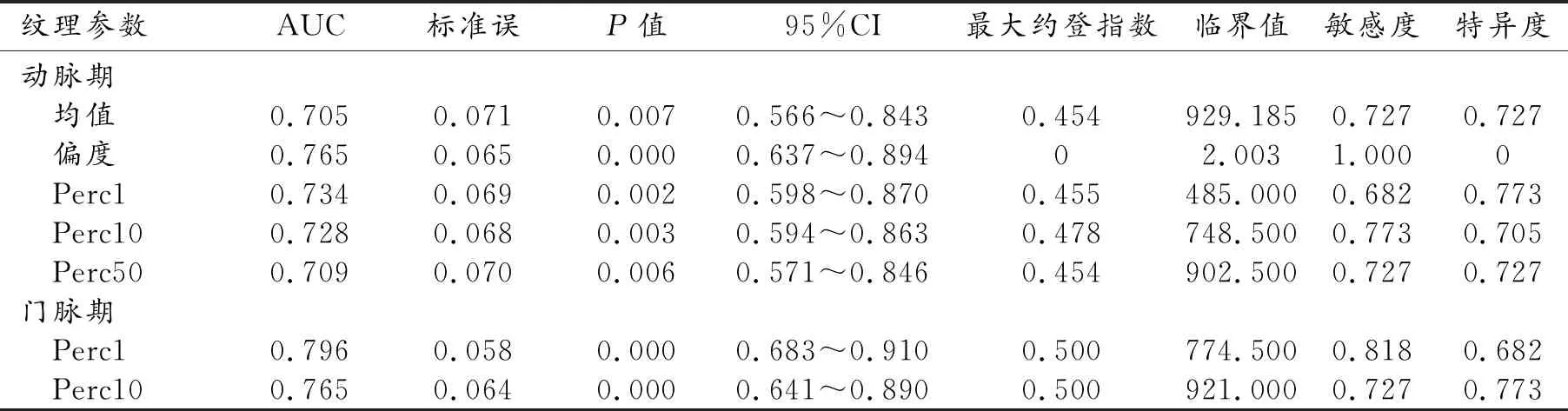
表7 各參數值診斷效能分析

表4 動脈期各紋理參數組間兩兩比較的P值
2.門脈期直方圖參數與病理分化程度的分析
門脈期圖像上HCC的直方圖參數測量值及組間比較結果見表5。經統計學分析,均值、Perc1、Perc10和Perc50在3組間的總體差異具有統計學意義(P<0.05),而偏度、方差、峰度、Perc90和Perc99在3組間的差異無統計學意義(P>0.05)。
組間兩兩比較結果見表6。Perc1和Perc10在各組間兩兩比較,差異均具有統計學意義(P<0.05);均值和Perc50僅在高分化和低分化組間的差異有統計學意義(P<0.05)。
相關性分析表明,Perc1(r=-0.587,P=0.000)和Perc10(r=-0.547,P=0.000)與分化程度呈負相關。
表6 門脈期紋理參數組間兩兩比較的P值
3.診斷效能分析
對組間差異有統計學意義的指標,進一步對其鑒別低分化HCC的診斷效能進行分析,并繪制ROC曲線,相關結果見表7、圖2~3。各參數的ROC曲線下面積為0.705~0.796,以門脈期Perc1的ROC曲線下面積最大,診斷效能最高,取其最大約登指數對應臨界點為診斷閾值,即Perc1為774.500時,診斷敏感度為0.818,特異度為0.682。
討 論
HCC作為全球發病率居第五的腫瘤,其致死率高居第二位[13],治療后的高復發率仍然是臨床亟待解決的主要難題,而腫瘤分化程度是影響預后的主要因素之一[1-2]。因此,選取一種能早期無創、準確評估HCC分化程度的方法至關重要。紋理分析技術目前已廣泛運用于惡性腫瘤侵襲性的研究[5,7,9]。MRI具有多參數成像、軟組織分辨率高和信噪比高等優勢[7,9],但是ADC、Ktrans等MR功能圖像的分辨率較差且需要采用額外的序列進行數據采集,而常規T1WI和T2WI不能很好地反映腫瘤的異質性[7,11,14],而增強掃描圖像不僅融合了HCC病灶的解剖、血供和細胞成分信息[15],而且圖像分辨率相對較高。因此,本研究探討增強MRI圖像直方圖與HCC組織學分化程度的相關性,結果表明HCC的病理分化程度與基于增強MRI的部分直方圖參數間具有顯著相關性。
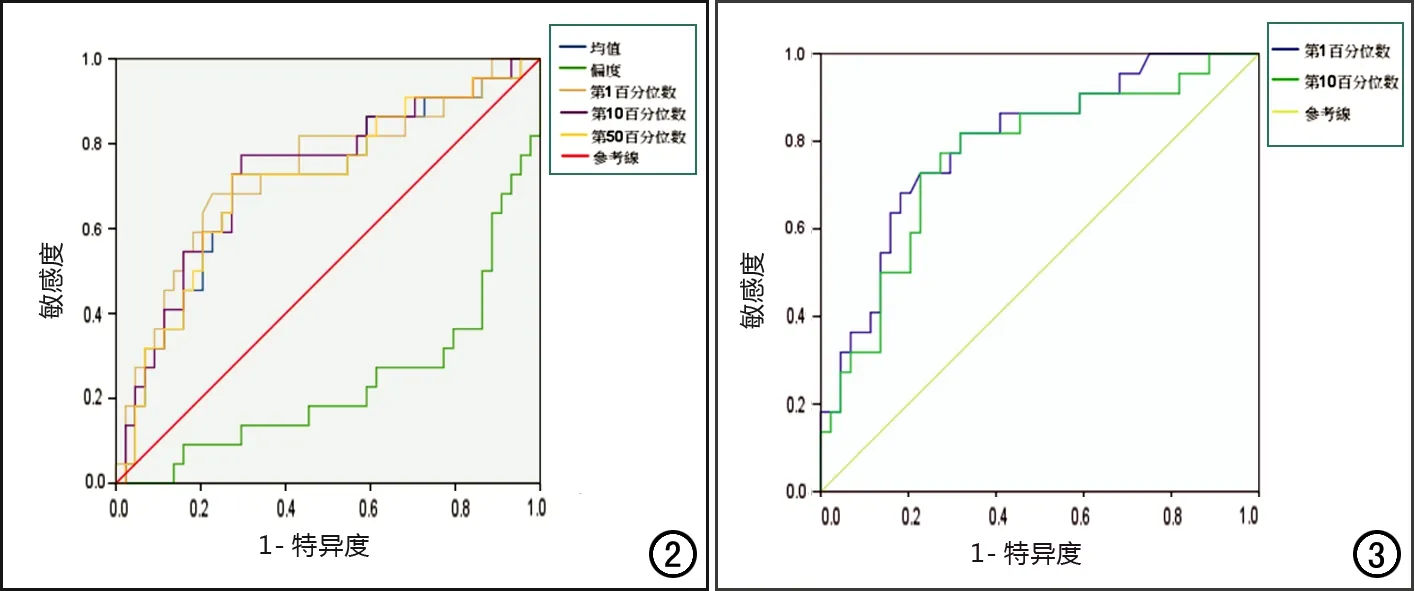
圖2 動脈期各項有組間差異的紋理參數的ROC曲線。 圖3 門脈期各項有組間差異的紋理參數的ROC曲線。
本研究結果顯示,在動脈期圖像上低分化HCC的均值明顯低于中分化和高分化HCC,而均值代表像素平均灰度值,這是由于低分化HCC的腫瘤細胞排列密集、微血管侵犯以及門靜脈癌栓形成等原因,造成動脈期對比劑進入腫瘤受阻,進而導致圖像像素灰度值比較低[15-16]。Zhou等[15]學者利用MRI動脈期直方圖參數表明,均值在區別低級別與高級別HCC具有重要意義,低級別HCC的均值明顯高于高級別HCC,與本研究結果基本相符。門脈期圖像上HCC的均值在3組間存在顯著差異,而進行兩兩比較時,僅在低分化組與高分化組間具有顯著差異,究其原因,可能是由于HCC強化方式為"快進快出",而隨著腫瘤惡性程度增加,HCC的供血方式由門靜脈為主轉變為以肝動脈為主[16]。但是,本研究中高分化組與中分化組間均值的差異無統計學意義,這可能是由于中、高分化腫瘤之間供血差異不足以造成圖像的灰度值改變。
偏度代表直方圖灰度分布的不均勻性。有研究認為腫瘤的異質性越高,偏度值就越高。其原因是分化程度越低的腫瘤,細胞數目越多,細胞排列越緊密,細胞外間質越少,進而偏度值越大,導致腫瘤內部結構的復雜性,從而造成灰度直方圖分布不均勻[17]。本研究結果也顯示,動脈期圖像上病灶的偏度值在高、中、低分化組間差異均有統計學意義,其值與分化程度呈正相關。所以,偏度可作為評估術前HCC分化程度的參數。同時,本研究中還發現僅動脈期圖像上病灶的偏度對鑒別低分化HCC有一定價值,這可能是由于肝細胞癌主要由肝動脈供血,導致動脈期HCC的強化程度最高,這樣就能更好地反映出HCC的異質性。
百分位數值指的是從直方圖左邊開始,在小于第n%體素區間內的平均灰度值。本研究結果顯示,動脈期第1、10和50百分位數值,門脈期第1和第10百分位數值在低分化組與中分化、高分化組間的差異具有統計學意義,而且低分化HCC的各個百分位數的均數顯著低于中分化和高分化HCC。推測可能是HCC的分化程度與腫瘤的供血豐富程度有關,低分化HCC一般強化程度較低,囊變、壞死更常見[15]。此外,診斷效能分析結果顯示,百分位數值越低,ROC曲線下面積越高,并且大于動脈期均值的診斷效能,這是由于相比于均值,百分位數更容易反映感興趣區內的微小變化[17]。由于低分化HCC囊變、壞死、出血等更常見,病灶在動脈期整體灰度值不高,且門脈期腫瘤實性部分灰度值下降明顯,從而導致整個腫瘤的灰度值較動脈期更低,所以相對而言門脈期百分位數值識別低分化HCC更為敏感。
國內外研究表明,HCC的形態學特征以及MRI信號改變,可在一定程度上預測其組織學分化程度[16,18-19]。例如,Chang等[18]學者的一項研究表明,HCC的分化程度隨著腫瘤的大小增加而降低;低分化HCC更容易出現包膜的延伸和動脈期強化程度較低。而在本組研究中,腫瘤大小在不同分化程度HCC間的差異無統計學意義,這可能是由于樣本量選擇差異等原因所致。而本研究中BLCL C期的單發腫瘤可見血管侵犯,這一征象的出現率在不同分化程度腫瘤之間的差異有顯著意義,這與Pawlik等[19]學者的研究結果相對一致。腫瘤的其它形態學特征(分葉、包膜等)以及MRI信號改變與HCC組織學分化程度之間具有一定的相關性,是由于腫瘤MRI的信號改變與其內部成分(瘤內脂肪變性、出血、肝實質背景鐵質沉積等)和血供有關[16,20],腫瘤的形態學特征與腫瘤本身的生長方式有關,所以我們將在今后的大樣本研究中將聯合應用紋理分析和影像組學研究,進一步進行探討和驗證。
本研究具有一定的局限性:①本研究為回顧性分析,樣本量相對較小,會存在一定的選擇偏倚;②本研究勾畫ROI采用的是最大橫截面積方法,相對于全容積法評價腫瘤異質性存在一定局限性,但是此方法簡單、快捷,更具有臨床實用性。
總之,我們認為基于增強MRI圖像的直方圖參數分析對鑒別不同分化程度的HCC具有一定價值,尤其是在預測低分化HCC方面,可以作為一項非侵入性技術輔助臨床在術前更好地評估腫瘤的分化程度。

