動態增強MRI評估胰腺導管內乳頭狀黏液性腫瘤惡性潛能的價值
柴麗,王晴柔,朱乃懿,王婷,柴維敏
胰腺導管內乳頭狀黏液性腫瘤(intraductal papillary mucinous neoplasms,IPMNs)是一種胰腺導管系統上皮源性的胰腺外分泌囊性腫瘤,占胰腺囊性腫瘤的22%[1],其特點是上皮細胞異常增生形成乳頭狀結構且可分泌大量黏液[2]。IPMNs根據累及范圍分為主胰管型、分支胰管型和混合型;根據不同免疫組化亞型,分為腸型、胃型、胰膽管型及嗜酸細胞型。IPMNs是一組從良性病變可逐步發展為浸潤癌的癌前病變,按細胞的異形性程度可分為低度、中度和重度不典型增生以及浸潤性癌,前三者為非浸潤性腫瘤[3]。IPMNs伴浸潤性癌時可分為導管腺癌、膠樣癌及其它類型。導管腺癌通常起源于胃型或胰膽管型,而膠樣癌常起源于腸型,膠樣癌的預后好于導管腺癌[3,4]。很多研究將表現為重度不典型增生和浸潤性癌的IPMNs歸為惡性腫瘤,但有研究者指出重度不典型增生的IPMN不應被認為是惡性病變[3,5,6]。而且,浸潤性癌IPMNs術后殘余胰腺發生胰腺癌的風險明顯高于重度不典型增生IPMNs[7]。因此,本文回顧性分析不同細胞異形性的IPMNs在動態增強MRI上的表現,旨在探討DCE-MRI評估IPMNs惡性潛能的價值。
材料與方法
1.研究對象
回顧性分析2016年1月-2018年6月本院符合納入標準的IPMNs患者的臨床和DCE-MRI資料。納入標準:①在本院經手術病理證實為胰腺IPMNs;②術前1~2月行DCE-MRI檢查;③行術前DCE-MRI檢查前未接受胰腺手術及胰腺放化療等相關治療。排除標準:①患者配合不佳,運動偽影干擾圖像質量,影響圖像分析;②病理證實IPMNs同時合并有其它胰腺腫瘤性病變。
符合納入標準的共172例IPMNs患者,排除IPMNs合并其它腫瘤性疾病的57例患者,包括IPMNs合并胰腺導管腺癌有49例、IPMNs合并胰腺神經內分泌腫瘤4例、IPMNs合并漿液性微囊腺瘤3例和IPMNs合并黏液性囊腺瘤1例。最終本研究共納入115例IPMNs患者,男75例,女40例,性別比為1.875:1;年齡41~83歲,平均(63.8±7.9)歲。主要臨床表現:腹部不適、腹痛41例,慢性胰腺炎急性發作5例,黃疸6例,腹瀉3例,腹脹2例,體重減輕3例,背部酸痛1例,無臨床癥狀54例。既往史:急性胰腺炎發作病史13例,胰十二指腸根治術56例,胰體尾部切除術+脾臟切除術22例,保脾胰腺體尾部切除術10例,胰中段或節段切除術17例,全胰腺切除術8例,胰腺病灶局部切除術2例。
根據病理檢查結果,將IPMNs患者分為3組:A組(輕度~中度不典型增生)70例、B組(重度不典型增生)10例,C組(浸潤性癌)35例,其中導管腺癌25例、膠樣癌8例、腺鱗癌2例。
2.MRI檢查方法
分別使用GE Signal HDxt 1.5T(37例)、Simens Area 1.5T(40例)和Philips Ingenia 3.0T(38例)磁共振掃描儀和腹部相控陣線圈。患者在增強掃描前禁食6~8 h,取仰臥位,行平掃及多期動態增強掃描。主要掃描序列和參數如下。①平掃T1WI:TR 181 ms、TE 2.39 ms(3.0T)或TR 215 ms、TE 2.15 ms(1.5T),層厚6 mm,矩陣240×180(3.0T)或288×224(1.5T);②FSE脂肪抑制T2WI:TR 2750 ms、TE 77.59 ms(3.0T)或TR 6000 ms、TE 85.01 ms(1.5T),層厚6 mm,矩陣296×296(3.0T)或288×224(1.5T);③動態增強掃描:采用一次屏氣三維容積間插重建梯度回波抑脂序列,TR 5.04 ms,TE 2.31 ms,層厚1.5~2.0 mm,對比劑為釓噴酸葡胺,劑量0.2 mL/kg,注射流率2 mL/s。
3.圖像分析
由2位分別有2年和20年腹部MRI診斷經驗的放射科醫師,在僅僅知曉病理結果為胰腺IPMNs情況下,在PACS上進行閱片,若出現分歧,則共同協商達成一致意見。根據2016年修訂版福岡共識[5]的分類標準,將本組病變分為3型:①主胰管型(main duct,MD):節段性或彌漫性擴張>5 mm且無其它梗阻原因;②分支胰管(branch duct,BD)型:胰腺囊性病灶直徑>5 mm且與主胰管相通;③混合型(mixed type,MT):胰腺病灶分別符合MD型和BD型的標準。觀察分析病灶的部位、大小、主胰管直徑、胰管內壁結節大小、低位膽道梗阻、周圍組織侵犯、淋巴結腫大及血管侵犯特征等表現。同時,參考2016年修訂的福岡共識[5]中的影像學上“讓人擔憂的特征”:囊性病灶≥3 cm、可強化壁結節<5 mm、厚囊壁強化、主胰管直徑5~9 mm、主胰管管徑改變伴有遠端胰腺實質萎縮、淋巴結腫大、CA(carbohydrate antigen)19-9升高(>35 U/mL)、囊性病變的增長速度>5 mm/2年;明顯的“高危特征”:胰頭部病灶伴有梗阻性黃疸(a)、強化壁結節≥5 mm(b)、主胰管管徑≥10 mm(c)。
4.病理分析
病理科醫師再次復察標本的常規HE染色切片,參照2010年WHO消化系統腫瘤分類標準,再次評估胰腺IPMN細胞異形程度。對于胰腺IPMNs切除術后病灶中不同部位出現不同細胞異形性的情況,我們將病理上細胞異形性程度最高的IPMNs與相應的影像學表現對應。
5.統計分析
使用SPSS 22.0軟件進行統計學分析。定量指標的比較采用獨立樣本t檢驗、單因素方差分析,各組間IPMNs在DCE-MRI上的征象與病理的對照比較采用Fisher精確檢驗法。以P<0.05為差異有統計學意義。
結 果
1.胰腺IPMNs的臨床及病理
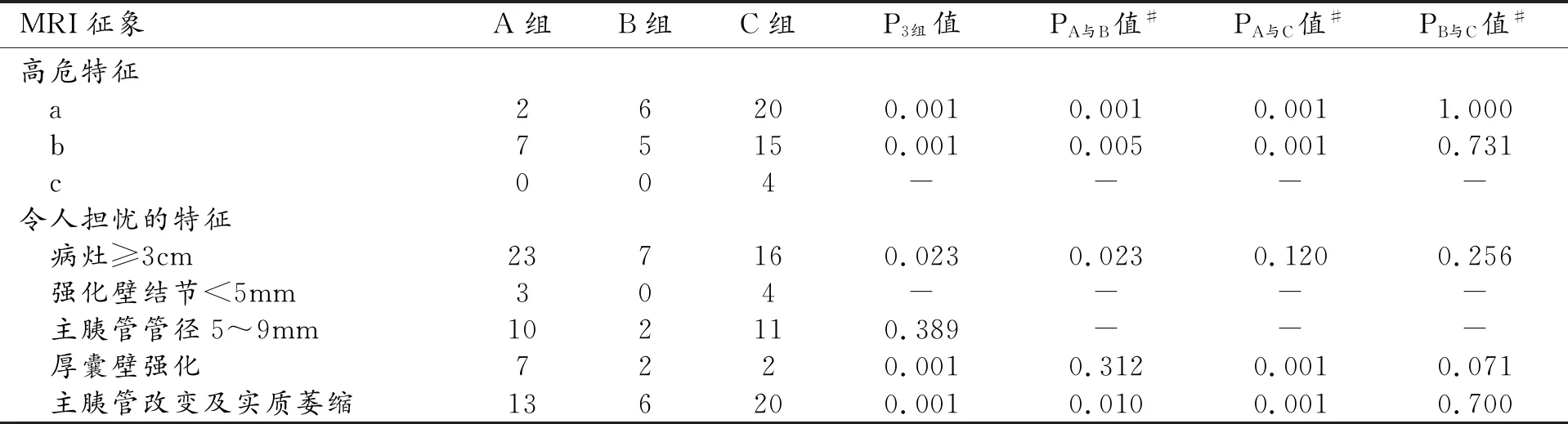
表2 三組IPMNs的MRI表現 (例)
注:#R×C列表Fisher精確檢驗進行組間兩兩比較時,檢驗水準α為0.017。
三組患者的主要臨床和病理特征見表1。不同性別間發病年齡的差異無統計學意義(t=0.257,P=0.797)。三組間患者年齡的差異無統計學意義(F=0.862,P=0.425)。

表1 三組患者的臨床及病理表現 (例)
2.胰腺IPMNs的DCE-MRI表現
本研究中IPMNs病灶直徑0.8~10.8 cm,位于胰腺頭部者占51.3%(59/115)。三組病灶的主要DCE-MRI表現及比較見表2。
對“高危特征”的分析:①出現壁結節35例,其中28例表現為可強化壁結節≥5 mm,3組病變分別占7.1%(2/28)、21.4%(6/28)和71.4%(20/28);②本研究中所有患者的主胰管管徑2~29 mm,中位數為4.4 mm,共27例的主胰管管徑≥10 mm,其中重度不典型增生(B組)占18.5%(5/27),浸潤性癌(C組)占55.6%(15/27),值得注意的是在主胰管<5 mm的65例中C組有9例、B組有3例;③4例胰頭病灶伴有梗阻性黃疸,分別為浸潤性癌BD型3例,浸潤性癌MPD型1例。
對“令人擔憂的特征”的分析:①囊性病灶≥3 cm者共46例,其中A組占50.0%(23/46),B組占15.2%(7/46),C組占34.8%(16/46);②可強化壁結節<5 mm者共7例,其中C組有4例,A組有3例;③厚囊壁強化共有29例,以C組多見,占69%(20/29);④主胰管5~9 mm共有23例,C組有11例(47.8%),A組10例(43.5%),B組僅2例(8.7%);⑤出現主胰管改變伴遠端胰腺實質萎縮共39例,多見于C組,有20例(51.3%);⑥腫瘤指標CA19-9升高共27例,以C組多見,有16例,占59.3%(16/27)。
出現胰腺周圍血管侵犯有8例,均為浸潤性癌IPMN。出現十二指腸侵犯的3例及膽總管下段受累的1例,均為浸潤性癌IPMN。由于本研究為回顧性分析,無法獲得囊性病變的增長速度。本次研究中未發現患者出現淋巴結腫大及遠處轉移等情況。
在可強化壁結節≥5 mm、主胰管≥10 mm、主胰管突然改變伴有胰腺實質萎縮這3個征象上,A組分別與B組和C組間的差異有統計學意義(P<0.017)。主胰管管徑(5~9 mm)、囊性病灶≥3 cm這2個征象在3組間的差異無統計學意義(P>0.05)。腫瘤指標CA19-9升高及厚囊壁強化這2個特征在A組與C組間的差異有統計學意義(P<0.017)。在本研究中“令人擔憂的特征”和“高危特征”在B組與C組間的差異均無統計學意義(P>0.017)。由于本研究中出現胰頭部囊性病灶伴有梗阻性黃疸者僅4例,可強化壁結節<5 mm僅有7例,出現胰腺周圍血管、十二指腸以及膽總管下段受累的病例也較少,統計誤差過大,故未進行統計學分析(表2)。
討 論
1.IPMNs概述
IPMNs是一組不同細胞異型性程度癌前病變,以往研究常常將重度不典型增生以及浸潤性癌IPMN認為是“惡性”腫瘤,但是兩者的術后復發率有所不同[7]。有必要將重度不典型增生IPMN和浸潤性癌IPMN分開進行評估,對手術預后有一定的提示。IPMNs治療方式選擇有很大爭議,從保守觀察隨訪、局部剜除術、胰腺節段切除術到全胰腺切除等有不同治療方案[8-10],Puri等[11]發現對于胰腺囊性腫瘤治療, 20%的患者可能存在過度手術治療。因此,準確評估IPMNs的惡性潛能十分重要。IPMNs好發于中老年男性,并且男女比例約為2∶1[2],年齡在性別方面、不同異型性的IPMNs中無差異。臨床表現主要為腹痛、慢性胰腺炎急性發作、黃疸、腹瀉和體重減輕等,另外因為常規體檢發現胰腺占位或腫瘤指標CA19-9升高進一步檢查發現[2]。
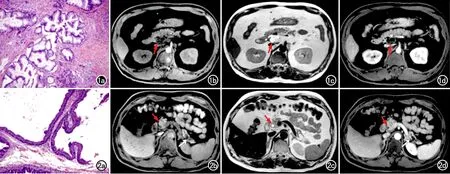
圖1 輕度不典型增生IPMN患者,男性,69歲。a)病理圖鏡下示導管上皮細胞呈單層排列,細胞核小而均勻,僅有輕微的異形性,胞漿內可見黏液(×100,HE);b)橫軸面脂肪抑制T1WI,顯示囊性病灶位于胰腺頭部,呈低信號(箭);c)T2WI示病灶呈高信號(箭),其內有低信號分隔;d)增強掃描門脈期示囊性成分未見強化(箭)。 圖2 中度不典型增生IPMN患者,男性,59歲。a)病理圖鏡下示導管上皮增生呈乳頭狀,細胞呈復層排列,極性消失,細胞核增大呈中度深染(×100,HE);b)橫軸面脂肪抑制T1WI,低信號囊性病灶位于胰腺尾部(箭);c)脂肪抑制T2WI顯示囊液呈高信號(箭);d)增強掃描門脈期示囊性成分未見強化(箭)。
2.IPMNs在DCE-MRI上的表現
IPMNs囊性病灶好發于胰腺頭部,若出現梗阻性黃疸時,應警惕IPMNs出現癌變情況,建議手術治療。對于“高危特征”中壁結節的研究,Marchegiani等[12]認為壁結節出現是IPMN浸潤性癌和重度不典型增生最強有力的獨立預測因素,在預測浸潤性癌IPMN起到很大作用。而Watanabe等[13]的研究進一步確定壁結節的閾值,在影像學上當可強化壁結節≥5 mm時,預測為浸潤型癌IPMN的敏感度和特異度分別為94%和87%。本次研究表明可強化壁結節≥5 mm時對于低度~中度不典型增生與重度不典型增生和浸潤性癌的鑒別診斷有一定價值。Sugimoto等[14]研究報道主胰管直徑為7.2 mm是評估為重度不典型增生或浸潤性癌IPMN的最佳臨界值。本研究中主胰管管徑5~9 mm在3組間的差異并無統計學意義;但主胰管管徑5~9mm在IPMNs不同細胞異形性臨界值的確定,還需要下一步研究。
Nguyen等[15]的研究中2/3重度不典型增生或浸潤性癌囊性病灶<3 cm,但認為沒有侵襲性征象時,若出現更大病灶(≥3 cm)則提示重度不典型增生或浸潤性癌IPMN。本次研究中,囊性病灶≥3 cm可用于鑒別的低-中度不典型增生與重度不典型增生和浸潤性癌,但需要關注囊性病灶<3 cm情況。Baiocchi等[16]認為囊壁厚≥3 mm、囊性病灶≥3 cm、出現壁結節是IPMN浸潤性癌的可疑特征,本研究認為厚囊壁強化可用于鑒別低度~中度不典型增生與浸潤性癌。本研究中腫瘤指標CA19-9升高在低度~中度不典型增生組與浸潤性癌組間有統計學差異,這與Kanno等[17]的研究結果類似,他們的多因素方差分析結果顯示腫瘤指標中癌胚抗原(carcinoembryonic antigen,CEA)和CA19-9的升高與浸潤性癌IPMN顯著相關。Sahora等的[18]研究中BD型浸潤性癌IPMN中35%出現CA19-9升高,但他認為該指標不是指導臨床治療的良好指標。本研究中發現影像學特征及CA19-9指標在重度不典型增生與浸潤型癌IPMN的鑒別診斷方面價值有限。
3.本研究的局限性
第一,本研究為回顧性、單中心研究,可能存在選擇性偏倚;第二,重度不典型增生的病例數偏少,需要擴大樣本量繼續觀察驗證結果;第三,病灶的病理切片沒有與影像一一對應。
綜上所述,DCE-MRI對于低度~中度不典型增生與重度不典型增生IPMN和IPMNs惡性潛能的評估具有一定的價值,有鑒別診斷意義的影像學表現主要有強化壁結節≥5 mm、主胰管≥10 mm、主胰管改變伴遠端實質萎縮等。腫瘤指標CA19-9升高對浸潤性癌IPMN有一定的提示作用。但DCE-MRI對于鑒別重度不典型增生與浸潤型癌IPMN的價值有限。

