經心尖植入二代J-ValveTM治療以關閉不全為主的主動脈瓣病變的初步結果
朱鵬 鄭少憶 姜妤 李偲 劉克玄 崔凱 修建成 賓建平
侯曉敏2 騰中華3 陳曌4
南方醫科大學南方醫院1心血管外科,2麻醉科,3心內科,4影像科(廣州510515)
對于以狹窄為主的高危主動脈瓣疾病患者,經導管主動脈瓣植入術(Transcatheter aortic valve replacement,TAVR)已經被證實能夠明顯降低此類患者圍手術期死亡率及并發癥發生率[1-4]。經典的Edwards SAPIEN 和Medtronic Corevalve 生物瓣在國外已經被廣泛使用,但是因為此類瓣膜需要極大的橫向支撐力,在以關閉不全病變為主患者會出現嚴重的瓣膜移位和瓣周漏,因此,對于術前為中度以上關閉不全的主動脈瓣病變或無鈣化患者,美國及歐洲的相關指南并不推薦其接受經股動脈主動脈瓣植入術[5-7]。
隨著以關閉不全為主的高危主動脈瓣疾病患者的不斷增多,傳統外科開胸手術風險過大,臨床迫切需要微創主動脈瓣植入術以降低手術風險。而目前在國內被證實能夠獲得較好治療效果只有J-ValveTM生物瓣,該瓣膜采用獨特的瓣架結合定位鍵設計,能夠允許外科醫生采用二階段釋放方法,在釋放定位鍵后進一步調整生物瓣膜位置及方向,以保證獲得最佳的瓣膜位置,強大的橫向支撐力及穩定縱向支持力確保將瓣膜移位及瓣周漏發生率降到最低[8-9]。因此項技術自2017年獲藥監局批準應用臨床以來,能夠開展的醫院及患者例數均較少,經心尖植入的經驗非常有限,并缺乏相關回顧性臨床研究[10]。我科自2018年6月采用新一代J-ValveTM治療以關閉不全為主的重度主動脈瓣病變患者,獲得良好臨床效果,為了總結介紹筆者使用經驗,特將我科4例患者資料進行回顧性分析總結如下。
1 資料與方法
1.1 一般資料回顧性分析2018年6月至2019年1月在南方醫科大學南方醫院心血管外科4例接受經心尖主動脈瓣植入手術患者的資料。其中,男3例,女1例;年齡72 ~82 歲;體質量37 ~76 kg。所有患者術前均出現左心功能不全癥狀,經系統改善心功能內科治療3 個月無效,歐洲心臟手術危險評估系統評分(EuroSCOREⅡ)為3.7% ~15%。所有患者術前超聲心動圖均提示為重度主動脈瓣關閉不全,2例伴有輕中度主動脈瓣狹窄,1例伴有中重度主動脈瓣狹窄。3例患者為竇性心律,余1例為高度房室傳導阻滯;1例伴有輕到中度二尖瓣關閉不全。1例既往接受冠脈搭橋術、3例合并高血壓、2例合并糖尿病、2例有腦卒中病史、1例合并慢性肺部疾病、1例患者為肺癌化療術后、1例為前列腺癌術后(表1)。J-valveTM自2017年已經被中國食品藥品管理局批準應用于臨床使用。本研究已經獲得南方醫科大學南方醫院倫理委員會批準,相關研究數據均由患者及家屬均簽署相關知情同意書后進行分析。

表1 患者基本資料Tab.1 Patient′s basic database
1.2 術前常規評估所有患者均接受常規實驗室檢查和三維CT、超聲心動圖評估[11-13]。實驗室檢查包括血常規、尿常規、腎功能、肺功能。心電圖、腹部及外周血管超聲也為常規檢查項目,必要時可行神經系統功能篩查。所有患者術前均需接受三維CT 評估,采用回顧性心電門控采集全心動周期心臟全容積CT 圖像,胸腹及外周血管區域采用非心電門控采集方式,評估內容主要包括主動脈瓣瓣環及瓣膜形態、冠狀動脈和最佳X-Ray 造影投射角度(圖1)。經胸超聲心動圖評估內容包括瓣膜形態及返流程度、跨瓣壓差、心臟結構及功能、評價心臟合并其他疾病。
1.3 手術過程所有手術均于介入導管室內進行。手術之前介入導管室經嚴格消毒,經感染管理科檢驗合格后方可開展手術。患者入室后取仰臥位,首先麻醉醫師進行手術前麻醉誘導,通常采用靜脈加吸入復合麻醉方式,并于右頸內靜脈或右鎖骨下靜脈植入深靜脈導管。心內科介入醫師通過右頸內靜脈或右腋靜脈在DSA 引導下,穿刺后植入心內膜臨時起搏導線至右心室尖端,測試起搏閾值,明確臨時起搏器功能。
麻醉誘導成功后,超聲科醫師經口植入經食道超聲心動圖探頭后再次評估心臟結構及功能,尤其是主動脈瓣瓣環及形態,對經胸超聲心動圖的診斷進一步補充。ECMO 和體外循環組人員于導管室外備用。
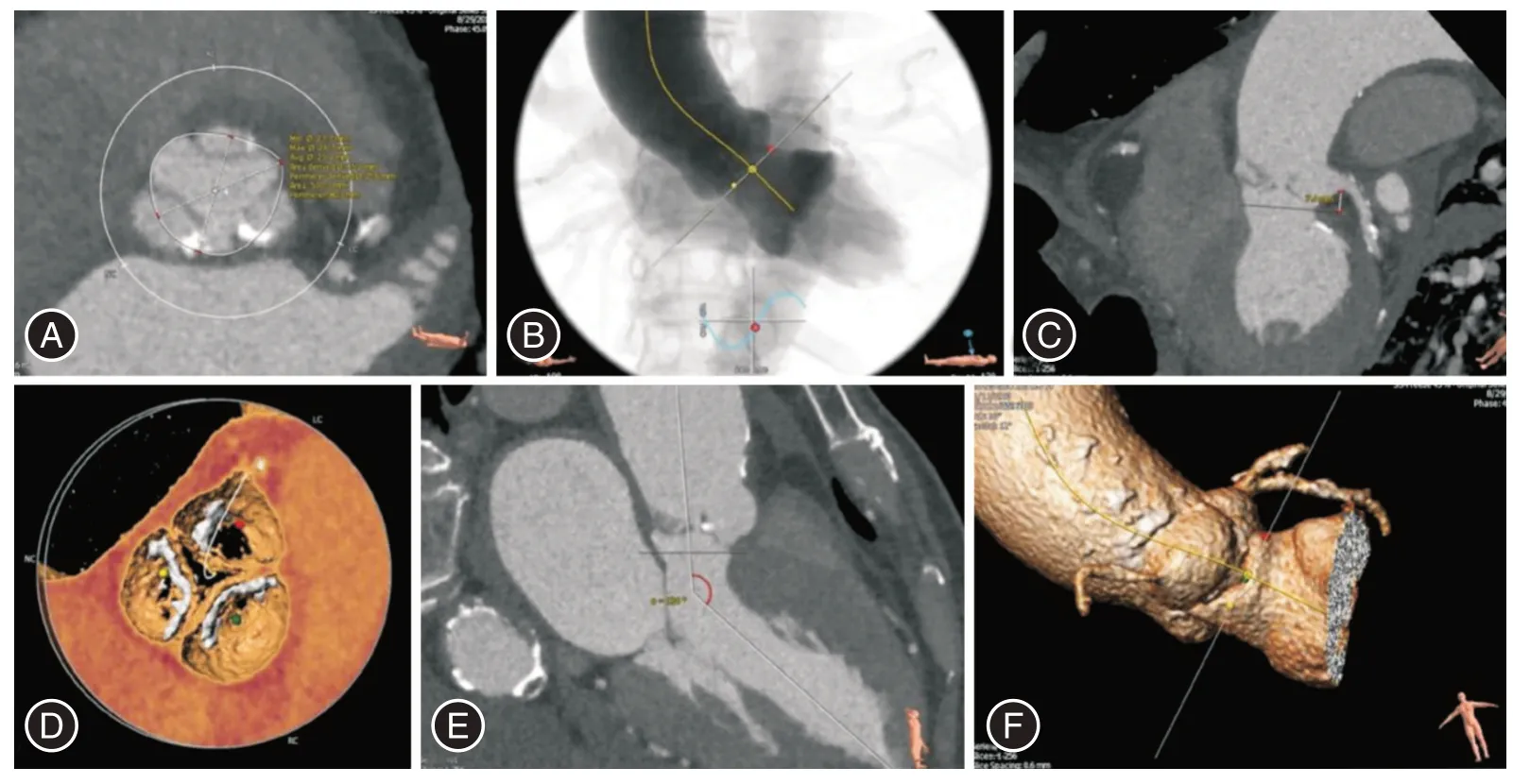
圖1 術前螺旋CT 對主動脈根部評估Fig.1 Preoperative spiral CT assessment of aortic root
手術醫生在DSA 下確定心尖位置及所在肋間。常規外科消毒,鋪無菌治療巾,暴露左前胸及雙側腹股溝區。先選擇右股動脈,Seldinger′s 法植入5F 鞘管,將5F 145°豬尾造影導管在DSA 引導下植入至主動脈瓣瓣竇水平,頭部進入右冠竇或者無冠竇,并造影確定主動脈瓣瓣環水平及兩側冠狀動脈開口。手術切口由DSA 下確定心尖位置決定,本組所有患者均在左鎖骨中線與腋前線之間第5 肋間平行肋骨切開約4 cm,逐層切開入胸并仔細止血,切開心包并懸吊,暴露左心室裸區。全身肝素化,于左心室裸區采用雙層3-0 Prolene 帶超大氈墊片行荷包縫合。術前通常根據經三維CT 測量的虛擬瓣環數值,結合具體瓣膜廠家推薦值來決定術中所用J-ValveTM生物瓣膜尺寸,所有輸送系統與瓣膜的裝配由專業人員在另一操作臺巨大冰水槽中進行組裝。采用改良Seldinger 法穿刺心包裸區,并將超滑導絲通過主動脈瓣,確認其進入降主動脈膈肌以下。通過導絲采用18F COOK擴張鞘擴張左心室穿刺部位二次。超滑導絲交換為COOK 超硬導絲,J-ValveTM輸送系統沿著超硬導絲進入左心室,并在DSA 引導下通過主動脈瓣進入升主動脈。先釋放3 枚定位鍵,經超聲心動圖確認定位鍵分別進入3 個主動脈瓣瓣竇,回撤輸送系統將支架瓣膜定位在主動脈瓣環水平,輸送系統保持持續回撤力以抗衡左心室前向血流沖擊。根據實時血壓及患者術前心功能情況決定是否需臨時起搏器快速起搏,緩慢釋放支架瓣膜(圖2)。瓣膜完全釋放后,緩慢回撤輸送系統,將其撤出患者體內,經食道超聲心動圖評估支架瓣膜位置、功能、血流速度、跨瓣壓差、形態和瓣周漏情況,根據瓣膜形態及瓣周漏情況決定是否需球囊擴張。實時監測心電圖,瓣膜釋放后是否出現房室傳導阻滯。導絲撤出后打結荷包縫線,魚精蛋白中和肝素后常規留置胸腔引流管,常規關胸[9-10,14-16]。
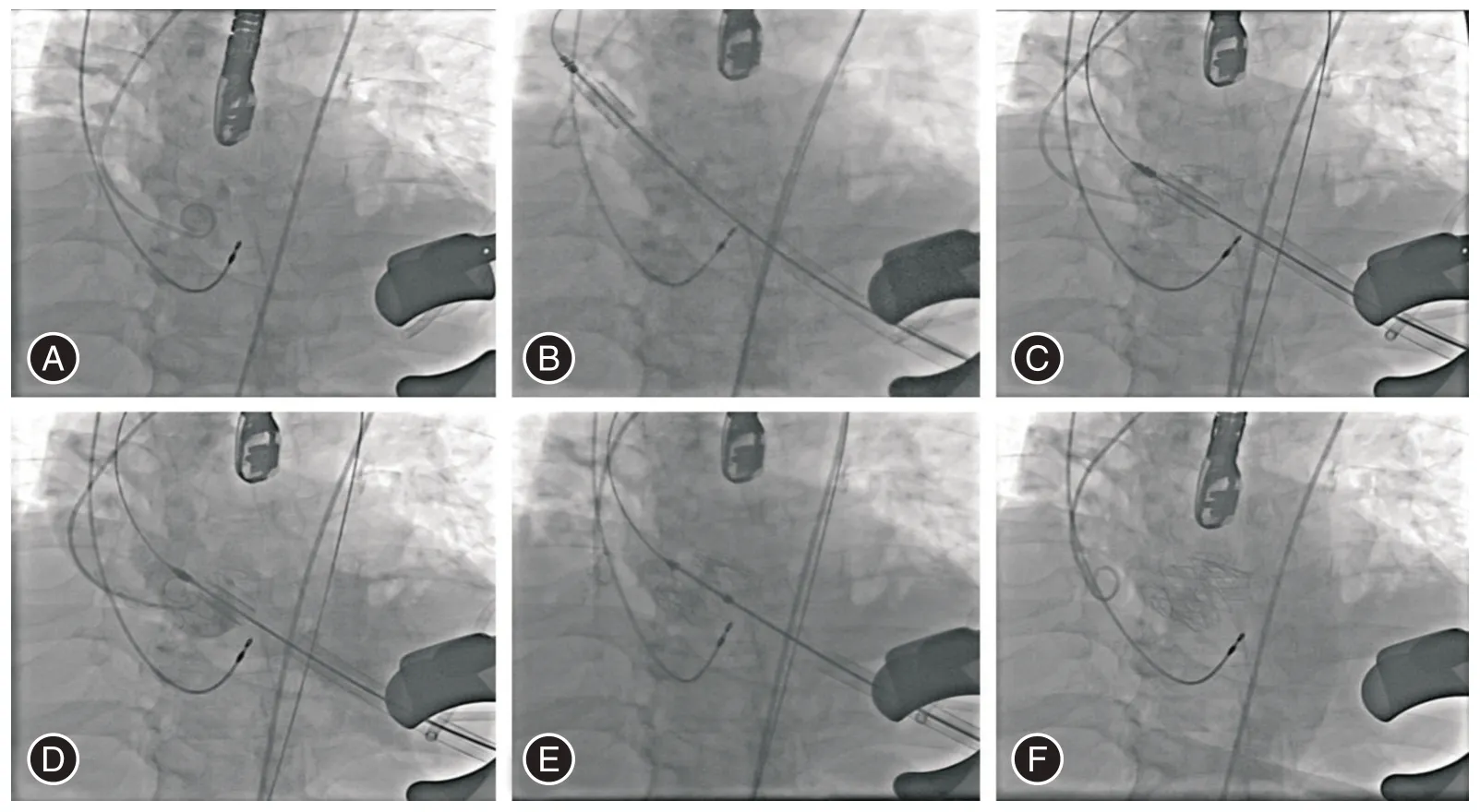
圖2 在DSA 下經心尖主動脈瓣植入步驟Fig.2 Trans-apical aortic valve implantation procedure under DSA
1.4 統計學方法此為納入4例研究對象的描述性研究,未進行相關的歸納性對比分析。所有的統計數據以SPSS 22.0 軟件完成,所有的計量資料以均值±標準差表示。
2 結果
2.1 術后一般資料所有患者手術均獲得成功,術中植入25 mm 生物瓣3 枚,27 mm 生物瓣一枚。術后主動脈瓣跨瓣壓差明顯降低[(63.55± 13.89)vs.(7.9 ± 5.99)]mmHg(1 mmHg = 0.133 kpa)。患者返回重癥監護室后均于24 h 內脫離呼吸機,監護室停留天數(2.13 ± 0.65)d,所有患者胸腔引流液量在100 mL 以內。術前為高度房室傳導阻滯的1例患者術后出現長RR 間期,為保證患者安全預防性植入永久心臟起搏器,其余3例無明顯心律失常。瓣膜釋放后出現輕微瓣周漏2例,給予魚精蛋白中和后均消失。所有患者術后無猝死、瓣膜移位、心包填塞、急性冠脈綜合征、腦卒中等并發癥,恢復順利,近期臨床效果顯著。出院時患者心功能均恢復至NYHAⅡ級以上。
2.2 隨訪結果所有患者于出院前、術后2 周、1 個月和6 個月均接受經胸超聲心動圖、胸部X 平片、常規12 導聯心電圖及凝血功能檢查。所有患者術后常規口服華法林至少6 個月,保持國際標準化比值在2.0 ~3.0[16]。
3 討論
根據目前最新的瓣膜外科指南,經皮主動脈瓣植入術已經被推薦應用于高危乃至中危的以主動脈瓣狹窄為主的主動脈瓣疾病患者,在歐洲及北美接受此種手術方式的主動脈瓣患者逐年增多[7,17]。但是,對于主動脈瓣關閉不全的患者此種方式并未被廣泛接受。自2013年開始,國外多項研究的結果表明目前歐美國家所采用的Edwards SAPIEN 和Medtronic Corevalve 瓣膜均因為植入后無法準確和持續錨定而導致瓣膜移位及瓣環破裂而被嚴格限制使用[18-20]。即使采用超過患者主動脈瓣瓣環過大瓣膜、瓣周漏及傳導阻滯高發生率也不能被臨床醫生所接受[21-22]。
新一代J-ValveTM生物瓣自2017年經歷三期臨床試驗被批準用于臨床,其是一款具有獨特定位鍵設計的自膨式可壓縮新型的豬生物瓣。定位鍵的設計主要根據主動脈瓣瓣竇解剖特點,并使之具有良好的縱向支撐力,三個定位鍵之間保持120 度間隔,當定位鍵準確進入主動脈瓣瓣竇時,生物瓣即在目標瓣環水平,輸送鞘可以反饋一定張力,使外科醫生能夠準確把握生物瓣與瓣環之間關系,降低該款瓣膜釋放難度。定位鍵另外一個獨特的特點在于,將患者病變瓣膜夾持在定位鍵與生物瓣之間,無論冠脈開口高度,均能保證冠狀動脈開口不被生物瓣釋放后受到擠壓的自身瓣膜所遮擋。傳統的經股動脈植入生物瓣在瓣膜完全釋放后,將患者自體瓣膜推擠至瓣竇側,影響左右冠狀動脈開口血流,容易術中引起冠狀動脈血流受阻,而J-ValveTM瓣膜獨特定位鍵杜絕手術過程中急性冠脈事件的發生[9,14]。
與同類產品相比較,J-ValveTM輸送系統具有獨特的二階段釋放方式,傳統經股動脈植入生物瓣,在瓣膜開始釋放后即無法改變釋放角度,而J-ValveTM輸送系統,當旋轉輸送鞘釋放定位鍵后,仍然保持瓣膜壓縮在鞘管內,即使是二葉畸形的復雜病變在DSA 下通過上下、左右旋轉輸送鞘多次定位,并盡量保持輸送鞘與左心室長軸的同軸性,也可以獲得最佳釋放角度[14]。
由于J-ValveTM生物瓣采用的是豬的瓣葉,因此目前獲得生物瓣直徑無超過29 mm,所以目前主要針對術前三維CT測量主動脈瓣瓣環直徑在19 ~26 mm之間的患者[23]。術中使用的生物瓣直徑均超越測量直徑5%~10%,但本組4例均無J-ValveTM生物瓣植入后直接出現高度房室傳導阻滯情況,1例患者術前即為高度房室傳導阻滯,術后經心臟團隊評估植入永久心臟起搏器以獲得最佳治療效果。
4例經心尖植入主動脈瓣手術順利完成表明此技術應用于高危以關閉不全的主動脈瓣疾病患者的可行性,技術相對簡單。其關鍵在于對患者術前心臟團隊評估,包括術前三維CT 和心臟超聲[12-13]。尤其是術前三維CT 對主動脈瓣根部及周圍結構的重建,必要時可進行3D 打印以增加心臟團隊的對主動脈瓣根部主觀認識。術中采用生物瓣的尺寸在一定程度上決定可能出現房室傳導阻滯和瓣周漏的發生率。心臟團隊在術前即制定最佳釋放角度和瓣膜大小。所有的治療過程均由心臟團隊完成,該心臟團隊包括心臟外科醫生、心臟內科醫生、麻醉醫生、影像科醫生、超聲科醫生、造影技師、手術護理團隊[22]。相應科室醫生及護士均需熟悉及明確在診療過程中自身分工和責任,術前根據患者具體情況仔細分析其圍手術期可能出現風險,及時告知并經團隊討論制定針對性解決方案。對于所有參加手術的人員、設備、耗材術前必須反復確認并預備應急預案,制定出現特定情況的搶救方案以獲得最佳治療效果。
目前采用新一代J-ValveTM已經在全國31 個省市一百多家醫療單位開展,總體例數超過300例,但相關經驗總結報道較少[14]。本研究僅為納入4例患者的非隨機對照觀察研究。最長患者隨訪時間僅為10 個月。進一步研究將納入更多患者和增加隨訪時間。
綜上,本研究進一步明確采用新一代J-ValveTM經心尖植入生物瓣系統治療以關閉不全為主的主動脈瓣疾病高危患者的可行性,其簡單操作方式及良好的早期結果可能使其適應癥進一步擴大到中危患者。為了進一步證實該新技術的可行性及實用性,需要納入更多患者及延長隨訪時間。

