常規腹腔鏡及腹腔鏡超聲下左半肝切除術治療原發性肝癌的臨床療效比較
姚本來,姚立鵬,李曉明,邢福元
(三亞市人民醫院,海南 三亞,572000)
原發性肝癌是指發生于肝細胞或肝內膽管上皮細胞的惡性腫瘤,近年報道顯示原發性肝癌發病率有上升趨勢[1]。目前肝切除術是治療原發性肝癌的主要術式,其中腹腔鏡左半肝切除術具有手術創傷小、術后疼痛輕等特點,已普遍在臨床開展,是治療肝臟惡性腫瘤的常規術式[2]。隨著腹腔鏡技術的進步,各種改良術式也逐漸被臨床報道[3-4]。腹腔鏡超聲(laparoscopic ultrasound,LUS)下左半肝切除術是用于原發性肝癌治療的新型術式,但在大部分醫院開展時間較短,手術難度大[5],也缺乏中長期隨訪報道,臨床需進一步對其治療原發性肝癌的療效進行分析。為此,本研究納入140例原發性肝癌患者作為研究對象,比較分析LUS下左半肝切除術與常規腹腔鏡術式的圍手術期相關指標、并發癥及預后差異,現將體會報道如下。
1 資料與方法
1.1 臨床資料 收集2013年3月至2016年3月我院行左半肝切除術治療的原發性肝癌患者,按照1:1配對,以年齡(±5歲)、性別、左肝腫瘤直徑(±3 cm)為配對條件選擇病例,共納入140例,按手術方法將患者分為觀察組與對照組,每組70例。觀察組在LUS下行左半肝切除術,對照組行常規腹腔鏡左半肝切除術。納入標準:(1)經電子計算機斷層掃描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)及數字減影血管造影檢查,患者均符合原發性肝癌診療規范診斷標準[6];(2)腫瘤病灶局限于左半肝,腫瘤直徑<8 cm;(3)患者均知情同意,愿意接受手術治療;(4)病例資料及隨訪資料完整。排除標準:(1)合并其他原發性惡性腫瘤;(2)嚴重心肺功能不全或對手術不能耐受;(3)已在外院接受肝動脈化療栓塞治療或其他肝臟手術。納入140例患者中男122例,女18例;51~70歲,平均(54.94±11.78)歲。
1.2 手術方法 觀察組:(1)LUS檢查:采用Prosound SSD-3500型超聲診斷儀,選用UST-5536型軟質探頭,頻率7.5 MHz。患者取平臥位,采用靜吸復合全身麻醉,臍下1 cm處做弧形切口,穿刺10 mm Trocar,建立人工氣腹,壓力維持在12~14 mmHg,置入LUS,建立臍平面左右腹直肌外側緣或左右上腹肋緣下檢查通道。依次掃描肝臟膈面與臟面,掃描時應連續逐層進行,以確定術中肝臟切割界限(圖1)。如果病灶位置較深,可調整探頭角度或切斷肝三角韌帶、肝圓韌帶后掃描。(2)手術操作:離斷左肝周圍韌帶,游離肝左葉及肝蒂內第一肝門的血管、肝管、淋巴管(圖2),游離后切斷肝左動脈,暴露門靜脈左支后夾閉切斷,阻斷左半肝入肝血供,懷疑病灶周圍有重要血管或血管變異時可再次行LUS檢查確認。于肝中靜脈左側1 cm處做斷肝的切除線,用可吸收生物夾結扎血管、膽管,再用超聲刀沿切緣由淺入深離斷肝實質,用直線切割閉合器離斷(圖3),將病灶標本由恥骨上切口取出,電凝處理出血點,檢查無出血及膽漏后放置引流管,術畢縫合切口(圖4)。對照組:采用常規腹腔鏡左半肝切除術,術中未行LUS檢查,余手術操作同觀察組,且兩組手術由同一組醫生完成。
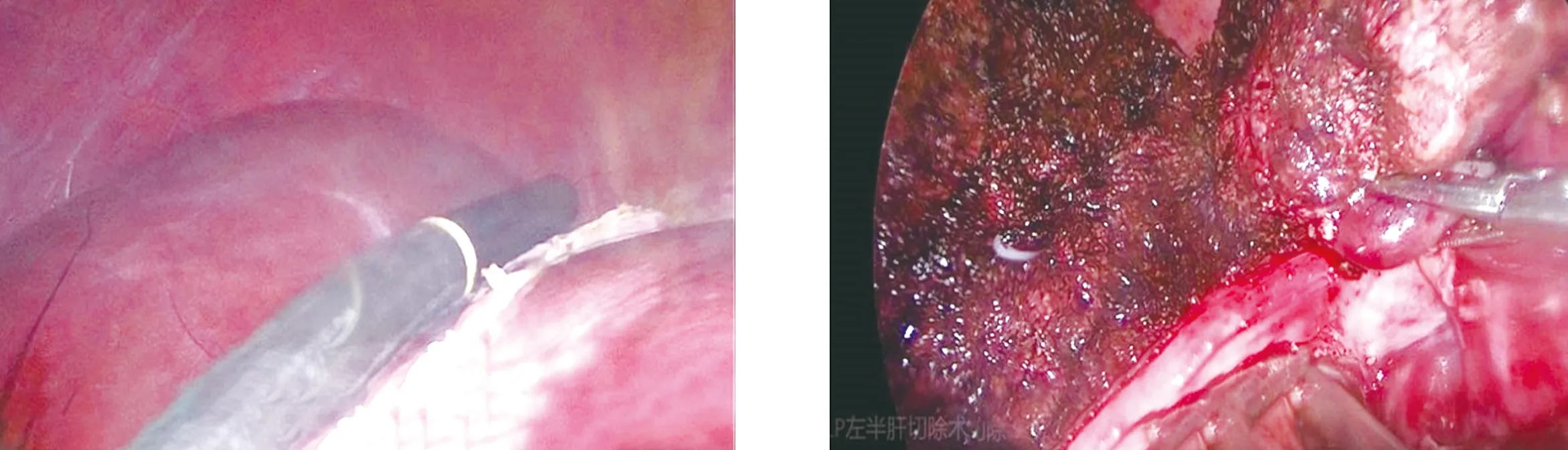
圖1 術中掃描并確定肝臟切緣線 圖2 游離肝左葉及左肝蒂
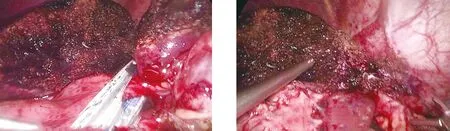
圖3 直線切割閉合器離斷左肝蒂 圖4 檢查有無膽漏、創面出血
1.3 觀察指標及隨訪 記錄兩組圍手術期指標,包括術中出血量、手術時間、病灶切緣距離、肝中靜脈損傷發生率、術后引流管拔管時間、肛門首次排氣時間及住院期間并發癥發生情況。出院后隨訪,前3個月每2周以復診、電話、上門訪視方式至少隨訪一次,后續每3個月至少隨訪一次,每半年入院復診1次。記錄兩組術后3年無進展生存時間及總生存時間。以患者出院至出院后再次入院復診時影像學檢查發現局部復發灶或遠處轉移灶時為無進展生存時間,以患者出院至死亡時間為總生存時間。
2 結 果
2.1 兩組患者基線資料的比較 兩組患者性別、年齡、BMI、腫瘤分期、腫瘤直徑、肝功能分級及術前治療(肝動脈化療栓塞術、肝動脈結扎插管、外放射等)差異均無統計學意義(P>0.05)。見表1。
2.2 兩組患者圍手術期指標的比較 兩組均無中轉開腹,觀察組術中出血量、肝中靜脈損傷率低于對照組(P<0.05),兩組手術時間、病灶切緣距離、術后引流管拔管時間及術后肛門首次排氣時間差異均無統計學意義(P>0.05)。見表2。
2.3 兩組術后并發癥及隨訪生存情況的比較 兩組術后感染(觀察組2例切口感染,1例肺部感染;對照組1例切口感染,1例肺部感染;均經相應治療后痊愈)、胸腔積液、出血、難治性腹水及并發癥總發生率差異均無統計學意義(P>0.05)。觀察組術后失訪2例,死亡25例,無進展生存32例,總生存45例,其中13例隨訪期間接受索拉非尼治療。對照組失訪4例,死亡29例,無進展生存27例,總生存41例,其中11例隨訪期間接受索拉非尼治療。兩組術后3年無進展生存率、總生存率差異均無統計學意義(P>0.05)。見表3。
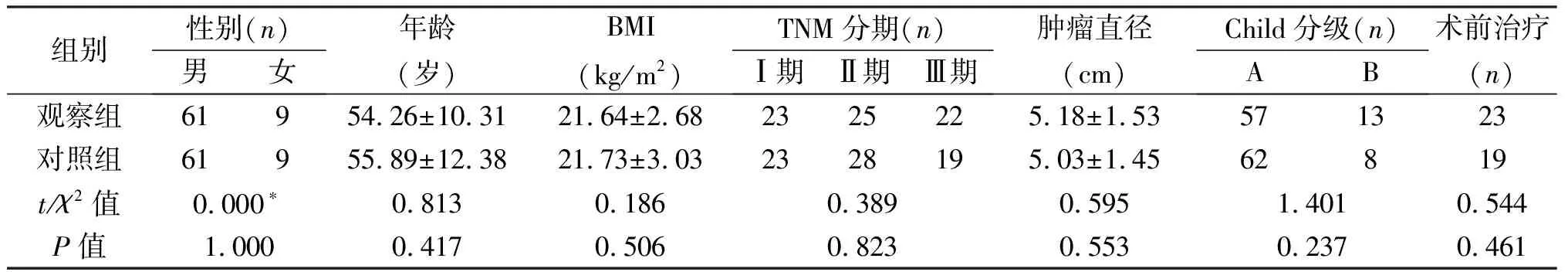
組別性別(n)男女年齡(歲)BMI(kg/m2)TNM分期(n)Ⅰ期Ⅱ期Ⅲ期腫瘤直徑(cm)Child分級(n)AB術前治療(n)觀察組61954.26±10.3121.64±2.682325225.18±1.53571323對照組61955.89±12.3821.73±3.032328195.03±1.4562819t/χ2值0.000?0.8130.1860.3890.5951.4010.544P值1.0000.4170.5060.8230.5530.2370.461
*采用校正χ2檢驗
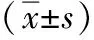

組別手術時間(min)術中出血量(mL)病灶切緣距離(cm)肝中靜脈損傷率[n(%)]引流管拔管時間(d)肛門首次排氣時間(d)觀察組148.30±31.25311.21±59.432.95±1.3105.97±1.353.75±1.01對照組143.48±29.57415.81±88.423.07±0.8210(14.29)6.42±1.774.09±1.43t/χ2值0.9378.2150.6508.723?1.6911.625P值0.350<0.0010.5370.0030.1350.148
*采用校正χ2檢驗
表3 兩組患者術后并發癥的比較[n(%)]

組別術后并發癥術后感染胸腔積液術后出血難治性腹水總發生率術后生存情況無進展生存率總生存率觀察組3(4.29)4(5.71)3(4.29)3(4.29)13(18.57)32(45.71)45(64.29)對照組2(2.86)5(7.14)5(7.14)3(4.29)15(21.43)27(38.57)41(58.57)χ2值0.000?0.000?0.133?0.170?1.6770.7320.482P值1.0001.0000.7160.1790.6730.3920.487
*采用校正χ2檢驗
3 討 論
原發性肝癌是消化系統最常見的惡性腫瘤之一,死亡率居惡性腫瘤的第二位[7],外科手術是延長肝癌患者生存時間的重要治療方法,目前臨床上多采用腹腔鏡手術。LUS將腹腔鏡微創與超聲融合,采用可屈曲軟質探頭全面采集肝臟信息,分辨正常組織與病灶界線,同時明確受檢臟器與周圍組織血管位置毗鄰關系。葛明剛等[8]還認為,超聲能在術中實時引導,避免誤傷重要臟器,并保證病灶完整切除。常規腹腔鏡手術中僅在手術視野下判斷肝切除范圍,可能增加切割線偏移風險,也可能造成肝中靜脈損傷,增加術中出血量。在LUS指引下進行精準斷肝,能降低術中對大血管、分支血管的損傷幾率,減少出血,同時也有助于減少缺血再灌注損傷及胃腸道淤血的風險。本研究結果顯示,兩組術中出血量、肝中靜脈損傷率差異有統計學意義,觀察組優于對照組,未發生因肝中靜脈受損而中轉開腹的病例,這提示LUS可降低血管損傷及出血風險,較傳統腹腔鏡手術安全性更高。
胸腔積液、術后出血是肝切除術后常見并發癥,多因引流管放置不當或過早拔除誘發[9]。本研究中,術后3 d仍有發熱的患者,排除肺炎與肺不張外,應高度懷疑胸腔積液,立即行B超檢查,確診后在B超引導下穿刺引流。此外,本研究中共8例患者術后出血,均發生于肝創面,有學者建議術中對攏縫合,適當增加創面壓力有助于減少術后出血[10-11]。LUS定位肝中靜脈位置精準,在LUS引導下能避免損傷肝中靜脈,降低術后出血風險,而對于肝創面滲血患者,術中可采用超聲刀止血或腔鏡下夾閉止血[12]。本研究中,觀察組術后并發癥發生率略低于對照組,但差異無統計學意義,表明LUS未能降低術后并發癥發生率,這可能與術者操作水平有關。此外,納入病例較少也可能導致統計數據結果產生偏倚。
術后肛門首次排氣時間與引流管拔除時間是衡量患者術后康復效果的重要指標[13],本研究中,兩組術后引流管拔除時間與肛門首次排氣時間差異無統計學意義,提示LUS對術后胃腸功能恢復的影響與常規腹腔鏡手術并無明顯差異。此外,無進展生存時間是評估肝癌治療效果與術后生活質量的重要指標[14]。本研究中,兩組患者術后隨訪生存情況,兩組3年無進展生存時間、總生存時間差異無統計學意義,提示LUS與常規腹腔鏡手術患者的預后無明顯差異。有觀點認為,術中出血是影響手術安全的重要因素,且可降低患者術后免疫功能[15],理論上因出血而播散的殘留腫瘤細胞及免疫功能降低會增加腫瘤復發風險,影響術后無進展生存率。但本研究中,兩組患者無進展生存率、總生存率差異無統計學意義,可能因為觀察時間較短,還需進一步擴大樣本量進行長期隨訪觀察。近年《原發性肝癌診療規范》意見指出分子靶向藥物具有較強的應用價值[7],本研究中兩組患者隨訪期間部分接受分子靶向藥物(索拉非尼)治療,這可能對兩組3年總生存率具有一定影響。但限于分子靶向藥物用藥負擔較高,本研究納入患者尚未廣泛使用。
常規腹腔鏡肝切除術在臨床外科手術中的應用已超過30年,其安全性、療效已得到臨床實踐驗證。總體而言,LUS可為左半肝切除術提供“指引”,減少損傷與出血,提高手術安全性,這與汪磊等[15]的研究結論相似。筆者認為,LUS左半肝切除術成功的關鍵是控制肝臟血流及腫瘤的完整切除,LUS有利于鑒別第一肝門、第二肝門動靜脈血管變異,發現肝動脈與門靜脈之間的側支血管及交通支,明確腫瘤的邊界及其與肝臟血管、膽管的毗鄰關系,從而降低血管、膽管誤損傷的風險,減少術中大失血等并發癥;術中LUS檢查利于術中腫瘤邊界的再次確認及肝內微小病灶的發現,術中可根據LUS檢查結果適當調整切除界限,提高腫瘤完整切除率。此外,腹腔鏡獲得圖像為二維平面圖像,鏡下視覺信息不如開放手術充分、真實,LUS則可增強鏡下真實感,利于術中操作。需要注意的是,腹腔鏡下肝切除術不但要求術者具備熟練的鏡下操作技術,還需要良好的超聲檢查技術與判斷技巧,初學者存在一定的學習熟練過程,如不熟練,反而延長手術時間,也無法發揮LUS的引導優勢。本研究中主要手術參與者具備3年以上腹腔鏡肝切除術的操作經驗,均在超聲科再學習1~3個月,熟練掌握后再參與手術,這可能是本研究中兩組手術時間差異不明顯的原因之一。
綜上,LUS下行腹腔鏡左半肝切除術治療原發性肝癌療效確切,與常規腹腔鏡手術治療原發性肝癌的生存情況相近,但LUS有助于減少術中肝中靜脈損傷及術中出血,臨床推薦應用。

