TGF-β2表達水平與肺腺癌患者預后的關系
趙麗 章淑芳 周楊 范麗丹 青艷 張莉涵
肺癌發病率及死亡率均位于惡性腫瘤第一位,全球數據顯示,每年因肺癌死亡患者約150萬人,死亡率高達25%以上[1]。肺癌依據其病理類型分為小細胞肺癌和非小細胞肺癌,其中非小細胞肺癌患者占總數85%左右[2]。非小細胞肺癌包括大細胞癌、鱗狀細胞癌、腺癌、腺鱗癌等。肺腺癌(Lung adenocarcinoma ,LAD)的發生率占肺癌總數的30~35%[3],每年全球因LAD死亡人數約50萬人。雖然ALK、EGFR-TKI等靶向藥物給這些敏感基因突變的LAD患者帶來生存獲益,但是對于無敏感基因突變的進展期LAD患者生存時間仍然較低,因此仍需要發現更多有效的治療靶點,使進展期LAD患者能有更多有效的治療方案,延長患者的生存時間。
Oncomine數據庫是目前的癌癥相關基因數據庫,該數據庫包含GEO、TCGA、癌癥基因芯片及已發表的研究數據,并整合數據挖掘平臺,能在線進行基因差異性表達及預后等分析。該數據庫已經有超過715個基因表達數據,86733個癌癥組織和正常組織基因表達數據。利用該數據庫能篩選出常見腫瘤與正常組織中差異表達基因,并且該數據庫中還包括轉移、病例類型、分期及生存時間等,因此對Oncomine充分應用能初步挖掘出某癌癥的相關基因,不僅可作為后期實驗研究的數據支持,還能節約研究時間及經費。Kaplan-meier Plotter數據庫包括乳腺癌、卵巢癌、肺癌、胃癌相關mRNA和乳腺癌相關miRNA與預后的分析。
轉化生長因子-β(Transforming growth factor‐β,TGF-β)是一種參與細胞多種生物學過程的細胞因子,其主要作用于內皮細胞,參與內皮細胞增殖、凋亡、彌散以及血管內皮形成等(10.1038/cr.2008.326)。TGF-β有三種分子亞型包括TGF-β1、TGF-β2、TGF-β3,TGF-β蛋白受體有兩種類型激酶受體(TGFβRI、TGFβRⅡ),通常情況下TGFβRⅡ受體與其配體結合后使TGFβRI 磷酸化,進而激活下游信號通路,例如ALK、Smad2/3等[4]。研究顯示TGF-β1主要作用于血管內皮生長因子,促進血管出芽誘導血管生成[5],目前關于TGF-β2的認識尚缺乏,有學者認為TGF-β2能降低血管內皮生長因子-2的表達,抑制血管內皮細胞生長[4],不僅如此,TGF-β2還可能與血管內皮細胞遷移有關。研究發現TGF-β2通過上調SNAIL、鋅指轉錄因子,促進內皮細胞間質轉化(Endothelial-mesenchymal transition , EndMT),EndMT過程與上皮間質轉化(EMT)密切相關,而EMT是腫瘤細胞發生轉移的重要機制,因此猜測TGF-β2可能與腫瘤的發生發展相關,本研究將通過Oncomine數據庫篩選與肺腺癌相關的基因,并結合Kaplan-meier Plotter計算TGF-β2與肺腺癌生存時間的相關性,旨在了解TGF-β2與肺腺癌預后的關系,為肺腺癌治療靶點提供新選擇。
資料與方法
一、數據來源與提取
本研究首先在Oncomine(https://www.oncomine.org/resource/login.html )數據庫中用以下檢索詞進行檢索:“Cancer type:lung adenocarcinoma cancer”;“Gene:TGF-β2”;“Date type:All”;Analysis type:Cancer vs Normal Analysis;臨界值設定為:P value<0.05,fold change>2,gene rank=all。再檢索Oncomine數據庫中TGF-β2與肺腺癌患者生存時間相關性數據,對數據進行提取,整合,結合Kaplan-meier Plotter(https://www.kmplot.com.analysis)數據庫進行生存分析。Kaplan-meier Plotter數據庫檢索條件為:Cancer:lung cancer,Pathological type:adenocarcinoma;Gene:TGF-β2;Split patients by:Auto select best cutoff;Survival:OS;Follow up threshold:All。總生存時間(overall survival,OS)定義為入組觀察至任何原因所致死亡時間。
二、統計方法
本研究采用Kaplan-Meier Plotter數據庫和SPSS 23.0進行數據分析。采用均數±標準差(x±s)描述TGF-β2基因的表達量,其在正常組織與肺腺癌組織的差異分析采用獨立樣本t檢驗。采用Kaplan—Meier法分析TGF-β2表達與肺腺癌預后的關系,組間比較用Log-rank檢驗。以雙側P<0.05為差異有統計學意義。
結 果
一、TGF-β2在實體腫瘤中表達結果
Oncomine數據庫中關于TGF-β2在惡性腫瘤與正常組織表達量的研究有456個,其中44個研究中TGF-β2在腫瘤組織中表達顯著上升,34個研究結果顯示TGF-β2表達下降,5個肺癌的研究數據顯示TGF-β2在腫瘤組織中表達降低(見圖1)。

圖1 Oncomine數據庫中TGF-β2在腫瘤中表達差異
利用Oncomine數據庫進行薈萃分析發現TGF-β2在肺癌中差異性表達,且位于所有差異基因第1537位,P=1.25E-8(見圖2)。分別提取5項研究原始數據匯總分析,結果顯示,TGF-β2在正常肺組織中表達水平為0.151±0.21,肺癌組織中表達量為-2.031±0.32,對比正常肺組織,TGF-β2基因在肺癌組織中表達降低P<0.0001(見圖3)。剔除非腺癌研究數據,TGF-β2在正常肺組織與肺腺癌組織中表達量分別為0.597±0.17、-1.529±0.29,肺腺癌組織中TGF-β2表達顯著降低P<0.0001(見圖4),Oncomine數據庫進行薈萃分析結果顯示TGF-β2位于肺腺癌差異基因排序的第1592位,P=0.007(見圖5)。

圖2 Oncomine數據庫中TGF-β2在肺癌組織表達差異
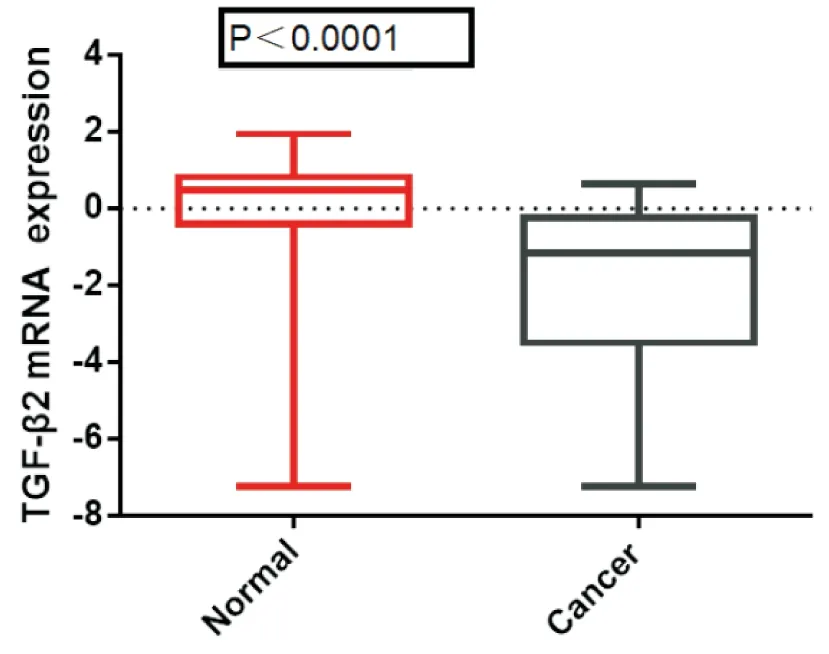
圖3 TGF-β2在肺癌和正常肺組織中表達差異
二、TGF-β2在肺腺癌中表達差異
結合4項研究箱圖數據顯示:TGF-β2在腫瘤組織中表達低于正常肺組織(見圖6)。
三、TGF-β2表達與肺腺癌預后的關系
為了進一步研究TGF-β2表達是否影響肺腺癌患者生存時間,我們將Oncomine數據庫中Beer DG[6]等人研究的生存時間的數據進行收集、整理(提取的原始數據見附錄1),該研究總納入85例肺腺癌患者,TGF-β2表達中位表達量為-2.59,我們設定為表達量高于中位數為高表達,其中高表達患者43例,低表達42例;中位隨訪時間為30.6m(2.4~110m)。統計分析顯示TGF-β2高表達患者生存時間更長(HR=0.43,95%CI:0.21~0.89,P=0.02)(見圖7)。然后我們從Kaplan-meier Plotter數據中提取TGF-β2與患者總生存時間的關系,對TGF-β2與肺腺癌患者生存時間進行統計分析,并繪制生存曲線圖,結果顯示TGF-β2高表達的肺癌患者OS略優于低表達患者(HR=0.83,95%CI:0.73~0.94,P=0.0029),且這種生存優勢在肺腺癌患者中更加明顯(HR=0.46,95%CI:0.34~0.61,P<0.0001)(見圖8)。
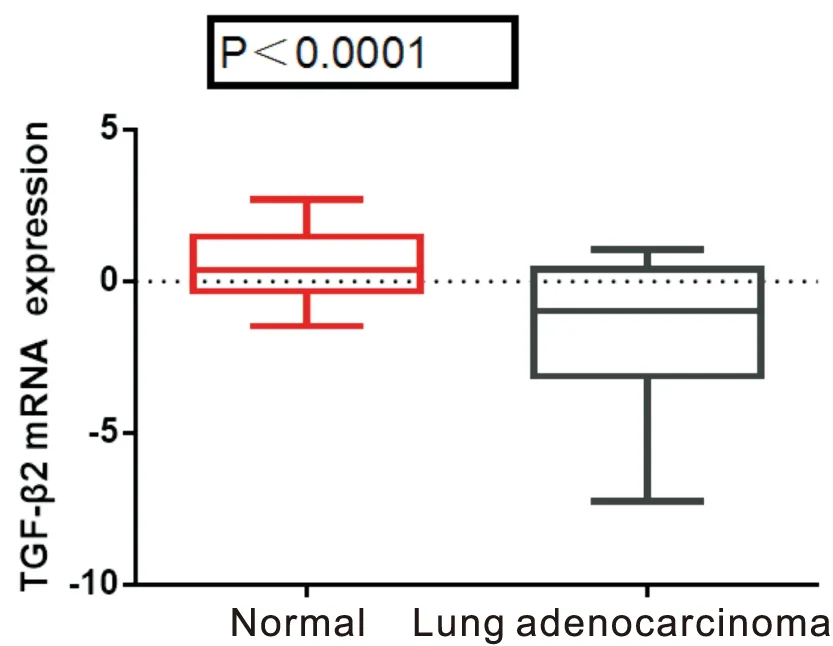
圖4 TGF-β2在肺腺癌和正常肺組織中表達差異

圖5 Oncomine數據庫中TGF-β2在肺腺癌中表達差異
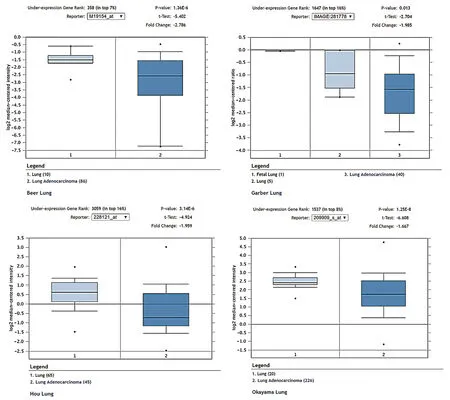
圖6 TGF-β2在肺腺癌與正常組織表達差異
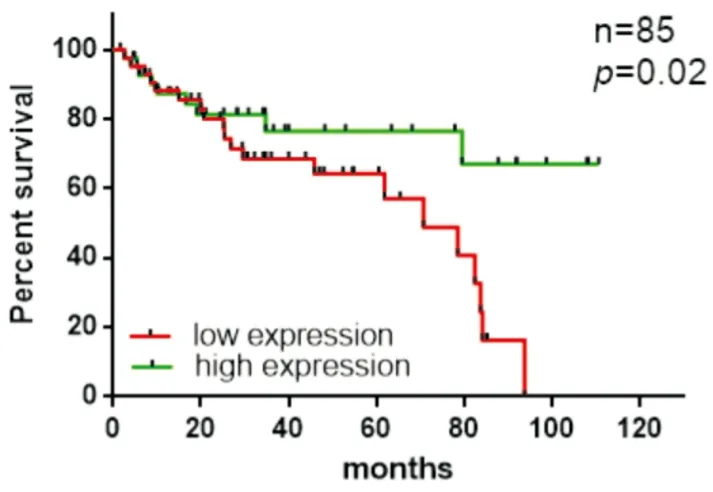
圖7 TGF-β2表達量與肺腺癌患者預后的關系
討 論
一直以來,肺癌的發生率及死亡率居高不下,嚴重威脅人們的生命健康,我國每年新增肺癌病例將超過100萬人,發病人數位居世界首位[7],肺腺癌更是肺癌中主要的病理類型。盡管EGFR、ALK等基因突變的肺腺癌患者能從靶向藥物中獲益,但是僅有70%~80%肺腺癌患者有敏感基因突變,仍有一部分無驅動基因或敏感基因靶向治療耐藥的患者預后較差,總體來說,我國肺癌患者5年OS僅10%~15%,因此仍需要積極探索新的分子標志物及治療靶點。
TGF-β家族具有復雜的生物學功能,包括細胞增殖、分化、凋亡、免疫應答及損傷修復等過程。研究數據發現TGF-β對血管的生成有至關重要的作用,主要體現在以下方面:1)TGF-β誘導免疫細胞、纖維母細胞等聚集,后者釋放出大量促進血管生成的細胞因子;2)TGF-β1直接誘導成纖維細胞表型發生改變,促進血管內皮生長因子表達;3)TGF-β能與GATA 6啟動子結合,進而促進血管內皮細胞功能[8]。TGF-β家族配體與受體結合后(TGF-β I型受體及Ⅱ型受體),激活信號通路發揮生物學功能。但是有研究報道TGF-β2與血管內皮生長因子、堿性成纖維細胞生長因子等一起促進血管生成,進而參與眼部新生血管性疾病的發生[9]。McDowell 等[10]發現TGF-β2能激活Smad信號通路誘導細胞外基質重塑改變細胞骨架,同時誘導細胞外基質相關蛋白表達水平。不僅如此,TGF-β2還可能與上皮細胞增生和上皮間質轉化相關:經TGF-β2刺激后晶狀體上皮細胞增生受到明顯抑制,隨著TGF-β2濃度及時間的增加其抑制作用更加明顯[11]。TGF-β2還能激活Notch信號通路,進而誘導視網膜色素上皮細胞發生間質轉化[12]。
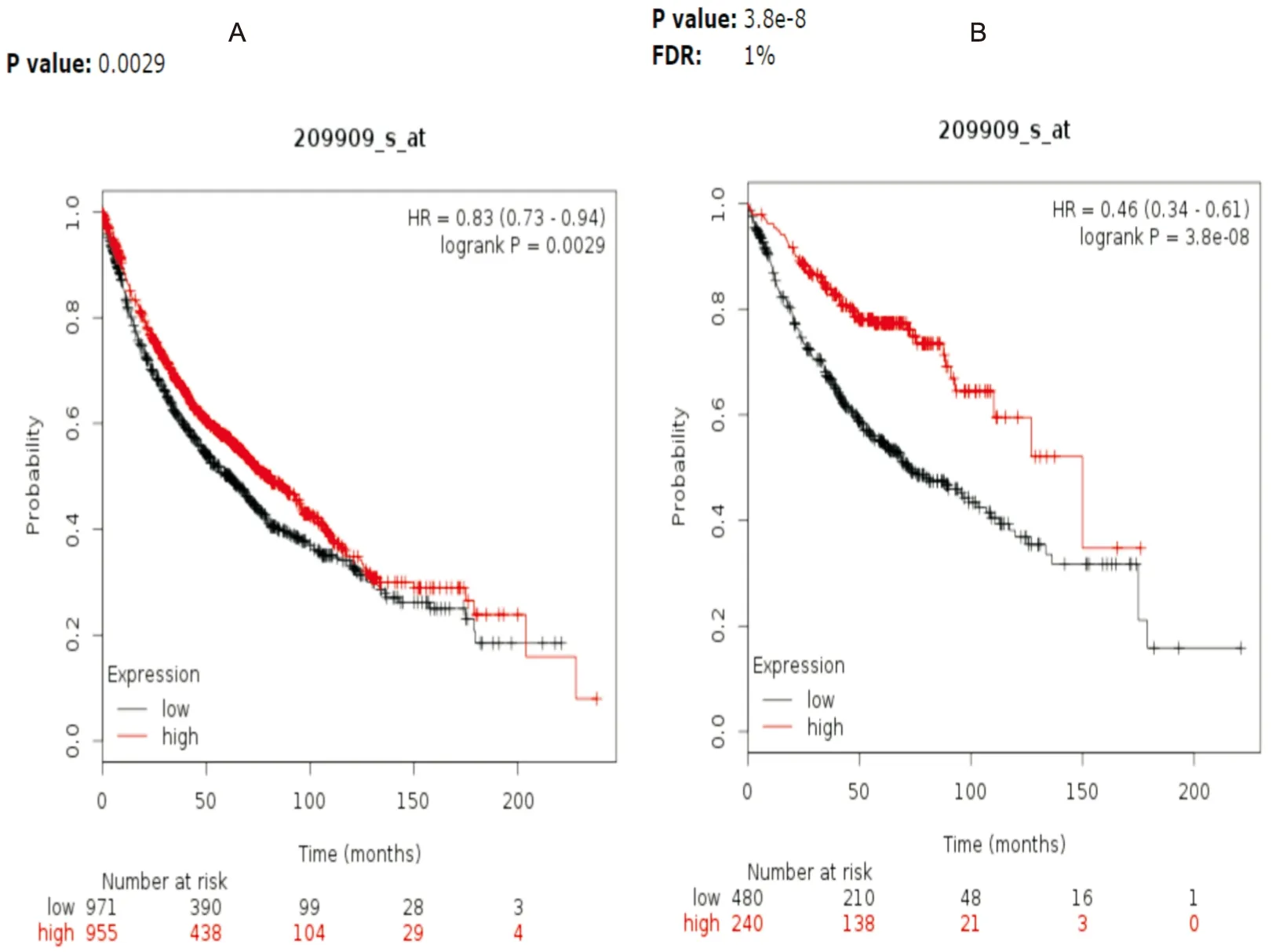
圖8 KMP數據庫中TGF-β2表達水平與肺癌患者OS的關系
上皮間質轉化與腫瘤的發生發展密切相關,因而猜想TGF-β2可能在腫瘤中發揮重要的生物學功能,但TGF-β2對腫瘤的作用存在較大爭議,研究發現TGF-β2與高級別膠質瘤發展相關,最初認為其作為膠質母細胞來源的T細胞抑制因子,與膠質母細胞瘤患者免疫抑制相關,因此TGF-β2高表達膠質瘤患者疾病分期更晚及預后較差[13],同樣,張東勇等[14]發現在腦膠質瘤干細胞中TGF-β2表達水平明顯升高,沉默其表達能顯著降低腦膠質瘤干細胞的侵襲能力,因此他們認為TGF-β2高表達水平可能是腦膠質瘤患者不良預后的危險因素。楊秀華等[15]采用免疫組化檢測30例外陰癌患者組織TGF-β2表達水平,他們發現TGF-β2在腫瘤組織中表達水平顯著高于正常組織,且高表達TGF-β2患者更易發生淋巴結轉移。而我們首先檢索Oncomine數據庫中TGF-β2在實體腫瘤中表達水平,包括456個研究數據,其中表達升高的有44個研究,表達降低有34項研究,對比正常肺組織,5項研究結果顯示肺癌組織中TGF-β2表達顯著下降,無表達上升的研究數據,進一步篩選肺腺癌數據支持TGF-β2在肺腺癌組織中表達明顯下調。為了進一步探索TGF-β2表達水平與患者預后的關系,我們結合Kaplan—Meier Plotte數據庫,結果發現TGF-β2低表達肺癌患者總生存時間更短,這一差異在肺腺癌患者中更加顯著,因此TGF-β2低表達是肺腺癌患者不良預后的危險因素。
綜上所述,TGF-β2在肺腺癌組織中表達顯著降低,且其低表達患者預后較差,故TGF-β2有望成為肺腺癌患者評估預后的分子標志物,甚至作為新的藥物治療靶點,給肺腺癌患者提供新的治療手段。雖然本研究利用大數據平臺進行分析,避免了個別小樣本研究數據的偏移,但是缺乏機制研究,TGF-β2是如何影響肺腺癌細胞生物學行為尚不清楚,因此仍需進一步探索。

