番荔枝中一個SWEET家族基因的克隆與表達分析
安振宇 方仁 黃偉雄 堯金燕 韋蒴曈
摘? 要:以番荔枝不同組織樣品為材料,通過基因文庫篩選,利用RT-PCR技術克隆出1個1227?bp的基因,命名為AT-SWEET16-1,該基因編碼408個氨基酸,該氨基酸序列在N端以α螺旋形成THB結構域。生物信息學分析結果表明,該蛋白分子量為44.8?kDa,等電點為8.87。進化分析結果發現其與海棗(Phoenix dactylifera)相類聚。qRT-PCR分析結果表明,該基因在植株的根、莖、嫩葉、老葉、花蕾、花苞、幼果、成熟果中均有表達,AT-SWEET16-1基因在不同組織中的表達量依次是:成熟果>莖>根>花蕾>幼果>老葉>嫩葉;該基因在不同果實發育階段中的表達情況為:在果實不同發育階段,果柄中的表達量最高,果肉、果皮中則相對較低,種子中最低;但果實成熟期該基因在果柄、果肉中的表達量最高。原位雜交實驗觀察發現,基因表達位置為果柄韌皮部、果肉細胞膜間,結合基因表達分析結果,預示該基因在植株糖分積累與轉運等方面起到一定的作用。
關鍵詞:番荔枝;克隆;SWEET基因;表達分析
中圖分類號:S813.3 ?????文獻標識碼:A
Cloning and Expression Analysis of a SWEET Family Gene from Annona squamosa L.
AN Zhenyu1,2, FANG Ren1*, HUANG Weixiong1, YAO Jinyan1, WEI Shuotong1
1. Horticultural Research Institute, Guangxi Academy of Agricultural Sciences / Nanning Investigation Station of South Subtropical Fruit Trees, Ministry of Agriculture and Rural Affairs, Nanning, Guangxi 530007, China; 2. Guangxi Crop Genetic Improvement and Biotech-Nology Lab, Nanning, Guangxi 530007, China
Abstract: The fruit at different stages of Annona squamosa L. was used as the experimental material. A gene named? AT-SWEET16-1 with 1227?bp was cloned by RT-PCR, which encoding 408 amino acids. The amino acid sequence had a α-helix THB domain at the N-terminal. Bioinformatics analysis showed that the molecular weight of the protein was 44.8?kDa, and the isoelectric point was 8.87. Evolutionary analysis showed that it was associated with Phoenix dactylifera). qRT-PCR analysis showed that the gene was expressed in roots, stems, tender leaves, old leaves, flower buds, buds, young?fruit?and?mature?fruit.?The?expression?of?AT-SWEET16-1?gene?in?tissue?was?as?follows:?mature?fruit>stem>root>
flower bud>young fruit>old leaf>tender leaf. The expression of the gene in different fruit development stages was the highest in fruit stalk, relatively low in pulp and pericarp, and the lowest in seed, and the highest expression in fruit stalk and pulp was at fruit maturity stage. It was found that the gene was expressed in the phloem of the fruit stalk and between the cell membrane of the pulp cell wall, indicating that the gene played a role in the progress of the fruit development and the transport of plant nutrients.
Keywords: Annona squamosa L.; cloning; SWEET gene; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.11.001
番荔枝(Annona squamosa L.)原產于熱帶美洲和西印度群島,現廣泛分布于中國臺灣、福建、廣東、廣西、海南和云南等省(區),由于其果實糖分含量較高,每100?g果肉組織中的可溶性固形物含量可高達20%,總糖含量達15.3%~18.3%,因此,深受廣大甜食愛好者的喜愛。糖是生物體內的主要能源物質及代謝底物,與植物的生長、生殖、發育與衰老等生理過程息息相關,來自SWEET家族的糖轉運蛋白在植物生長發育階段會起到調節糖的運輸,從而影響果實糖分的積累。因此,研究番荔枝SWEET基因對糖類的轉運調控機理對于番荔枝果實糖分積累、改善品質等田間栽培調控具有重要的理論意義。
SWEETs是一類新發現的糖轉運蛋白,具有7個跨膜結構域,廣泛存在于原核生物、人類、植物以及動物中。SWEET基因家族的成員數目有所差異,如擬南芥有17個SWEET家族成員,水稻有21個,高粱23個,玉米24個,番茄有29個[1],而大豆的高達52個。不同物種所包括的成員數如此之多,預示著SWEET蛋白功能的多樣性[2-3]。對植物SWEET基因家族的研究發現,SWEET蛋白有4個分支:Clade Ⅰ、Clade Ⅱ、Clade Ⅲ和Clade Ⅳ,其中Clade Ⅰ(SWEET1-SWEET3)為己糖轉運蛋白,功能為轉運葡萄糖;Clade Ⅱ(SWEET4-SWEET8)功能為轉運葡萄糖;Clade Ⅲ(SWET9-SWEET15)功能為轉運蔗糖;Clade Ⅳ(SWEET16-SWEET17)為液泡膜轉運蛋白,功能為轉運果糖[4]。SWEET蛋白通過對多糖類,特別是蔗糖起控制亞細胞定位以及從庫到源的長距離運輸的作用[5]。Madoka等[6]通過對水稻SWEET基因的研究,發現糖的合成與轉運是通過己糖激酶來完成的,它能使葡萄糖和果糖磷酸化,再通過SWEET蛋白的結合以實現糖分的運輸。SWEET蛋白除了參與糖運輸過程,其在植株生長發育、衰老、逆境脅迫、抗病等方面亦起著非常重要的作用[7-8]。本研究以番荔枝‘吉夫納品種為材料,通過基因克隆與表達分析,以期探究SWEET基因在番荔枝生長過程中各組織的表達情況,進一步研究SWEET基因的功能與作用,最終為田間植株生長發育與果實品質調控提供理論依據。
1? 材料與方法
1.1? 材料
供試植物樣品為2006年種植于廣西農業科學院示范園區內的番荔枝科鳳梨釋迦(Atemoya)品系‘吉夫納品種,取其根、莖、嫩葉、老葉及花后8、30、90、120、140 d的果實為供試材料。所用試驗耗材為:cDNA Synthesis Kit試劑盒(TaKaRa)、M-MLV逆轉錄酶(TaKaRa)、EX TaqDNA聚合酶(TaKaRa)、氨芐青霉素(TaKaRa)、pMD18-T載體(TaKaRa)、熒光染料及相關耗材等;瓊脂糖、瓊脂糖凝膠回收試劑盒、大腸桿菌感受態DH5α(南寧國拓生物科技有限公司)。引物合成及測序均由上海生工生物工程技術服務有限公司完成。
1.2? 方法
1.2.1? RNA提取 ?提取番荔枝不同組織部位的RNA,采用課題組改良華越洋試劑盒提取法[9]。用紫外分光光度計測定其純度和濃度,并用1%瓊脂糖凝膠電泳檢測其完整性。
1.2.2? cDNA第一鏈合成? 以AUP1為逆轉錄引物,用M-MLV逆轉錄酶合成cDNA第一鏈,紫外分光光度計測定逆轉錄產物的濃度,并用瓊脂糖電泳檢測逆轉錄效果,最后配成200??g/?L標準濃度用于PCR擴增。
1.2.3? 番荔枝SWEET基因片段的克隆? 利用Super SMARTTM PCR cDNA Synthesis Kit試劑盒構建正向消減cDNA文庫,利用斑點雜交技術對克隆菌株作進一步篩選,再從中挑選陽性克隆菌株,通過De Novo技術對番荔枝進行測序分析,獲得的AT-SWEET同源基因片段序列信息,設計上、下游特異引物(AT-SWEET-F、AT-SWEET-R),利用RT-PCR方法獲得番荔枝長度為1227?bp的SWEET基因序列,命名為AT-SWEET16-1。同源基因cDNA擴增PCR體系:上下游引物各為1??L,cDNA 1??L,dNTP 0.5??L,Dream Taq聚合酶0.16??L,Buffer 2.5??L,水18.84??L。PCR擴增參數為:95?℃,5?min;95?℃,40?s;57?℃,40?s;72?℃,80?s,42個循環;72?℃,10?min。PCR產物經1.8%瓊脂糖凝膠電泳檢測,試劑盒回收克隆的目的片段,膠回收產物連接pMD18-T載體后轉化大腸桿菌DH5α感受態細胞,畫平板培養后篩選陽性菌落,經PCR驗證后測序。本研究所用引物見表1。
1.2.4? 番荔枝SWEET進化樹及蛋白序列分析? 通過美國國立生物信息中心National Center for Biotechnology Information(NCBI)Blast工具檢索SWEET同源基因的相似性;利用DNAman 5.2.2軟件分析預測;利用Protparam和GENSCAN軟件分別分析氨基酸及核苷酸序列;利用MEGA 10.0軟件對多物種SWEET同源基因進行近鄰算法分析,構建推測蛋白系統進化樹。
1.2.5? qRT-PCR? 采集番荔枝的幼嫩葉、老葉、莖、花、花蕾及不同發育階段的果實的不同部位(果柄、果皮、果肉和種子)。以持家基因GAPDH為內參基因(引物GAPDH-F、GAPDH-R),設計熒光定量引物AT-F、AT-R,參照試劑盒說明書,利用羅氏熒光定量PCR儀(Light Cycler480)進行qRT-PCR實驗,分析番荔枝SWEET基因在植株的不同組織和果實的不同部位中的表達模式。
1.2.6? 原位雜交? 采集番荔枝成熟果等組織為實驗樣品,委托上海生工生物工程技術服務有限公司合成基因探針(SWEET16-1,5'端加地高辛)。實驗主要步驟如下:石蠟切片脫蠟至無水;使用3%檸檬酸稀釋胃蛋白酶,將剛稀釋的混合液保持于37?℃,進行30?min消化處理;滴加預雜交液,于37?℃條件下進行實驗約2~3?h;將雜交探針混合液稀釋到適量的濃度,保持在42?℃條件下,實驗處理12?h;使用在恒溫水浴鍋中37?℃溫浴的檸檬酸鈉緩沖液(SSC),將樣品洗滌2次,每次洗滌時間保持在5~10?min;滴加封閉液,保證在37?℃條件下進行30?min的實驗處理;滴加生物素化鼠抗地高辛,于37?℃條件下進行約1?h的實驗處理;配制顯色液,室溫顯色;蘇木素復染細胞核,充分水洗;室溫晾干,中性樹膠封片;顯微鏡觀察,拍照。
2? 結果與分析
2.1? RNA提取及cDNA第一鏈合成
利用華越洋試劑盒改良提取法提取番荔枝的不同組織、器官樣本RNA,經1.0%的瓊脂糖凝膠電泳檢測結果表明,條帶清晰,無DNA污染;經分光光度計檢測,其OD260/OD280在1.9~2.1之間,說明RNA提取質量較好[9]。將RNA稀釋成1?g/L,然后按照TaKaRa反轉錄試劑盒步驟進行反轉錄。
2.2? AT-SWEET基因全長克隆
利用SWEET基因特異引物AT-SWEET-F和AT-SWEET-R,以番荔枝cDNA為模板擴增基因片段,獲得長度為1227?bp的番荔枝科鳳梨釋迦(Atemoya)品系SWEET基因全長cDNA序列,通過Uniprot數據庫(http://www.uniprot.org/)比對及生物信息學分析后,結果發現該基因所編碼的蛋白結構與SWEET16蛋白家族結構相似,由a螺旋形成的三螺旋束(triple-helix bundles,THB)結構域,故命名為AT-SWEET16-1,與克隆載體PMD-18連接,轉化感受態細胞。通過重組子的篩選,獲得陽性克隆菌株9個,通過抑制消減雜交技術及酶切檢驗后(圖1),送上海生工生物工程技術服務有限公司利用表達譜基因芯片技術進行測序分析,以驗證構建克隆載體。
2.3? 生物信息學分析
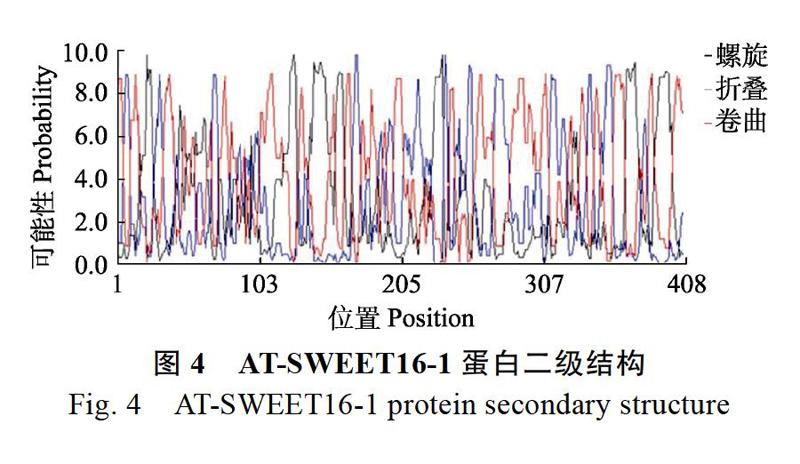
利用BioXM2.6軟件對AT-SWEET16-1基因進行分析,基因序列全長1227?bp(NCBI基因登錄號:2308905),編碼408個氨基酸,利用Protparam軟件對基因所編碼的氨基酸進行理化分析,結果表明,理論蛋白質的分子量為44.8?kDa,等電點為8.87;原子個數為6392,分子式為C2070H3240N516O542S24;不穩定指數(instability index)為41.39;脂肪族指數(aliphatic index)為108.48;蛋白質疏水性(grand average of hydropathicity,GRAVY)為0.562,預測為疏水蛋白;該蛋白在活體哺乳動物的紅細胞的半衰期為30?h,在活體酵母中半衰期超過20?h,在活體大腸桿菌超過10?h。利用ScanProsite、SMART和DNAman軟件對氨基酸序列的結構域進行分析。N端由2個相對保守的3-TM結構域(seven ɑ-helical transmembranes, TM)串聯重復和1個低保守的單TM進行連接,組成3-1-3對稱結構,再由3個TMs以TM1-TM3-TM2的形式排列形成三螺旋束(triple-helix bundles,THB)結構域(圖2),蛋白質的跨膜片段見圖3,二級結構見圖4。
2.4? 系統進化分析
將獲得的AT-SWEET16-1基因ORF用DNAman軟件翻譯成氨基酸序列,與NCBI上公布的其他物種的相關基因序列進行Blast比對,翻譯成氨基酸序列后進行同源比對,結果發現相似性最高為98%,最低為72%,選取14個同源性、相似性較高(≥81%)且具有SWEET蛋白結構特性的氨基酸序列。用MEGA10.0軟件繪制進化樹(圖5),結果發現其與海棗(Phoenix dactylifera)相類聚,表明在進化關系上非常接近,但與其他物種的SWEET蛋白進化關系較遠。對比AT-SWEET16-1基因所編碼的氨基酸序列與海棗(XP_ 008784806.1)所編碼的氨基酸序列,發現僅有幾個氨基酸序列存在差異,相似度達95%。
2.5? 番荔枝AT-SWEET16-1基因的表達分析
分析番荔枝AT-SWEET16-1基因在不同組織中的表達情況,結果見圖6和圖7,番荔枝AT-SWEET16-1基因在根、莖、嫩葉、老葉、花蕾、幼果、成熟果中均有表達,不同組織間表達量存在明顯不同,但差異不顯著,在成熟果、莖的表達量均比其他組織高,其中,在成熟果中的表達量最高,在嫩葉組織中表達量最低,成熟果中的表達量是幼果表達量的4倍多,是嫩葉表達量的5倍多。
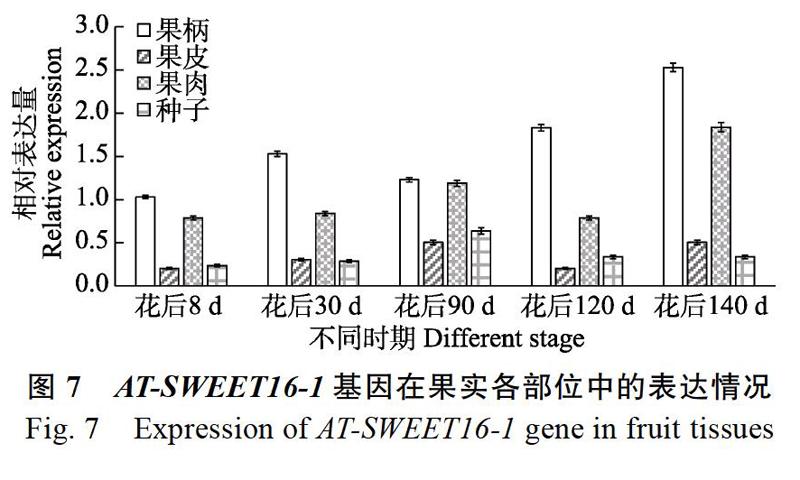
AT-SWEET16-1基因在果實不同發育階段不同部位的表達情況見圖7,結果發現在果實成熟期果柄的表達量明顯比其他果實發育時期的其他組織部位高,AT-SWEET16-1基因在花后140 d果實的果柄表達量最高,在果實種子中的最高表達量是在花后90 d。AT-SWEET16-1基因在番荔枝果實的不同部位的表達情況為:果柄>果肉>果皮>種子。
2.6? 原位雜交
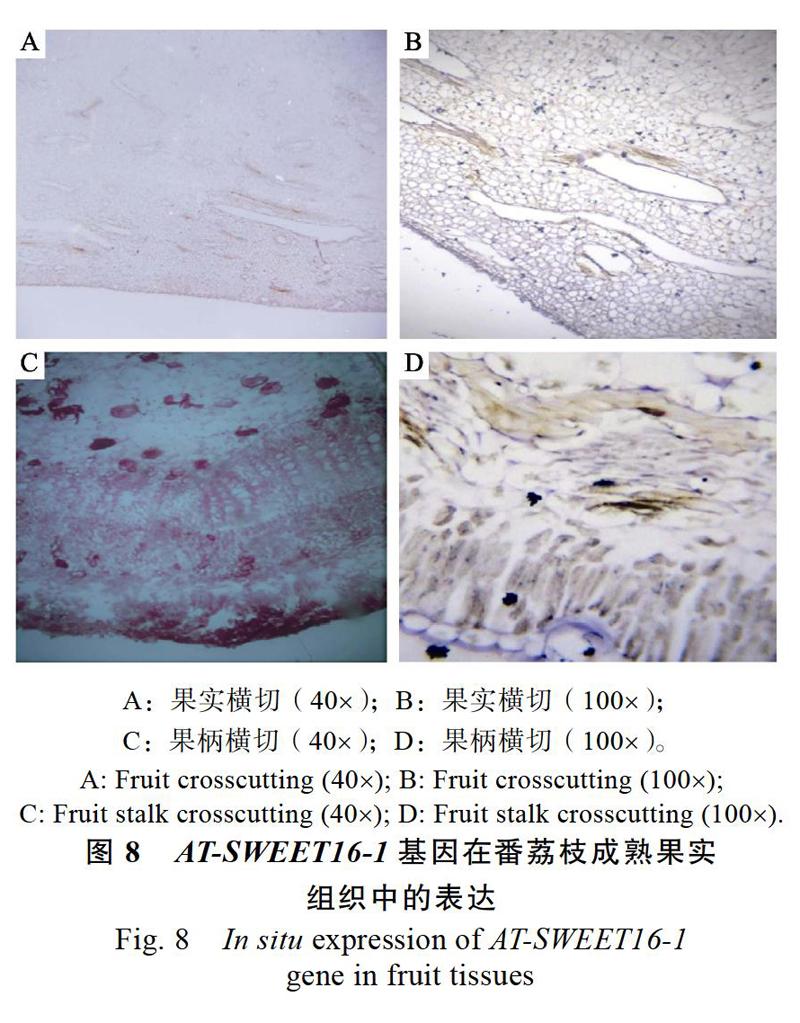
通過熒光定量分析結果發現,AT-SWEET16-1基因在番荔枝成熟果中果肉、果柄組織部位表達量高,將果肉、果柄組織樣品制成石蠟切片,用加地高辛的探針染色后進行電鏡觀察,得到直觀的基因表達部位圖像(圖8)。由圖8可知,基因表達位置為果肉細胞膜間、果柄韌皮部(顯示黃色)。
3? 討論
番荔枝作為世界五大熱帶名果之一,具有非常高的經濟價值,其糖分含量對果實風味和品質有著重要影響。而來自SWEET家族的糖轉運蛋白在植物生長發育中能夠調節糖分的運輸,從而影響植株的發育和果實糖分的積累。在本研究中,從番荔枝果實的時空表達分析中發現AT-SWEET16-1基因在根、莖、嫩葉、老葉、花蕾、幼果、成熟果中均有表達,其表達量依次為:成熟果>莖>根>花蕾>幼果>老葉>嫩葉。AT-SWEET16-1基因在果實成熟期的表達量高于幼果期,說明其對果實發育起著一定的調控作用,可能是基因編碼的蛋白參與到果實糖分的合成與運輸中,這與Chong等[10]在葡萄上的VvSWEET7基因表達一致。從不同組織部位表達看,AT-SWEET16-1基因在果柄中的表達量最高,果肉和果皮中相對較低,種子中的表達量最低,說明該基因有可能從源器官運輸至庫器官的轉運過程,通過原位雜交電鏡觀察再次驗證了AT-SWEET16-1基因與糖分積累與轉運有關。本研究的基因表達結果與番茄[1]、木薯[11]、蘋果[12]中SWEET基因的表達較為一致,SWEET蛋白在植物細胞間隙、液泡中均有表達,它們通過調控植物體內糖類化合物的運輸、分配和貯藏,參與到植物生長發育的重要生理過程;通過泛素裂解化酵母膜蛋白雙雜交和綠色熒光蛋白(GFP)試驗表明,SWEET蛋白功能缺失突變能阻止葡萄糖的轉運[13];SWEET蛋白同植株配子體發育有關,通過敲除SWEET基因的擬南芥突變體產生的種子較小,并且植株有明顯的發育延遲現象[14];SWEET蛋白參與的多種生理過程,如韌皮部裝載、蜜腺分泌[15]、籽粒灌漿、花粉發育、葉片衰老及響應生物和非生物脅迫[16-17],但目前有關SWEET基因的功能只在少數作物中得到驗證,還有很多SWEET家族成員的功能有待進一步挖掘[18]。
綜上所述,番荔枝AT-SWEET16-1基因可能在植株糖分積累與轉運等方面起到一定的作用,但該基因具體功能有待進一步驗證。
參考文獻
[1] 程 ?杰, 張新圣, 李安琪, 等. 番茄果實成熟過程中SlSWEET7a的功能分析[J]. 中國農業科學, 2018, 51(15): 2958-2968.
[2] Yuan M, Wang S. Rice MtN3/saliva/SWEET family genes and their homologs in cellular organisms[J]. Molecular Plant, 2013, 6(3): 665-674.
[3] Dobrenel T, Marchive C, Azzopardi M,et al. Sugar metabolism and the plant target of rapamycin kinase: A SWEET operator[J]. Frontiers in Plant Science, 2013, 4(1): 93.
[4] Chen L Q, Hou B H, Lalonde S, et al. Sugar transporters for intercellular exchange and nutrition of pathogens[J]. Nature, 2010, 468(7323): 527-532.
[5] 劉 ?暢, 姜 ?晶, 韓曉雪, 等. 植物中SWEET基因家族研究進展[J]. 植物生理學報, 2014, 509(9): 1367-1373.
[6] Madoka Y, Naohiro A, Tatsuro H, et al. The promoter activities of sucrose phosphate synthase genes in rice OsSPSl and OsSPSll,are controlled by light and circadian clock, but not by sucrose[J]. Frontiers in Plant Science, 2013, 4(1): 31.
[7] Guo W J, Nagy R, Chen H Y, et al. SWEETI7, a facilita-tive transporter mediates fructose transport across the tonoplast of Arabidopsis roots and leaves[J]. Plant Physiology, 2014, 164(2): 777-789.
[8] Patil G, Valliyodan B, Deshmukh R, et al. Soybean (Glycine max) SWEET gene family: Insights through comparative genomics transcriptome profiling and whole genome re-sequence analysis[J]. BMC Genomics, 2015, 16(1): 520.
[9] 安振宇, 方 ?仁, 黃偉雄, 等. 鳳梨釋迦總RNA提取方法探究及質量分析[J]. 分子植物育種, 2018, 16(5): 1654-1659.
[10] Chong J, Piron M C, Meyer S, et al. The SWEET family of sugar ?transporters in grapevine: Vv SWEET4 is involved in the interaction with Botrytis cinerea[J]. Journal of Experimental Botany, 2014, 65(22): 6589-6601.
[11] 劉 ?秦, 馬 ?暢, 馮世鵬, 等. 木薯SWEET1基因的分子克隆、亞細胞定位與功能分析[J]. 分子植物育種, 2017, 15(7): 2502-2509.
[12] 楊官顯, 許海峰, 張 ?靜, 等. 蘋果糖轉運蛋白基因MdSWEET17的功能鑒定[J]. 植物生理學報, 2018, 54(11): 1737-1745.
[13] Zhou Y, Liu L, Huang W, et al. Overexpression of OsSWEETS in rice causes growth retardation and precocious senescence[J]. PLoS One, 2014, 9(4): e94210.
[14] Braun D M. Sweet! the pathway is complete[J]. Science, 2012, 335(6065): 173-174.
[15] 薛蓓蓓, 覃麗芳, 董明右, 等. 木薯SWEETs基因家族生物信息學及表達特性研究[J]. 基因組學與應用生物學, 2019, 38(1): 260-268.
[16] Kanno Y, Oikawa T, Chiba Y, et al. AtSWEETI3 and AtSWEETI4 regulate gibberellin-mediated physiological processes[J]. Nature Communications, 2016, 7: 13245.
[17] Mueckler M. Facilitative glucose transporters[J]. European Journal of Biochemistry, 1994, 219(3): 713-725.
[18] 李艷嬌, 李文才, 孫 ?琦, 等. SWEET轉運蛋白在作物中的功能研究及前景展望[J]. 山東農業科學, 2019, 51(6): 154-159.
收稿日期 ?2019-11-08;修回日期 ?2020-03-23
基金項目 ?國家現代農業產業技術體系廣西創新團隊項目(No. nycytxgxcxtd-17-15);廣西創新驅動發展專項資金項目(桂科AA17204026);廣西科技重點研發計劃項目(桂科AB19245004)。
作者簡介 ?安振宇(1989—),男,碩士,助理研究員,研究方向:果樹遺傳育種與分子生物技術。*通信作者(Corresponding author):方 ?仁(FANG Ren),E-mail:fangren1981@163.com。

