pH值和比生長(zhǎng)速率協(xié)同調(diào)控Streptomyces albulus合成ε-聚賴(lài)氨酸
王開(kāi)方,潘龍,刁文嬌,陳旭升,毛忠貴
(工業(yè)生物技術(shù)教育部重點(diǎn)實(shí)驗(yàn)室(江南大學(xué)),生物工程學(xué)院,江蘇 無(wú)錫,214122)
ε-聚賴(lài)氨酸(ε-poly-L-lysine,ε-PL)是由25~35個(gè)L-賴(lài)氨酸單體通過(guò)ε-氨基和α-羧基脫水縮合形成的一種同型氨基酸聚合物[1-2]。ε-PL具有抑菌范圍廣[3-4]、安全無(wú)毒[5]和熱穩(wěn)定性高等特點(diǎn),故廣泛用作食品防腐劑,目前已被多個(gè)國(guó)家使用[6-7]。
ε-PL的發(fā)酵工藝主要為pH控制策略。KAHAR等[8]開(kāi)創(chuàng)了兩階段pH控制策略,即發(fā)酵前期(2 d)將pH控制在5.0以上,獲得更高的菌體量;后期將pH控制在4.0左右,快速合成ε-PL。經(jīng)過(guò)連續(xù)8 d補(bǔ)料分批發(fā)酵,ε-PL產(chǎn)量達(dá)到48.3 g/L,成為當(dāng)時(shí)的領(lǐng)先水平。任喜東等[9]建立了一種pH沖擊策略發(fā)酵生產(chǎn)ε-PL模式。前期控制pH為5.0,隨后讓pH自然下降,經(jīng)12 h左右的沖擊(pH 3.0)后回調(diào)pH值至4.0左右,直至發(fā)酵結(jié)束。同樣經(jīng)過(guò)連續(xù)8 d補(bǔ)料分批發(fā)酵,ε-PL產(chǎn)量達(dá)到54.7 g/L。大量研究表明,發(fā)酵過(guò)程中將pH控制在4.0左右是S.albulus積累ε-PL的先決條件[8,10-11]。目前,關(guān)于低pH促進(jìn)S.albulus高產(chǎn)ε-PL的原因主要有2種觀點(diǎn),第1種觀點(diǎn)認(rèn)為,低pH能夠有效的抑制ε-PL降解酶(PL dehydrogenase, Pld)的酶活,防止產(chǎn)生的ε-PL被降解[12-13];第2種觀點(diǎn)認(rèn)為,ε-PL合成酶(PL synthetase, Pls)是一種依賴(lài)于ATP的非核糖體肽合成酶,低pH環(huán)境有利于胞內(nèi)ATP的積累,從而促進(jìn)ε-PL的合成[14]。
然而,低pH除了影響Pld酶活和胞內(nèi)ATP濃度之外,還會(huì)對(duì)菌體生長(zhǎng)速率產(chǎn)生影響[15],而生長(zhǎng)速率的不同又會(huì)影響微生物的代謝流分布[16-17]。王澤建等[18]研究發(fā)現(xiàn):在糞產(chǎn)堿桿菌中,隨著比生長(zhǎng)速率的升高(0.05 h-1到0.29 h-1),葡萄糖流向菌體生長(zhǎng)的比例從18%增加到了47%,流向凝膠多糖合成的碳去向分布由45%降低到了12%;在高比生長(zhǎng)速率的情況下,更多的碳源流向菌體的生長(zhǎng)以及副產(chǎn)物的生成。那么比生長(zhǎng)速率是否也是影響ε-PL合成的一個(gè)重要原因呢?目前關(guān)于菌體比生長(zhǎng)速率對(duì)ε-PL合成的影響尚未有研究報(bào)道。因此,本研究將通過(guò)恒化培養(yǎng)方式,研究不同pH和菌體比生長(zhǎng)速率對(duì)S.albulusM-Z18合成ε-PL的影響。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1 菌種
StreptomycesalbulusM-Z18,本實(shí)驗(yàn)室保藏。
1.1.2 試劑
ATP檢測(cè)試劑盒、BCA蛋白濃度測(cè)定試劑盒(增強(qiáng)型),碧云天生物技術(shù)公司;ε-PL標(biāo)準(zhǔn)品,鄭州拜納佛生物工程股份有限公司;葡萄糖(優(yōu)級(jí)純),西王藥業(yè)有限公司鄒平分公司;酵母粉,英國(guó)Oxoid公司;其他試劑(分析純),國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.1.3 培養(yǎng)基
固體培養(yǎng)基(BNT)(g/L):葡萄糖 10,酵母粉 1,魚(yú)粉蛋白胨 2,pH 7.5。
種子培養(yǎng)基(M3G培養(yǎng)基)(g/L):葡萄糖 50,酵母粉 5,(NH4)2SO410,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,F(xiàn)eSO4·7H2O 0.03,KH2PO41.36,K2HPO40.8,pH 6.8。
分批培養(yǎng)基(RSM培養(yǎng)基)(g/L):葡萄糖 60,酵母粉 10,(NH4)2SO410,MgSO4·7H2O 0.8, FeSO4·7H2O 0.05,KH2PO44,pH 6.8。
恒化分批培養(yǎng)基(g/L):葡萄糖20,其他成分與分批培養(yǎng)基相同。
恒化補(bǔ)料培養(yǎng)基(g/L):葡萄糖22,其他成分與分批培養(yǎng)基相同。
1.1.4 儀器與設(shè)備
T&J-Miniskid 1 L*4迷你平行生物反應(yīng)器,迪比爾生物工程(上海)有限公司;BT100-1F/DG蠕動(dòng)泵,保定蘭格恒流泵有限公司;Synergy H4多功能酶標(biāo)儀,美國(guó)伯騰儀器有限公司;UV-2100紫外可見(jiàn)分光光度計(jì),尤尼可儀器有限公司;AB204-N分析天平,瑞士梅特勒公司;3K15冷凍離心機(jī),德國(guó)SIGMA公司;HYG-Ⅱ回轉(zhuǎn)式恒溫調(diào)速搖瓶柜,上海欣蕊自動(dòng)化設(shè)備有限公司;BS1100+電子天平,上海友聲衡器有限公司;GNP-9160恒溫培養(yǎng)箱,上海光都儀器設(shè)備公司;SBA-40C生物傳感分析儀,山東省科學(xué)院生物研究所。
1.2 培養(yǎng)方法
1.2.1 搖瓶種子培養(yǎng)
從活化的新鮮平板上刮取2環(huán)孢子接入裝有80 mL種子培養(yǎng)基的500 mL搖瓶中,200 r/min、30 ℃搖床培養(yǎng)24 h。
1.2.2 分批發(fā)酵
將培養(yǎng)好的種子液以體積分?jǐn)?shù)8%接種量接入T&J-Miniskid 1 L*4迷你平行生物反應(yīng)器,裝液量為600 mL,溫度設(shè)置為30 ℃,通氣量1.0 vvm,初始轉(zhuǎn)速為200 r/min,溶氧設(shè)置為30%,轉(zhuǎn)速溶氧聯(lián)動(dòng)控制。待pH分別自然下降至3.5、4.0、5.0和5.5時(shí),用12.5%的NH3·H2O分別維持pH恒定直至發(fā)酵結(jié)束。期間每隔6 h取一次樣,測(cè)定菌體干重(DCW)、ε-PL濃度、葡萄糖濃度等參數(shù),以考察不同pH控制模式對(duì)S.albulusM-Z18生長(zhǎng)以及ε-PL合成的影響。
1.2.3 恒化培養(yǎng)
恒化培養(yǎng)在T&J-Miniskid 1 L*4迷你平行生物反應(yīng)器中進(jìn)行,工作體積為600 mL,接種量為8%。分批階段:初始轉(zhuǎn)速為200 r/min,溶氧設(shè)置為30%,轉(zhuǎn)速溶氧聯(lián)動(dòng)控制,直至葡萄糖基本耗完(18 h),轉(zhuǎn)入恒化階段[19]。恒化階段:全程控制溫度為30 ℃,轉(zhuǎn)速為700 r/min,通氣量為1.0 vvm,分別控制pH為4.0、5.0和5.5,置換4~5個(gè)體積后均能達(dá)到穩(wěn)定狀態(tài)(通過(guò)葡萄糖濃度、菌體干重、溶氧、ε-PL濃度等過(guò)程參數(shù)確定)。取穩(wěn)定狀態(tài)菌液進(jìn)行分析。
1.3 分析方法
1.3.1 ε-PL濃度的測(cè)定
采用甲基橙比色法[20]。
1.3.2 DCW的測(cè)定
取10 mL發(fā)酵液,5 000×g離心10 min后,棄上清,沉淀用去離子水洗滌、離心2次后,于105 ℃烘干至恒重(約24 h)。
1.3.3 葡萄糖濃度的測(cè)定
使用生物傳感分析儀進(jìn)行測(cè)定。
1.3.4 胞內(nèi)ATP濃度的測(cè)定
參照試劑盒說(shuō)明書(shū)。
1.3.5 蛋白濃度的測(cè)定
參照試劑盒說(shuō)明書(shū)。
1.3.6 動(dòng)力學(xué)參數(shù)的計(jì)算[18,21-22]
比生長(zhǎng)速率:使用Origin 9.0軟件按照Logistic方程非線(xiàn)性擬合得到生長(zhǎng)曲線(xiàn),再經(jīng)Origin 9.0軟件進(jìn)一步處理數(shù)據(jù)得出比生長(zhǎng)速率曲線(xiàn)。
ε-PL比合成速率:方法類(lèi)似于比生長(zhǎng)速率。
恒化穩(wěn)態(tài)時(shí),比生長(zhǎng)速率(μ,h-1)、稀釋率(D,h-1)、細(xì)胞得率(YX/S,g/g)、ε-PL得率(YP/S,g/g)、以菌體生長(zhǎng)為基準(zhǔn)的ε-PL得率(YP/X,g/g)、葡萄糖比消耗速率(qS,g/(g·h)以及ε-PL比合成速率(qP,g/(g·h)參照以下公式。
(1)
(2)
(3)
(4)
(5)
qP=μ·YP/X
(6)
式中:F,補(bǔ)料速率,L/h;V,裝液量,0.6 L;c(X),穩(wěn)態(tài)時(shí)菌體干重,g/L;c(P),穩(wěn)態(tài)時(shí)ε-PL質(zhì)量濃度,g/L;c(S),穩(wěn)態(tài)時(shí)葡萄糖質(zhì)量濃度,g/L;c(S0),補(bǔ)料液中的葡萄糖質(zhì)量濃度,g/L。
2 結(jié)果與討論
2.1 pH對(duì)S. albulus M-Z18分批發(fā)酵的影響
微生物的生長(zhǎng)需要一定的酸堿度,鏈霉菌的最適生長(zhǎng)pH為中性偏堿性[23-24]。pH通過(guò)影響微生物細(xì)胞膜的電荷、酶活、營(yíng)養(yǎng)物質(zhì)和中間代謝產(chǎn)物的解離等進(jìn)而影響微生物生長(zhǎng)和產(chǎn)物合成[25]。pH對(duì)S.albulusM-Z18分批發(fā)酵結(jié)果如圖1所示,隨著分批發(fā)酵進(jìn)行,pH值由初始6.8逐步下降至pH 5.5(13 h)、pH 5.0(14 h)、pH 4.0(14.5 h)和pH 3.5(15 h),隨后依靠自動(dòng)流加氨水將分批發(fā)酵過(guò)程控制在不同的pH進(jìn)行。由圖1-a可知,不同pH對(duì)S.albulusM-Z18菌體生長(zhǎng)產(chǎn)生了顯著影響,受控pH越高,發(fā)酵結(jié)束時(shí)菌體量就越高,該實(shí)驗(yàn)結(jié)果與前期研究保持一致[18]。pH 3.5時(shí),最終生物量為(11.62±0.40)g/L,僅為pH 5.5時(shí)的一半[(22.53±0.42 g/L]。另外,在分批發(fā)酵分別達(dá)到受控pH值后(15 h),μpH 3.5約為0.04 h-1,μpH4.0約為0.07 h-1,μpH 5.0約為0.10 h-1,μpH 5.5約為0.13 h-1(圖1-b),表明分批發(fā)酵受控pH, pH值越小,S.albulusM-Z18比生長(zhǎng)速率越低。然而,ε-PL產(chǎn)量在pH 3.5時(shí)最高,達(dá)到(5.24±0.10) g/L;當(dāng)pH高于5.0時(shí),發(fā)酵液中檢測(cè)不到ε-PL(圖1-c)。通過(guò)對(duì)ε-PL比合成速率分析發(fā)現(xiàn),ε-PL快速合成階段主要集中于18~27 h左右。24 h之后,ε-PL比合成速率顯著下降。在大部分時(shí)間里,pH 3.5時(shí)ε-PL比合成速率高于pH 4.0時(shí)(圖1-d)。因此,S.albulusM-Z18在低pH環(huán)境下積累ε-PL與菌體生長(zhǎng)速率存在一定關(guān)聯(lián)。
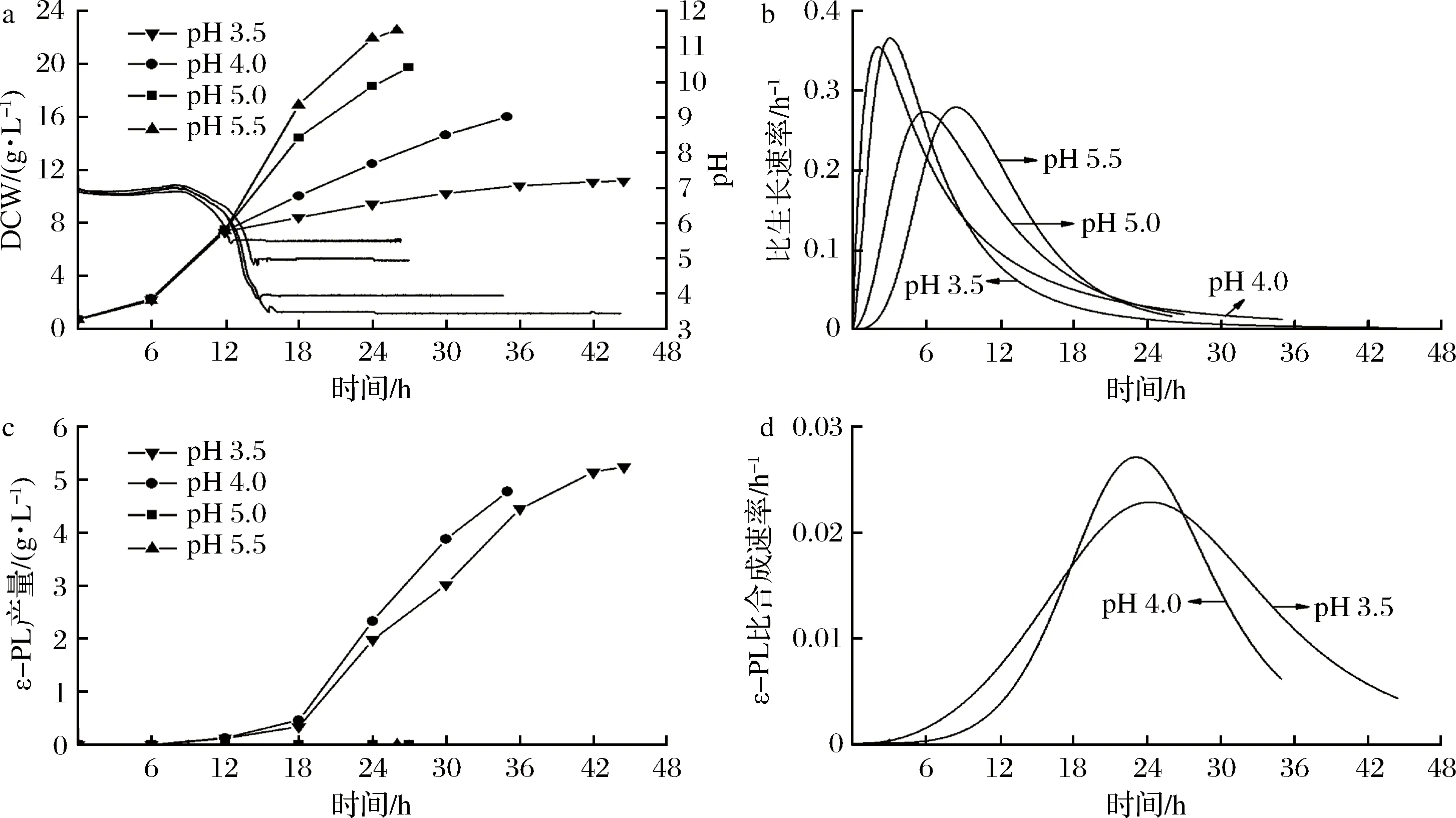
a-菌體生長(zhǎng);b-比生長(zhǎng)速率;c-ε-PL產(chǎn)量;d-ε-PL比合成速率圖1 pH值對(duì)分批發(fā)酵過(guò)程參數(shù)的影響Fig.1 Time profiles during batch fermentation at different pH
2.2 pH對(duì)S. albulus M-Z18恒化培養(yǎng)積累ε-PL的影響
恒化培養(yǎng)可以通過(guò)改變稀釋率及限制性基質(zhì)的種類(lèi)和濃度靈活地控制微生物細(xì)胞的比生長(zhǎng)速率。通過(guò)恒化培養(yǎng)可以使微生物細(xì)胞達(dá)到“穩(wěn)態(tài)”,故常常被用于微生物生理方面的研究[26-27]。本文通過(guò)控制D=0.04 h-1,研究不同pH(4.0,4.5,5.0)對(duì)S.albulusM-Z18合成ε-PL的影響(在稀釋率為0.04 h-1時(shí),pH 3.5不能建立恒化體系),如圖2a-c所示,隨著pH值升高,S.albulusM-Z18生物量逐漸增大,而ε-PL質(zhì)量濃度逐漸減小。在pH 4.0時(shí),生物量為(8.19±0.05) g/L,ε-PL濃度為(2.43±0.04) g/L;在pH 5.0時(shí),生物量為(12.19±0.14) g/L,ε-PL質(zhì)量濃度為(0.76±0.02) g/L;在pH 5.5時(shí),生物量為(15.63±0.09) g/L,ε-PL質(zhì)量濃度為0 g/L。實(shí)驗(yàn)結(jié)果表明,pH值對(duì)于恒化條件下的菌體生長(zhǎng)和ε-PL合成影響,與上述分批發(fā)酵結(jié)果基本一致:低pH有利于ε-PL合成,而不利于菌體生長(zhǎng)。進(jìn)一步動(dòng)力學(xué)參數(shù)分析發(fā)現(xiàn),隨著pH值降低,細(xì)胞得率(YX/S)逐漸減小,葡萄糖比消耗速率(qS)逐漸增大,ε-PL比合成速率(qP)也逐漸增加。特別是在pH 4.0時(shí),YX/S最低(0.376 g/g),qS最高(0.106 g/(g·h)),qP最大(0.012 g/(g·h))(表1)。這表明,低pH時(shí),細(xì)胞會(huì)快速消耗葡萄糖用于ε-PL的合成。胞內(nèi)ATP濃度檢測(cè)發(fā)現(xiàn)(圖2-d),在pH 4.0時(shí),胞內(nèi)ATP濃度最高為(7.11±0.80) nmol/mg蛋白,而pH 5.0與pH 5.5胞內(nèi)ATP濃度分別只有(4.23±0.43) 和(2.66±0.70) nmol/mg蛋白。這表明,pH值越低越有利于胞內(nèi)ATP積累。事實(shí)上,ε-PL合成依靠的ε-PL合成酶是一種依賴(lài)于ATP濃度的非核糖體肽合成酶,即ATP濃度越高,酶活越高[14],ε-PL合成速率就越快。另外,已有的研究表明S.albulus中存在2種ε-PL分解酶,它們的最適pH為7.0左右,且酶活會(huì)隨著pH降低而逐漸減小,在pH 4.0時(shí)酶活基本喪失[12-13]。綜上,在菌體比生長(zhǎng)速率相同情況下,低pH一方面抑制了分解酶活性,另一方面使得底物葡萄糖更多地用于ATP和ε-PL合成,從而有利于ε-PL積累。

a-pH 4.0;b-pH 5.0;c-pH 5.5;d-胞內(nèi)ATP含量圖2 S. albulus M-Z18在不同pH下的恒化培養(yǎng)(D=0.04 h-1)過(guò)程參數(shù)和胞內(nèi)ATP含量Fig.2 Time profiles and intracellular ATP concentrations of S. albulus M-Z18 in chemostat (D=0.04 h-1) at different pH

表1 不同pH值下S. albulus M-Z18恒化培養(yǎng)(D=0.04 h-1)動(dòng)力學(xué)參數(shù)Table 1 Kinetic paraments of S. albulus M-Z18 in chemostat (D=0.04 h-1) at different pH
2.3 比生長(zhǎng)速率對(duì)恒定pH 4.0條件下S. albulus M-Z18合成ε-PL的影響
S.albulusM-Z18在pH 4.0條件下,不同稀釋率的恒化培養(yǎng)體系中達(dá)到“穩(wěn)態(tài)”時(shí)(D=0.08 h-1有輕微洗脫現(xiàn)象),μ=0.04、0.06和0.08 h-1的生物量分別為(8.19±0.05)、(7.83±0.04)和(6.81±0.07) g/L;ε-PL濃度分別為(2.43±0.04)、(2.29±0.06)和(1.68±0.06) g/L(圖3a-c)。隨著菌體比生長(zhǎng)速率的增加(稀釋率升高),qS和qP均呈逐漸增加趨勢(shì)(表2)。相比于D=0.04 h-1、D=0.06 h-1時(shí),qS和qP分別提高了43%和50%;相比于D=0.06 h-1、D=0.08 h-1時(shí),qS提高了70%,而qP只提高了11%。

表2 不同稀釋率S. albulus M-Z18恒化培養(yǎng)(pH 4.0)動(dòng)力學(xué)參數(shù)Table 2 Kinetic paraments of S. albulus M-Z18 in chemostat (pH 4.0) at different dilution ratios
另外,不同稀釋率恒化體系中菌體胞內(nèi)ATP濃度檢測(cè)發(fā)現(xiàn),稀釋率為0.04、0.06和0.08 h-1時(shí),胞內(nèi)ATP濃度分別為(7.11±0.80)、(12.98±0.45)和(16.06±1.41) nmol/mg蛋白。相比于D=0.04 h-1、D=0.06 h-1胞內(nèi)ATP增加了82.5%左右,約6 nmol/mg蛋白。而相比于D=0.06 h-1、D=0.08 h-1胞內(nèi)ATP僅增加了23.7%,約3 nmol/mg蛋白。綜上,在恒定pH 4.0時(shí),菌體比生長(zhǎng)速率越高,底物葡萄糖消耗速率、ε-PL比生成速率和胞內(nèi)ATP濃度就越大,而細(xì)胞得率和ε-PL得率(YP/S)卻在總體下降。由此可以看出,隨著菌體比生長(zhǎng)速率提高,底物葡萄糖消耗速率加快,更多的葡萄糖流向了菌體合成和ATP生產(chǎn),但是ε-PL比生成速率提高不顯著,而YP/S下降明顯(特別是在D=0.08 h-1時(shí)),故過(guò)高的菌體比生長(zhǎng)速率會(huì)降低發(fā)酵的經(jīng)濟(jì)性。因此,在發(fā)酵過(guò)程中,除了將pH控制在合適范圍內(nèi),也需要調(diào)節(jié)菌體的生長(zhǎng)速率保持在合理區(qū)間(如0.06 h-1左右),才能實(shí)現(xiàn)ε-PL的最高效發(fā)酵。

a-0.04 h-1;b-0.06 h-1;c-0.08 h-1;d-胞內(nèi)ATP含量圖3 S. albulus M-Z18在不同稀釋率的恒化培養(yǎng)(pH=4.0)過(guò)程參數(shù)和胞內(nèi)ATP含量Fig.3 Time profiles and intracellular ATP concentrations of S. albulus M-Z18 in chemostat (pH 4.0) at different dilution ratios
3 結(jié)論
為了探究ε-PL發(fā)酵過(guò)程的關(guān)鍵影響因素,本文從發(fā)酵動(dòng)力學(xué)角度,分析了pH值和菌體比生長(zhǎng)速率對(duì)ε-PL發(fā)酵過(guò)程參數(shù)的影響。研究結(jié)果表明,發(fā)酵過(guò)程控制pH在4.0左右,不僅可以抑制ε-PL分解酶活性,同時(shí)使得底物葡萄糖更多地用于ATP和ε-PL合成,從而有利于ε-PL的積累;另外,維持菌體比生長(zhǎng)速率在合理區(qū)間(0.06 h-1左右),也是獲得ε-PL高效積累的重要控制條件。因此,在發(fā)酵過(guò)程中將pH控制在較低水平,不僅能夠抑制分解酶活性、提高胞內(nèi)ATP濃度,還可以將菌體生長(zhǎng)控制在合適的速率范圍,最終共同調(diào)控了ε-PL大量積累。基于上述發(fā)現(xiàn),在ε-PL補(bǔ)料分批發(fā)酵過(guò)程中(pH沖擊模式),當(dāng)菌體增長(zhǎng)緩慢時(shí),可通過(guò)流加有機(jī)氮源(如酵母粉)促進(jìn)菌體生長(zhǎng);而當(dāng)菌體增長(zhǎng)過(guò)快,可通過(guò)適當(dāng)下調(diào)pH,以維持細(xì)胞比生長(zhǎng)速率在0.06 h-1左右,進(jìn)一步達(dá)到高產(chǎn)ε-PL的目的。

