不同建模方法對鏈脲霉素誘導1型糖尿病成模率的影響
王樂旬,吳惠娟,張盛昔,榮向路,郭姣
(廣東省代謝病中西醫結合研究中心/廣東省代謝性疾病中醫藥防治重點實驗室/粵港澳聯合代謝病重點實驗室/廣東藥科大學中醫藥研究院,廣東 廣州 510006)
糖尿病(diabetes mellitus,DM)的全球患病率逐年上升,已成為威脅人類健康的主要疾病之一,主要分為1型(T1DM)和2型(T2DM)。T1DM作為目前高發的一種慢性胰島素依賴性自身免疫性疾病,主要病理表現為T淋巴細胞浸潤胰腺,導致胰島β細胞破壞,進而使其喪失合成和分泌胰島素的功能[1]。然而,臨床上對T1DM的防治措施尚不完善,還需要對其進行深入的研究。因此,建立較理想的動物模型對研究該病的發病機制和治療具有重要意義。
鏈脲佐菌素(streptozotocin,STZ)是一種從鏈霉菌中提取的抗生素,因其具有毒性低、用藥量小、高特異性的破壞胰島β細胞等優點,為目前世界范圍內最常用的誘發動物出現糖尿病的化學誘導劑[2]。STZ誘導糖尿病的發生及類型與鼠的種系、性別、用藥劑量和次數有關[2]。經典的誘導T1DM方法是多次小劑量STZ注射,但用藥劑量、是否饑餓、模型成功率以及小鼠死亡情況文獻報道不一[3-5]。本研究采用多次腹腔注射STZ或先饑餓然后給予腹腔注射STZ誘導C57BL/6小鼠T1DM,以篩選模型成功率較高、小鼠死亡率較低的造模方法。
1 材料與方法
1.1 實驗動物
8~10周的雄性C57BL/6小鼠購自廣東省醫學實驗動物中心,動物生產許可證號:SCXK(粵)2018-0002。小鼠飼養在廣東藥科大學實驗動物中心,實驗動物使用許可證號:SYXK(粵)2017-0125,室內溫度25 ℃,相對濕度70%~90%,普通飼料喂養,自由飲水和攝食。
1.2 試劑與儀器
分析純的檸檬酸和檸檬酸鈉購于天津市大茂化學試劑廠;STZ購自美國Sigma公司;羊血清和DAB顯色試劑盒購自碧云天生物技術公司;胰島素一抗為北京博奧森生物技術有限公司產品;羊抗兔HRP標記的二抗為Thermo Scientific公司產品;ONETOUCH ultraeasy血糖儀及試紙購自美國Johnson & Johnson公司;BX51WI顯微鏡為日本Olympus公司產品;Vectra顯微鏡分析軟件為美國PE公司產品。
1.3 溶液的配制
檸檬酸鹽緩沖液:稱取檸檬酸2.1 g加雙蒸水100 mL配成A液,檸檬酸鈉2.94 g加雙蒸水100 mL配成B液,將A、B液按1∶1(V∶V)混合,嚴格調節pH在4.2~4.5,用0.22 μm的微孔濾膜過濾除菌。
STZ溶液:稱取STZ裝于一干燥的滅菌管中,外用錫紙包好,用預冷的檸檬酸鹽緩沖液溶解,配成質量濃度為10 mg/mL的溶液,現配現用,30 min內用完。
1.4 分組與建模
小鼠隨機分對照組(7只)、實驗組一(經典造模方法,12只)、實驗組二(12只)以及實驗組三(常用造模方法,11只)。實驗組一[4-7]:未禁食,腹腔注射劑量為50 mg/kg的STZ,連續5 d;實驗組二:不禁食,腹腔注射劑量為50 mg/kg的STZ,連續4 d,最后1天注射STZ的劑量加倍,為100 mg/kg;實驗組三[3,8]:每天先禁食12 h,然后腹腔注射50 mg/kg的STZ,連續5 d。對照組注射與實驗組等體積(5 mL/kg)的檸檬酸鹽緩沖液。
1.5 模型觀察指標
注射STZ后每天觀察并記錄小鼠的一般狀況和死亡情況,一般狀況主要包括精神狀態、毛發顏色、運動情況和墊料有無尿濕等,并及時更換尿濕的墊料;每天測量各組小鼠的體質量、攝食量和飲水量;最后1次注射后每周測量1次隨機血糖,連續4周,隨機血糖值≥15 mmol/L為建模成功[8-9]。比較各組的成模率和死亡率、成模小鼠的血糖值變化和體質量變化等。
1.6 免疫組織化學
實驗結束后,脫臼處死小鼠,取胰腺組織,多聚甲醛固定,石蠟包埋后切片。對胰腺石蠟切片進行烤片、脫蠟和脫水后,利用枸櫞酸緩沖液加熱進行抗原修復;正常羊血清工作液封閉,胰島素一抗濕盒孵育過夜;PBS洗滌3次,每次5 min后,孵育生物素標記二抗;PBS洗滌3次,每次5 min;二氨基聯苯胺(DAB)染色后,蘇木素復染,常規脫水,透明,干燥和封片;然后顯微鏡觀察并拍照,并利用顯微鏡自帶分析軟件分析胰島面積。
1.7 統計學方法

2 結果
2.1 小鼠的一般情況
對各組小鼠日常活動狀態觀察發現,對照組小鼠毛發干凈、順、有光澤,精神狀態良好,比較活潑,反應靈敏。各實驗組均有不同程度地表現為活動少、精神萎靡、毛發欠光澤、易脫毛、反應遲鈍等現象,這些情況又以實驗組二的表現最為明顯。
注射STZ第3天起飲水量和進食量開始增加。選擇第4周對每天攝食和飲水情況進行統計,結果如圖1所示,實驗組的攝食量顯著高于對照組(實驗組一和三:P<0.05;實驗組二:P<0.01),所有實驗組的飲水量均顯著高于對照組(P<0.01)。從飲水量上看,實驗組二的飲水量是最高的,遠高于實驗組一和實驗組三(P<0.01)。實驗組從STZ注射后第3天起出現多尿現象,3個模型組的墊料明顯比對照組墊料的濕度大。結果顯示多飲多食癥狀明顯。
2.2 不同建模方法對小鼠體質量的影響
對照組的各小鼠體質量逐步增長;在STZ注射后第1周,各實驗組與對照組的小鼠體質量差異無統計學意義。實驗組二的小鼠體質量與對照組相比從第2周開始有了顯著差異(P<0.05),這種差異一直維持到第4周實驗結束(P<0.01);而實驗組一的小鼠體質量與對照組相比,在第3周才出現顯著性差異(P<0.05),并且一直到實驗結束(P<0.05);實驗組三的體質量差異變化不大,見表1。從第2周開始,實驗組一和二的體質量呈現下降趨勢,而實驗組三的體質量下降趨勢不明顯。

ABCDABCD5.04.03.02.01.00.0攝食量/g飲水量/mL15.010.05.00.0******##**##**
A.對照組; B.實驗組一; C.實驗組二; D.實驗組三。與對照組比較:*P<0.05,**P<0.01;與實驗組二比較:##P<0.01。
圖1各組小鼠的攝食及飲水量

2.3 不同建模方法對小鼠隨機血糖的變化
通過不同時間測得的隨機血糖結果顯示,和對照組相比,實驗組一和二的隨機血糖在注射STZ后的第1周就顯著高于對照組的血糖(P<0.05),這種升高一直持續到實驗結束(實驗組一:P<0.05;實驗組二:P<0.01)。而實驗組三的血糖從第2周開始明顯高于對照組(P<0.05),第3周有升高趨勢,這種趨勢持續到實驗結束(P<0.05)。另外,不同實驗組間的血糖也有差異。實驗組三的血糖從第2周開始顯著低于實驗組二的血糖(P<0.05),且這種趨勢一直存在。見表2。
表1 各組小鼠建模后體質量


組別n1周2周3周4周對照組723.89±1.8124.97±1.8525.56±2.0125.81±2.20實驗組一1223.13±1.3723.63±1.4722.60±2.39?22.93±1.93?實驗組二1222.78±1.3523.03±1.44?22.15±1.68??22.28±1.92??實驗組三1122.52±1.5523.85±1.0623.26±1.3323.54±1.39
與對照組比較:*P<0.05,**P<0.01。
2.4 不同方法的建模成功率
根據隨機血糖值超過15 mmol/L即確定為1型糖尿病,分析了每次測量的血糖結果,如表3所示。在這3種不同方式建模中,實驗組二在第1周的時候成功率最高,為41.7%,且于第2周有11只小鼠的血糖超過15 mmol/L(成功率為91.7%),數量和血糖值均一直維持到實驗結束。其次,實驗組一小鼠的成模率在第3周才達到83.3%,第4周也并未增加。而實驗組三的小鼠在第1和第2周時的成模率為36.4%,第3周和第4周分別比前2周增加了2只和3只小鼠,于第4周時成模率達到63.6%,在3種建模方式中成模率最低。
另外,在整個建模過程中,實驗組二在第3周死亡1只小鼠,其余兩組均未發生小鼠死亡的情況。
表2 各組小鼠建模后隨機血糖值

c/(mmol·L-1)
與對照組比較:*P<0.05,**P<0.01;與實驗組二比較:#P<0.05。
表3 各組小鼠成模率
Table3Modeling rate of mice in each group

%
2.5 模型鼠的胰腺改變
結果如圖2所示,和對照組相比,模型組小鼠的胰島普遍縮小(實驗組一和二,P<0.01;實驗組三,P<0.05);形態上胰島細胞顯著減少且排列不規則。
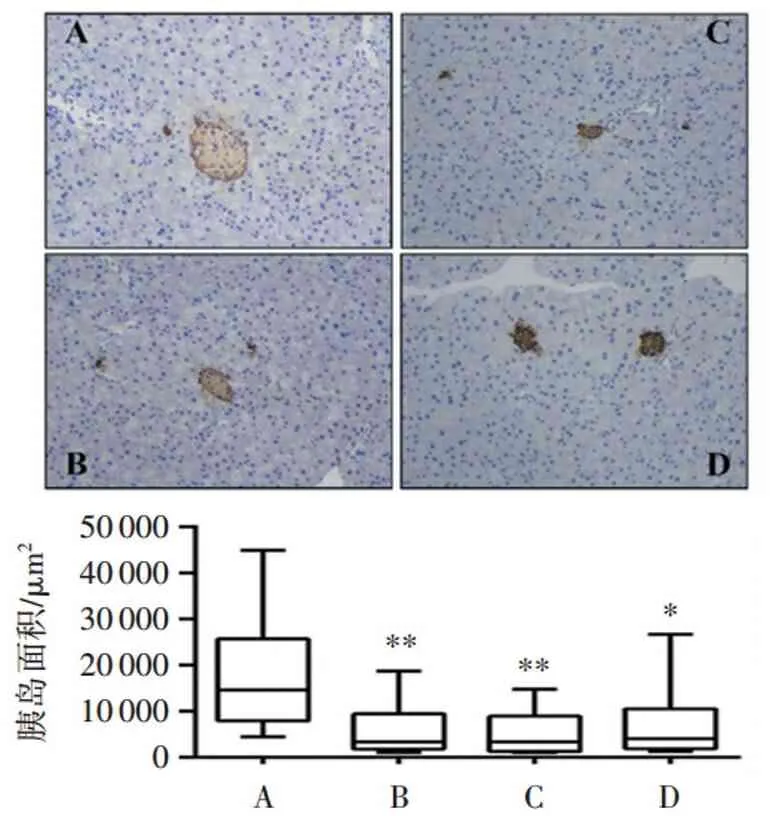
A.對照組; B.實驗組一; C.實驗組二; D.實驗組三。與對照組比較:*P<0.05,**P<0.01。
圖2各組小鼠胰腺免疫組化
Figure2Immunohistochemistry of pancreas in mice of each group (200×,n=7)
3 討論
近年來隨著我國居民生活水平的提高,糖尿病的發病率呈上升趨勢,青少年的發病率也逐年升高。T1DM作為青少年常見疾病類型,可引起酮癥酸中毒、昏迷和糖尿病腎病等并發癥,對人類健康造成巨大影響。因此,對糖尿病的發病機制、預防與治療等研究成為熱點。為了克服現有模型的不足,構建簡單易操作、重復性好的糖尿病動物模型顯得尤為重要。
目前常用糖尿病模型主要有藥物誘導模型、胰腺切除模型以及自發性糖尿病動物模型等[7],STZ是最為常用的藥物誘導劑。因STZ對胰島β細胞具有高度特異的選擇殺傷作用,故用STZ造模的成模率高,操作簡便,且小劑量多次注射給藥可引發T細胞介導的β細胞損傷,出現自身免疫系統紊亂[2]。這種損傷與人類T1DM發病機制相似,因此受到格外關注。STZ誘導糖尿病注射方法有多種,腹腔注射較尾靜脈注射操作簡單、準確快速,因此在本研究中,采取腹腔給藥途徑構建糖尿病模型。對于給藥劑量,國內外的研究多采用30~60 mg/kg[3,10-12]。本研究中選擇了50 mg/kg作為基礎劑量進行注射,然后通過腹腔連續注射5 d,成功構建1型糖尿病模型。
對于血糖的檢測和標準,研究報道也不一致。有研究檢測空腹血糖,血糖值定為大于16.65 mmol/L[13]、15 mmol/L[8]或11.1 mmol/L[5,14]認為糖尿病模型構建成功。也有研究檢測隨機血糖,血糖值大于16.7 mmol/L[3,15]、15 mmol/L[9]、13.9 mmol/L[10]或11 mmol/L[16]作為模型成功的標準。本研究選擇了操作較為簡單的隨機血糖檢測,并且將模型構建標準定為血糖值大于15 mmol/L。隨機血糖檢測操作簡單、方便易行,不用對動物進行饑餓處理,減少對動物不必要的干預,符合動物的倫理要求。
對于血糖的檢測時間,各報道并不一致。有些研究顯示,在最后一次STZ注射后的3 d檢測血糖高于標準之后就判定為模型構建成功[3,9,17-18];有些研究顯示,在末次注射后的1周檢測血糖值高于判定標準后認為模型構建成功[12-13,15]。考慮到STZ注射后3 d時間過短,胰島β細胞的損傷需要一定的時間,正如一些研究中顯示3 d時檢測的血糖低于1周時的血糖[13],所以本研究選擇從注射后1周開始測量血糖,將血糖值大于15 mmol/L定為模型構建成功。
有研究[8]顯示,注射STZ前禁食與否對模型的成功構建有很大影響。如禁食可以增加建模的成功率。10~20 h建模成功率最高,禁食時間過短或過長,建模成功率均下降[3,12]。但另外一些研究表明,在注射STZ前不禁食也可達到較高的建模成功率[9-10,15]。本研究比較了禁食12 h與不禁食對造模成功率的影響。通過4周的觀察和檢測,發現禁食組的成模率(63.6%)低于未禁食組的成模率(83.3%)。造成這種現象的原因可能是禁食導致血糖和胰島素的分泌下降,進而引起胰腺β細胞對葡萄糖類似物STZ的攝入下降所致[2,12]。
另外,本研究也對比了未禁食時5 d連續基礎劑量(50 mg/kg)注射和4 d基礎劑量+1 d加大劑量(100 mg/kg)建模情況,發現最后1天STZ的劑量加倍后能夠顯著提升糖尿病模型的建模成功率(100%)。胰腺的免疫組化結果也提示,末次加大劑量后能夠在前期損傷的基礎進一步殺傷β細胞[2]。末次劑量加倍處理使血糖升高更快,水平也更高,和另外兩組相比,血糖幅度變化小。小鼠的大體形態、飲食和飲水、血糖水平等更符合糖尿病的模型標準。在模型鼠的死亡方面,除了實驗組二有1只死亡外,其余兩組沒有小鼠死亡。
綜上,綜合成模率和死亡率,腹腔注射STZ 4 d基礎劑量(50 mg/kg)+1 d劑量加倍(100 mg/kg),無需禁食,建成的糖尿病模型較為穩定,成模率及成活率均較高,可作為1型糖尿病首選的建模方式。

