葉片衰老誘導FLP重組酶刪除轉基因煙草外源基因的研究
秦利軍,李啟龍,趙德剛,2
1 貴州大學農業生物工程研究院/山地植物資源保護與種質創新省部共建教育部重點實驗室,貴州貴陽甲秀南路 550025;
2 貴州省農業科學院,貴州貴陽金欣社區1號 550006
自1983年首次獲得轉基因煙草后,轉基因技術已廣泛應用到多種農作物中[1],但轉基因作物可能存在的環境及食品安全問題也備受關注[2]。標記基因剔除是利用特異位點重組實現轉基因植物中選擇標記基因的清除,從而獲得無選擇標記基因的植物(Marker-free transgenic plants,MFTPs)[3]。目前,在眾多標記基因清除技術中以位點特異性重組系統(Site-specific recombination)應用最為廣泛[4]。最常用的兩種位點特異性重組系統包括噬菌體(Phage)Pl的Cre/LoxP系統和啤酒酵母(Saccharomyces cerevisiae)的FLP/FRT系統[3,5-7]。Dale等[8]首次利用Cre/LoxP系統轉化煙草,成功實現了Cre重組酶對熒光素酶基因(Luc)、選擇標記基因(Hpt)的有效清除,清除率高達90%。之后該技術又成功應用到煙草(Nicotiana tabacum)[9]、擬南芥(Arabidopsis thaliana)[10]、玉米(Zea mays)[11]、水稻(Oryza sativa)[12]、大豆(Glycine max)[13]、馬鈴薯(Solanum tuberosum)[14]、番茄(Lycopersicum esculentum)[15]等多種作物中。FLP/FRT系統也同樣能刪除報告基因Gus和篩選基因NptⅡ,創立安全的轉基因水稻和玉米新品系[16,17]。但這兩種系統在應用上也存在一定的弊端,如可能引起基因重排和導致物種出現特異性缺陷等[18,19],使其應用受到一定限制。2007年,Li實驗室最先將噬菌體P1的Cre/LoxP系統和酵母(S.cerevisiae)的FLP/FRT系統融合成新的重組酶識別位點LF(LoxP-FRT),開創了“外源基因清除(Gene-Deletor)”技術。特異性啟動子驅動重組酶Cre或者FLP在適當的時間和空間表達后,重組酶即可識別兩個融合識別位點LF之間的序列(也包括重組酶自身基因序列),進而將這些序列在特定的時間和特定的部位從植物器官的細胞基因組中全部清除(圖1)。
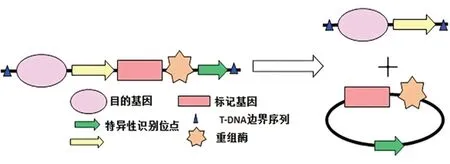
圖1 重組酶介導的標記基因刪除系統[20]Fig.1 Selectable gene-deletor system induced by site-specific recombinase
有研究者將該技術與特異性啟動子(如,花粉或種子特異表達啟動子)相結合,成功了實現了轉基因植物花粉或種子中外源基因的100%清除,為該系統的廣泛應用奠定基礎[21,22]。已有文獻報道,擬南芥(A.thaliana)SAG12基因可編碼半胱氨酸蛋白酶(cysteine protease),該基因表達不僅嚴格受發育調控的衰老途徑所特異性調節,而且僅在衰老組織中表達。啟動子缺失和片段重組的研究表明,SAG12啟動子的一個高度保守區域負責衰老特異性調控。從不同葉齡(年輕和衰老)的擬南芥葉片中分離到可與SAG12啟動子元件結合的差異結合因子[23]。Calderini[24]利用SAG12啟動子特異性地控制的IPT基因表達,從而延緩了紫花苜蓿(Medicago sativa)葉片的衰老。本研究以含有衰老特異表達基因SAG12啟動子驅動“LoxP/FRT”系統表達的轉基因煙草為材料,通過分析轉基因株系不同葉齡葉片、花藥及花粉中GUS的表達活性,研究轉基因煙草葉齡與GUS蛋白活性及除草劑草銨膦的抗性關系,探討“LoxP/FRT”系統在葉片中引起的外源基因清除效率;另外,通過轉基因煙草植株花粉中GUS染色數目的統計分析,計算外源基因清除系統在不同轉基因煙草株系花粉中的清除效率,為利用“LoxP/FRT”系統快速培育不含外源基因的轉基因煙草新種質提供一定參考。
1 材料與方法
1.1 材料、試劑與儀器
1.1.1 試驗材料
供試材料:野生型栽培煙草K326(N.tabacumL.cv.K326)、轉基因煙草株系Q1、Q2和Q3株系含有以擬南芥(A.thaliana)衰老基因SAG12啟動子PSAG12驅動重組酶FLP識別重組位點“別重組位點FRT”表達的清除系統和含有普通煙草(N.tabacum)泛素蛋白基因Ubi啟動子PUbi啟動的草甘膦篩選和GUS報告的融合基因Gus::Bar,其植物表達載體pGM626-SAF-Ucn(見圖2A),Q1和Q3株系均含1個外源基因拷貝,Q2株系含2個外源基因拷貝;轉基因株系Q0中所轉的表達元件除不含FLP基因,其它與Q1、Q2和Q3株系相同,其植物表達載體pGM626-SA-Ucn(見圖2B)。
將野生型K326、Q0、Q1、Q2和Q3株系的種子撒播于煙草育苗盤上進行漂浮培養。待煙苗長至3~5葉期時,各取25株生長良好、長勢一致的轉基因及野生型煙草,分別移栽至含培養基質(菜園土∶Hawita泥炭土=3∶1)的花盆(高16 cm,直徑20 cm,培養基質10 kg)中繼續生長,每盆種1株苗。每盆施1~2 g復合肥(N ∶ P2O5∶ K2O=10∶ 10∶12),期間追肥1次。種植條件:相對濕度70~80%,16 h光照 /8 h 黑暗,25~28 ℃。
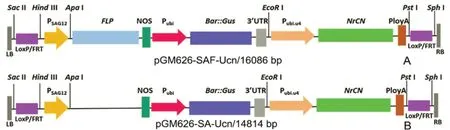
圖2 植物表達載體pGM626-SAF-UCn和pGM626-SA-Ucn圖譜Fig.2 Construction of plants expression vectors pGM626-SAF-UCn and pGM626-SA-Ucn
1.1.2 試劑
草銨膦(Phosphinothricin,PPT)購自美國Sigma公司;Plant DNA Kit購自天根(北京)生物科技有限公司;Plant RNA Kit購自美國 OMEGA Bio-Tek 有限公司;DL 2000 DNA Marker購自日本 Takara(大連)生物公司;MultiScribeTMReverse Transcriptase Kit、Power SYBR?Green PCR Master Mix購自于美國Applied Biosystems公司;可溶性糖測定試劑盒購自南京建成生物工程研究所;引物由上海旭冠生物科技有限公司合成。
1.2 方法
1.2.1 轉基因煙株的PCR鑒定
根據Plant DNA Kit試劑盒操作說明書提取萌發至3~5葉期煙株的總基因組DNA。以基因組DNA為模板,用引物FUbi.U4(5'-AGGAGCCTCTTTGTTCCC-3')和RUbi.CN(5'-TCATTCAAACAC -CACCTCG-3')對特異性片段U4-CN(含550 bp煙草PUbi.U4序列和257 bp CN基因序列)進行擴增。PCR擴增條件:94℃ 3 min;94℃ 20 s,58℃ 30 s,72℃ 1 min,30個循環;72℃ 5 min。
1.2.2 轉基因煙草不同組織GUS活性分析
以移栽 25 d、30 d、45 d、60 d 轉基因煙草葉片和現蕾期花藥為材料,分析GUS蛋白在兩者中的表達活性。分別對移栽 25 d、30 d、45 d、60 d 時的相同葉位轉基因煙草小葉塊(約1 cm2左右)進行GUS活性分析,每個株系選3個單株取樣進行葉塊染色實驗另剪取現蕾期轉基因煙株的花藥(每個株系各取8個花藥)和收集盛花期轉基因煙株的花粉(每個株系單株套袋收集花粉),分別置于含有GUS染液的0.5 mL離心管中進行GUS染色。將浸沒于GUS染色液的煙草葉塊、花藥及花粉分別置于真空濃縮儀(ZLS-1)中,以25 Kpa壓力抽真空15 min后放入37℃恒溫培養箱中孵育過夜。次日依次以95%乙醇、75%乙醇、50%乙醇和20%乙醇逐級梯度浸提葉片色素,以便觀察GUS染色結果。GUS染色液配置:100 mmol/L Tris-HCl,0.5 mmol/L NaCl,0.02 mmol/L K3Fe(CN)6,50 mmol/L CH3OH,8.65 μmmol/L X-Gluc(5-溴 -4-氯 -3-吲哚 -β-D-葡萄糖苷酸)。以野生型植株葉塊、花藥及花粉為對照。
1.2.3 轉基因煙草對草銨膦敏感性分析
轉基因煙草含有Bar::GUS融合篩選報告基因,其中Bar基因對除草劑草銨膦具有抗性。分別對不同轉基因株系上、中和下部葉片(不同葉位葉片代表葉齡的差異)進行草銨膦(4 mg/L)涂抹處理,觀察草胺膦處理 5 d、9 d、16 d后對煙株上、中和下部葉片形態變化的影響,每個株系選3株進行處理,以野生型煙草處理為對照。
1.2.4 葉片外源基因的表達量分析
根據Plant RNA Kit操作說明書提取不同移栽天數(移栽后 10 d、25 d、40 d 和 60 d)轉基因株系葉片的總RNA,并反轉錄成cDNA。采用反轉錄PCR(Reverse transcription PCR,RT-PCR)和實時熒光定量PCR(Real-time PCR,PCR)技術對外源Bar::Gus和FLP基因的表達量進行分析,以Actin為內參。每個轉基因株系各取5株,為5次重復,以非轉基因煙草為對照,基因引物序列見表1。

表1 外源基因表達量分析的引物序列Tab.1 Primer sequences of relative expression analysis for exogenous genes
1.2.5 外源基因刪除率的分析
轉基因煙草植株花粉進行GUS染色后,在光學顯微鏡下分別記錄各煙株花粉細胞的染色情況,每個株系各選5個單株進行花粉染色觀察。分別統計各單株的藍色和白色花粉數目,并以此計算外源基因在轉基因煙草花粉中的刪除率。計算公式:
GUS染色陽性率=染色呈藍色花粉數/總花粉數×100%
1.2.6 數據處理
采用 Microsoft Excel 2003 及 SPSS 16.0 軟件進行數據處理,Duncan法分析其差異顯著性。
2 結果
2.1 轉基因煙草移栽及鑒定
對萌發至苗期的T2代轉基因煙草植株進行GUS染色和PCR擴增檢測,共獲得3個獨立轉基因株系及空載體對照煙草植株54株,其中Q1株系13株、Q2株系10株、Q3株系15株,Q0株系16株,種植的轉基因植株中部分在生長過程中死亡,移栽存活的株系GUS染色和PCR擴增均呈陽性(圖3A,3B)。農藝性狀測定結果表明,各轉基因煙株在旺長期、盛花期和成株期的株高、葉片數、開花期等形態指標與野生型煙株相比均無顯著差異(圖4)。
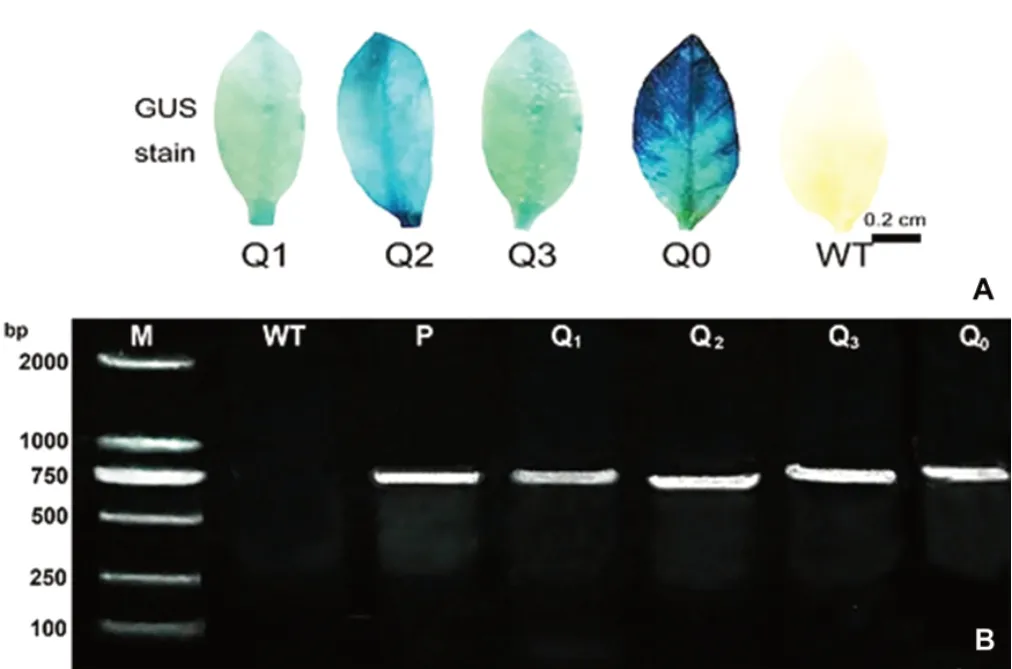
圖3 轉基因株系GUS染色及PCR鑒定Fig.3 GUS staining and PCR identification of transgenic lines

圖4 轉基因煙草與非轉基因煙草形態特征比較Fig.4 Comparison of morphological characteristics between transgenic lines and wild type lines
2.2 轉基因煙草GUS染色活性分析
轉基因植株同一生長期葉片GUS組織化學染色表明,各獨立轉基因株系中GUS表達強弱有一定的差異,以Q2株系活性最強,Q3株系次之,Q1株系最弱(圖5),說明不同株系表現出的GUS蛋白活性差異可能是由外源報告基因GUS的拷貝數不同所引起,之前的外源基因拷貝數分析結果表明轉基因植株含有1-2個拷貝的外源基因[25]。為了進一步分析外源基因清除效率與葉片衰老間的關系,對不同移栽天數(25 d、30 d、45 d 和 60 d)轉基因煙草葉塊進行GUS染色,結果表明三種獨立轉化的煙草株系(Q1、Q2和Q3)葉片GUS活性均表現隨取材的衰老而逐漸降低(圖5)。當煙株移栽60 d后,Q1株系低葉位葉片中幾乎檢測不到GUS蛋白活性,說明葉片的衰老引起了外源GUS蛋白表達量下降。另外,轉基因煙草花粉染色結果顯示,不同轉基因株系(Q1、Q2及Q3)花粉中也表現出了不同程度的外源基因清除(圖6A)。其中以Q1株系花粉中外源基因平均清除效率最高,其次是Q3,而Q2植株中外源基因清除效率最低。不同轉基因煙株其花藥GUS著色表現出一定程度的差異(圖6B)。

圖5 不同轉基因株系及不同葉齡葉片GUS組織化學染色觀察Fig.5 Observation of GUS stain in different transgenic plants and at different leaf stages
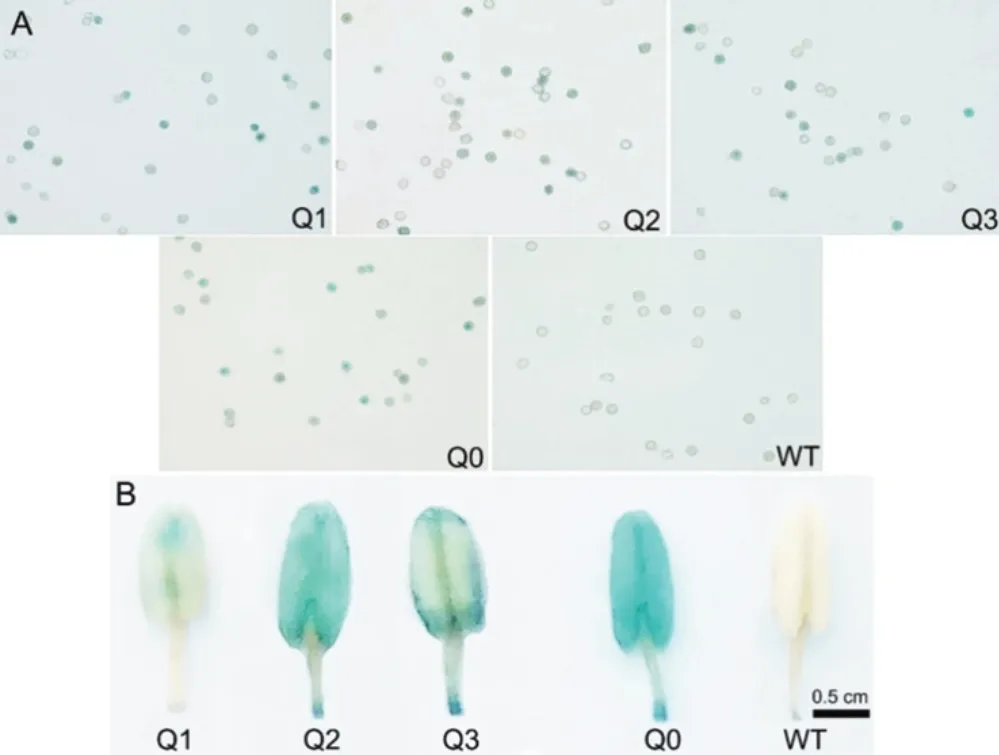
圖6 不同煙草株系花藥及花粉粒GUS組織化學染色Fig.6 GUS stain for anthers and pollen grains in different tobacco lines
2.3 轉基因煙草除草劑抗性分析
分析不同生育期煙草葉片對除草劑PPT的敏感性,結果顯示PPT處理煙草植株5 d時,轉基因和非轉基因煙草植株立即出現對PPT敏感的應答差異。Q2植株對草銨膦的敏感性最低,表現為草銨膦處理后葉片沒有出現明顯的黃化現象,而野生型對除草劑表現最為敏感,處理5 d后嫩葉出現明顯變黃特征。當草銨膦處理9 d時,轉基因株系Q1和Q3中部及下部葉片對PPT的敏感性逐漸增強,其中以Q3株系敏感性增幅最為顯著,此時Q2株系中部葉片仍對PPT表現出較弱的敏感性(圖7)。但隨著植株的生長成熟,各獨立轉基因株系葉片均表現對草銨膦敏感,且部分轉基因植株下部的葉片對草銨膦表現出的敏感性與野生型植株相當,說明隨著轉基因植株葉片的衰老,外源篩選基因Bar也逐漸發生了清除。
2.4 轉基因煙草外源基因表達量分析
外源基因Real-time PCR分析結果表明,不同轉基因煙株外源基因(重組酶FLP基因和篩選報告Bar::GUS融合基因)表達量變化表現出一定差異。隨著移栽天數推移、葉片的生長發育,葉片中外源FLP基因起始表達且表達水平呈逐漸上升趨勢,移栽第40 d時FLP基因的表達水平最高,分別比移栽第60 d時增加1.21倍(Q1株系)、2.52倍(Q2株系)和1.35倍(Q3株系);另外,外源篩選報告融合基因Bar::GUS表達水平總體呈現隨著移栽天數的推移而下降的趨勢,但以Q1和Q3株系中Bar::GUS基因量的降幅最大,移栽第60 d時這兩個株系中的Bar::GUS基因幾乎無表達,但Q2中仍能檢測Bar::GUS基因表達(圖8A),這一實驗結果與之前發表的研究結果一致[25]。外源基因的RT-PCR分析結果也表明,移栽第10 d時轉基因株系Q1、Q2和Q3中均有較高水平的Bar::Gus表達,Q2中Bar::Gus表達量最高,之后在移栽第40 d時轉基因各株系中Bar::Gus基因表達隨之下降,以Q1和Q3植株中外源基因表達量降幅最顯著;而FLP基因在移栽早期(10 d)在所有轉基因植株中都有表達但表達量不高,移栽后期(40 d)FLP基因在Q1和Q3株系中表達量極低,在Q2中表達量較高(圖8B)。

圖7 轉基因煙草不同生育期葉片對除草劑草銨膦的抗性比較Fig.7 Comparison of phosphinothricin-resistance in leaves at different growth periods between transgenic and wild type tobacco plants

圖8 轉基因煙草葉片中外源基因表達量分析Fig.8 Expression analysis of exogenous genes in transgenic tobacco plants
2.5 轉基因煙草花粉中外源基因清除效率統計
不同株系不同單株間花粉外源基因清除效率統計見表2,統計結果顯示外源基因清除效率介于51.3~83.6%之間,說明葉片衰老特異啟動引起的外源基因清除事件也可在配子細胞的外源基因清除中具有一定作用。

表2 轉基因煙草花粉中外源基因清除效率(GUS蛋白為標記)Tab.2 Excision efficiency of exogenous gene in pollen of transgenic tobaccos
3 討論
轉基因育種在培育高產、優質、抗逆、廣適的作物新品過程中具有高效、穩定、周期短、成本低等優點,是當前作物育種的一種新策略[26],但轉基因作物可能存在將其外源基因以多種途徑擴散到自然界并破壞生態平衡的潛在風險[2,7]。2007年,美國康涅狄格大學李義教授領導的研究小組建立了“GM-genedeletor”技術,利用該技術不僅實現當代轉基因煙草中外源基因的100%刪除,而且還證明這種“清除系統”能在無性生殖后代中可得到穩定的遺傳[21]。本研究以含PSAG12::LoxP/FRT元件的轉基因煙草為材料,分析葉片衰老特異表達基因SAG12啟動子驅動外源基因清除的效率,分析結果表明不同轉基因株系外源報告基因GUS表達有一定差異,以Q2植株GUS著色最深,Q3植株次之,Q1植株最弱,推測Q2植株中GUS的高表達可能與GUS基因拷貝數多有一定關系。但這三個株系GUS活性均具有隨葉片的衰老而降低的特點;同樣轉基因煙草對PPT的抗性實驗分析表明,Q2對PPT的抗性最強,Q3株系和Q1株系較弱。煙草葉片對PPT的抗性也表現為隨葉片衰老,抗性由強至弱的變化趨勢,與GUS染色結果一致,說明Bar::GUS基因表達與葉齡呈負相關,即葉片的衰老導致了低外源篩選報告基因的表達水平。轉基因植株中Bar::GUS的Real-time PCR和RT-PCR分析結果也驗證了葉齡與外源篩選報告基因表達的負相關性。同時,對外源重組酶基因FLP的基因表達分析顯示,FLP表達量表現為移栽早期低、中期高、后期低的變化趨勢,說明轉基因植株隨著發育、成熟,SAG12基因啟動子驅動的FLP基因起始表達且表達水平隨葉片衰老而不斷增強,進而引起FLP啟動包含特異位點兩端間的外源基因片段刪除,故移栽后期FLP和Bar::GUS基因均發生了清除,這個結果與之前的研究一致[25]。高媛媛等[27]利用熱擊蛋白hsp18.2基因啟動子驅動熱擊誘導的FLP表達,獲得外源基因清除的轉基因煙草;之后李巖等[28]也將該熱擊啟動刪除系統應用到矮牽牛(Petunia hybrida)中,實現了轉基因矮牽牛中報告基因GUS的清除。以上結果表明,“GM-gene-deletor”系統能與目標啟動子結合實現外源基因的特異時空的清除。轉基因煙株花粉GUS活性測定表明,Q1植株外源基因清除效率平均為78.32%、Q2為54.66%、Q3為75.24%,說明葉片衰老特異基因SAG12啟動子也能在煙草花粉中表達,實現花粉細胞中外源基因的刪除,表明該系統不僅能有效啟動衰老葉片中外源基因的清除,同時也會引起成熟花粉中外源基因的清除,且外源基因清除效率介于51.3—83.6%之間。盡管Noh等[23]報道認為,SAG12的表達嚴格受發育調控的衰老途徑所特異性激活,而不受應激或激素控制的途徑所調節,但SAG12啟動子的完全活性至少需要2個結構域協同發揮作用。Grbi?等[29]在研究擬南芥(A.thalianaL.)植物的SAG2和SAG12基因表達模式時也發現SAG12基因同樣也會在衰老花粉中特異性表達。綜上所述,利用“GM-gene-deletor”系統結合不僅可以實現外源基因的清除,同時可以通過將“GM-gene-deletor”系統中啟動子序列進行替換實現外源基因特異性的刪除(如開花啟動刪除、乙醇誘導刪除等),進而保障和提高轉基因植物的安全性,為培育不含選擇標記的轉基因煙草新種質提供理論基礎。
4 結論
轉基因煙株葉片衰老可誘導外源重組酶基因FLP表達,其表達產物FLP重組酶特特異性識別LoxP/FRT融合位點,進一步引起包括篩選報告融合基因GUS::Bar及外源重組酶基因FLP在內的所有外源基因的清除。該啟動子還能誘導煙株配子細胞中外源基因的刪除。
本研究可為利用該系統實現轉基因植株中外源基因的特定時空清除、培育不含選擇標的轉基因煙草新種質提供支持。

