對高考試題與教材中電極反應書寫形式差異的探討
余曉光
摘要: 對電解時有水參與的電極反應的書寫形式,在人教版及多種版本高中化學教材中表示的是水電離出的離子參與反應。而在近幾年的高考試題中凡是要求書寫電解時水參與的電極反應式的參考答案全部是以H2O直接放電來書寫。對兩種書寫形式的差異產生的原因進行分析,同時也為教師的教學和高考命題提出合理化建議。
關鍵詞: 電解; 電極反應; 高考試題; 教材
文章編號: 10056629(2020)12008404
中圖分類號: G6338
文獻標識碼: B
1問題由來
對電解時有水參與的電極反應的書寫形式,在人教版高中化學教材選修4《化學反應原理》的第四章第3節[1]中,電解飽和食鹽水時陰極的電極反應書寫為: 2H++2e-H2↑,表示是水電離出的H+參與了反應。在不同版本的高中化學教科書和各種教輔資料中對電解時有水參與的電極反應的書寫形式,在講解及歸納時都是以水電離出的H+或OH-參與反應來書寫的。但是在近幾年的高考試題中凡是要求寫電解時水參與的電極反應式的參考答案全部是以H2O直接放電來書寫的。
下面是近幾年涉及到電解時水參與的電極反應式書寫的高考試題。
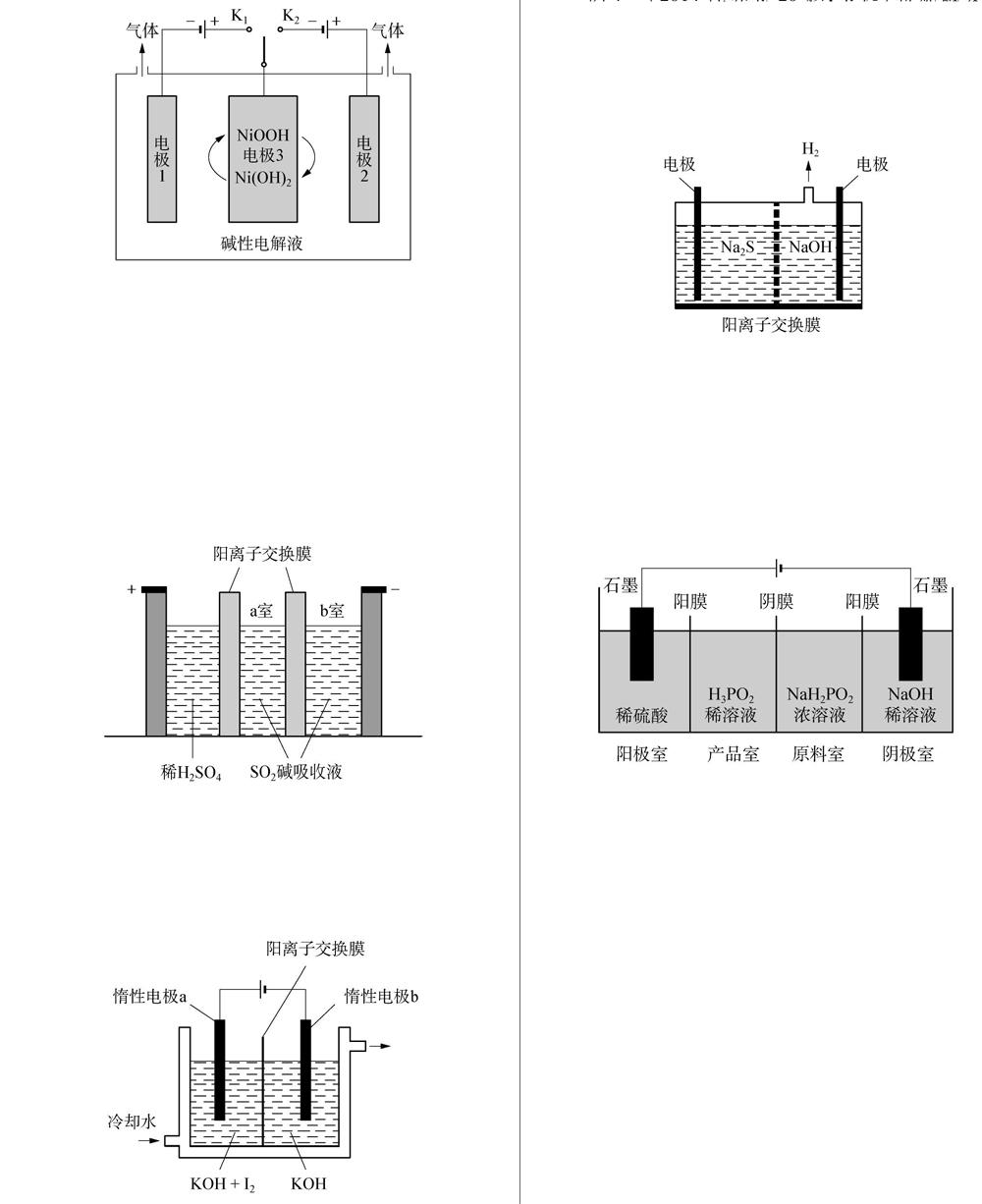
例1(2019北京卷27題,節選)可利用太陽能光伏電池電解水制高純氫,工作示意圖如下。通過控制開關連接K1或K2,可交替得到H2和O2。
制H2時,連接。產生H2的電極反應式是。
參考答案: K12H2O+2e-H2↑+2OH-
例2(2018新課標Ⅰ卷27題,節選)制備Na2S2O5也可采用三室膜電解技術,裝置如圖所示,其中SO2堿吸收液中含有NaHSO3和Na2SO3。陽極的電極反應式為。
參考答案: 2H2O-4e-4H++O2↑
例3(2018新課標Ⅲ卷27題,節選)KIO3也可采用“電解法”制備,裝置如圖所示。
寫出電解時陰極的電極反應式。
參考答案: 2H2O+2e-H2↑+2OH-
例4(2014江蘇卷20題,節選)將燒堿吸收H2S后的溶液加入到如題20圖1所示的電解池的陽極區進行電解。電解過程中陽極區發生如下反應: S2--2e-S, (n-1)S+S2-S2-n。
寫出電解時陰極的電極反應式: 。
參考答案: 2H2O+2e-H2↑+2OH-
例5(2014新課標Ⅰ卷27題,節選)H3PO2也可用電滲析法制備。“四室電滲析法”工作原理如圖所示(陽膜和陰膜分別只允許陽離子、陰離子通過):
寫出陽極的電極反應式。
參考答案: 2H2O-4e-4H++O2↑
電解時有水參與的電極反應式的參考答案無一例外都以H2O放電來書寫。并且在2018年湖北和湖南兩省新課標Ⅰ卷27題最終的閱卷評分細則中提到只能寫H2O放電,寫成OH-放電0分,因為是硫酸的酸性溶液。而在2018年山東省的閱卷評分細則中寫成H2O或OH-放電均給分。而更不可思議的是同樣是湖北省在2014年新課標Ⅰ卷27題最終的閱卷評分細則中寫成H2O或OH-放電均給分[2]。
高考試題與教材中電極反應書寫形式的差異容易給高中教師和學生的教學活動帶來困惑并造成干擾。教師按課本教、學生按課本學結果寫出來的反應式卻不能得分。
2教育部考試中心對參考答案的解釋
教育部考試中心編寫的《高考理科試題分析(2015年版)》[3]中對2014新課標Ⅰ卷27題第(4)小題參考答案的解釋如下。
陽極室存在H2O、 SO2-4、 H+與OH-等物質。根據得電子難易程度,OH-優先在陽極得到電子發生反應:
4OH--4e-2H2O+O2↑
由于陽極室的電解質為稀硫酸,OH-濃度非常小,故陽極的電極反應式寫成:
2H2O-4e-4H++O2↑
陰極室存在H2O、 Na+、H+與OH-等物質。根據失電子難易程度,H+優先在陰極失去電子發生反應:
2H++2e-H2↑
由于陰極室的電解質為NaOH溶液,H+濃度非常小,故陰極的電極反應式寫成:
2H2O+2e-H2↑+2OH-
通過以上分析,不難得出陽極的電極反應書寫的正確答案:
2H2O-4e-4H++O2↑
3大學化學類教材或參考書中對電解時水參與的電極反應的書寫形式
對電解時有水參與的電極反應的書寫形式的差異應該是來源于大學化學類教材對電極反應的書寫形式的不同。筆者翻閱相關書籍,將各大學化學類教材或參考書中對電解時水參與的電極反應式表述如表1所示。
表1各大學化學類教材或參考書中電解時水參與的電極反應式
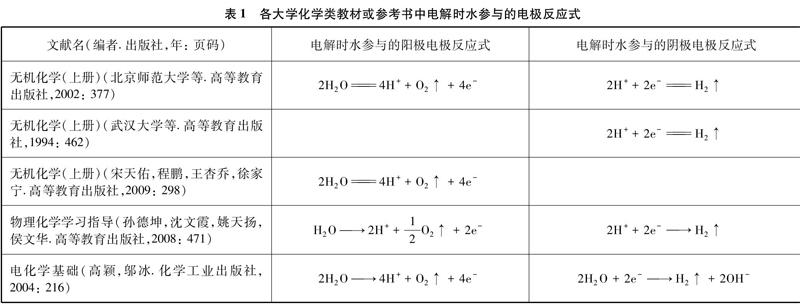
文獻名(編者.出版社,年: 頁碼)電解時水參與的陽極電極反應式電解時水參與的陰極電極反應式
無機化學(上冊)(北京師范大學等.高等教育出版社,2002: 377)2H2O4H++O2↑+4e-2H++2e-H2↑
無機化學(上冊)(武漢大學等.高等教育出版社,1994: 462)2H++2e-H2↑
無機化學(上冊)(宋天佑,程鵬,王杏喬,徐家寧.高等教育出版社,2009: 298)2H2O4H++O2↑+4e-
物理化學學習指導(孫德坤,沈文霞,姚天揚,侯文華.高等教育出版社,2008: 471)H2O2H++12O2↑+2e-2H++2e-H2↑
電化學基礎(高穎,鄔冰.化學工業出版社,2004: 216)2H2O4H++O2↑+4e-2H2O+2e-H2↑+2OH-
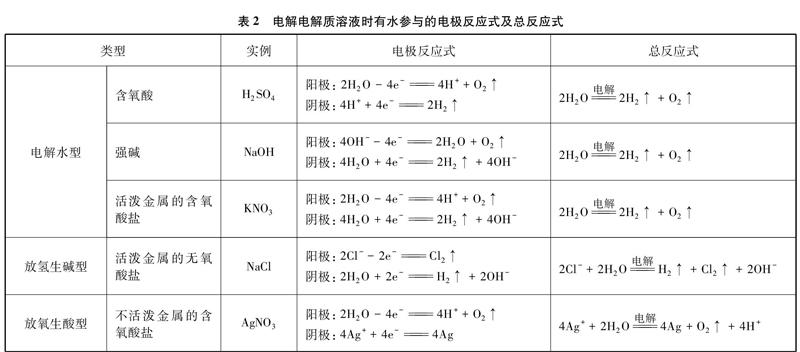
從上表可看出,這幾本大學化學類教材或參考書中對電解時水參與的陽極電極反應式都是H2O放電,但對于電解時水參與的陰極電極反應式則寫成H+或H2O放電。這就是在中學教材中電解飽和食鹽水時陰極的電極反應書寫為: 2H++2e-H2↑的根源。
但是在楊文治編著北京大學出版社出版的《電化學基礎》中明確說兩種寫法都可以。書中提到電解飽和食鹽水在陰極的鐵/溶液界面上,Na+并不能放電,倒是濃度極小的H+首先在電場作用下放電了,形成氫分子逸出: 2H++2e-H2↑。在堿性溶液中H+很少,故H2O直接放電: 2H2O+2e-2OH-+H2↑,從熱力學的角度,其效果與H+放電是一樣的,在不涉及電極反應機理時,以下討論都采用H+放電的表達式。
而楊綺琴、方北龍、童葉翔編著中山大學出版社出版的《應用電化學》卻根據氫在陰極析出的反應歷程和氧在陽極析出的反應歷程明確提出水放電時電極反應式中反應物要寫成H2O。書中提到電解水工業中氫析出反應若在堿性溶液中,不是H3O+還原,而是H2O還原。在酸性溶液中氧析出反應為: 2H2O4H++O2↑+4e-,在堿性溶液中氧析出反應為: 4OH-2H2O+O2↑+4e-。
4教學思考
從各大學化學類教材或參考書中對電解時水參與的電極反應的書寫形式可以看出,無論是寫成離子放電或是水放電都是可以的。但高考試題與中學教材中電極反應書寫形式差異確實給高中教師和學生的教學活動造成了干擾。那么在教學中如何盡可能排除這種干擾,既能讓學生容易理解和接受,又能在高考中不失分。
若按中學教材中的書寫方式,電解飽和食鹽水時的陽極反應: 2Cl--2e-Cl2↑,陰極反應: 2H++2e-H2↑,則兩極反應直接相加的離子方程式為2H++2Cl-電解H2↑+Cl2↑。這就讓我們在教學過程中要向學生反復強調當水參與電極反應時,書寫總反應的離子方程式時H2O要保留化學式,不能將兩極反應式直接相加。學生很難理解為什么將兩個半反應疊加不能得到正確的總反應式。另外,這種寫法從電極反應無法直觀地看出電解飽和食鹽水時陰極區同時生成H2和NaOH。若是將陰極電極反應式寫成2H2O+2e-H2↑+2OH-,則兩極反應直接相加的離子方程式為2Cl-+2H2O電解H2↑+Cl2↑+2OH-。也能直接從陰極電極反應式看出H2和NaOH是同時在陰極產生的。
以此類推,凡是有水參與的電極反應均寫成H2O放電的形式,歸納用惰性電極電解電解質溶液時有水參與的電極反應式及總反應式如表2所示。
當然,如果高考試題的參考答案能夠根據高中教材及教學的實際情況,將電解時有水參與的電極反應式的參考答案寫成兩種(H2O放電或離子放電)就更好了。
參考文獻:
[1]宋心琦主編. 普通高中課程標準實驗教科書·化學反應原理[M]. 北京: 人民教育出版社, 2007: 81.
[2]連國華, 張神排. 2014年湖北高考理科綜合(化學部分)評分細則[J]. 理科考試研究, 2015, (5): 38.
[3]教育部考試中心. 高考理科試題分析(2015年版)[M]. 北京: 高等教育出版社, 2015: 400.

