miR-124通過hClock調控人結直腸癌進展的機制研究
楊沔 沈迎春 賀海斌 錢海龍 俞仲輝 江州華 裘豐
生物節律的破壞是導致人類結直腸癌(colorectal cancer,CRC)發生、發展的內源性因素之一[1-3]。盡管哺乳類動物的晝夜節律已被廣泛研究,但多數研究只是基于轉錄水平的負性調控及轉錄后水平的修飾[4]。近年來,有學者致力于微小RNA(microRNA,miRNA)的研究。miRNA幾乎可以調控整個細胞代謝進程,如細胞增殖、凋亡等[5-7]。miR-124作為腫瘤抑癌基因,通過一些特殊靶點(如STAT3、SMC4、iASPP等)發揮CRC抑制作用也常被報道[8-11]。但是,miR-124與生物鐘基因hClock之間是否存在調控作用尚未清楚。本研究就miR-124通過hClock調控人CRC進展的機制作一探討,現將結果報道如下。
1 對象和方法
1.1 對象 選取2015年12月至2016年12月在寧波市醫療中心李惠利醫院東部院區行CRC根治術的50例患者為研究對象,所有患者術后病理檢查證實為CRC,術前均未行放化療。其中男28例,女22例;年齡35~82(56.3±13.8)歲。術中將患者的癌組織標本立即投入液氮中暫存,術后放入-80℃冰箱保存待檢。
1.2 hClock蛋白表達檢測 采用免疫組化染色法。取癌組織標本,甲醛固定、石蠟包埋、切片(4 μm 厚);脫蠟、切片、水化、枸櫞酸緩沖液(0.01 M,pH 6.0)10 min微波抗原修復;單克隆抗體 hClock(cat#5157,1:100 dilution,美國Cell signaling Technology公司)4℃孵育過夜。PBS簡單清洗后,加二抗(#A31460,1:500 dilution,美國Thermo Fisher公司)37°C孵育60 min。PBS再次清洗,DAB顯色試劑盒染色5~10 min,常規蘇木素復染細胞核1 min,在光學顯微鏡(×400)下觀察細胞染色情況。由2位病理科醫生獨立評估染色強度(無著色為0分,弱著色為1分,中度著色為2分,強著色為3分)及染色細胞百分比,計算免疫組化評分。免疫組化評分=染色強度評分×染色細胞百分比,≥1.5分為hClock蛋白高表達,<1.5分為hClock蛋白低表達。
1.3 miR-124表達檢測 采用qPCR法。(1)RNA抽提及逆轉錄:用Trizol試劑提取CRC組織樣本中的總RNA,分光光度計檢測總RNA含量。總RNA通過特異的miRNA逆轉錄試劑盒及miR-124莖環結構逆轉錄引物進行逆轉錄。引物序列:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCATTC-3'。(2)PCR反應:加入SYBR-green的成熟miR-124的PCR擴增反應體系,在PCR儀(Corbett,美國Bio-Rad公司)上進行反應,反應體系包括 cDNA 4 μl、10 mmol/L引物4 μl(上、下游引物各2 μl)、PCR Master Mix 10 μl、水2μl,最終配成20 μl反應體系。反應參數:95℃5 min;95℃5 s,60 ℃ 30 s,72 ℃ 5 s,40個循環。qPCR 引物序列:正義為 5'-GCTAAGGCACGCGGTG-3',反義為 5'-CAGTGCAGGGTCCGAGGT-3'。根據每例患者癌組織與癌旁正常組織miR-124相對表達量的比值不同分為兩組,即miR-124低表達組(比值<2)和miR-124高表達組(比值≥2)[12-13]。
1.4 miR-124生物信息學靶點預測 采用雙熒光素酶報告實驗。使用3種靶點預測軟件TargetScan(http://www.targetscan.org)、PicTar(http://pictar.mdc-berlin.de/cgibin/new_vertebrare.org)、miRNA.org(http://www.microrna.org)對miRNA在hClock 3'-非翻譯區上的靶點進行預測。將野生型或突變型的hClock 3'-非翻譯區基因克隆到雙熒光素酶報告基因中,進一步驗證hClock是否為miR-124的直接調控靶點。
1.5 統計學處理 采用SPSS 18.0統計軟件。計量資料用±s表示,組間比較采用兩獨立樣本t檢驗;計數資料用率表示,組間比較采用χ2檢驗。CRC患者癌組織miR-124表達與hClock蛋白表達的相關性分析采用Pearson相關。P<0.05為差異有統計學意義。
2 結果
2.1 不同臨床特征CRC患者癌組織hClock蛋白高表達率比較 CRC患者癌組織hClock蛋白高表達率為52.0%(26/50)。不同TNM分期及有無淋巴結轉移患者癌組織hClock蛋白高表達率比較,差異均有統計學意義(均P<0.05);不同性別、年齡及腫瘤位置、組織學分級、浸潤深度的患者癌組織hClock蛋白高表達率比較,差異均無統計學意義(均P>0.05),見表1。
2.2 不同臨床特征CRC患者癌組織miR-124低表達率比較 CRC患者癌組織miR-124低表達率為68.0%(34/50)。有無淋巴結轉移患者癌組織miR-124低表達率比較,差異有統計學意義(P<0.05);不同性別、年齡及腫瘤位置、組織學分級、浸潤深度、TNM分期的患者癌組織miR-124低表達率比較,差異均無統計學意義(均P>0.05),見表 2。
2.3 CRC患者癌組織miR-124表達與hClock蛋白表達的關系 CRC患者癌組織miR-124低表達34例,高表達16例。miR-124高表達組hClock蛋白表達的免疫組化評分為(1.13±0.61)分,明顯低于miR-124低表達組的(1.71±0.54)分,差異有統計學意義(t=2.67,P<0.05),免疫組化染色結果見圖1。CRC患者癌組織miR-124相對表達量與hClock蛋白表達的免疫組化評分呈負相關(r=-0.798,P<0.01)。
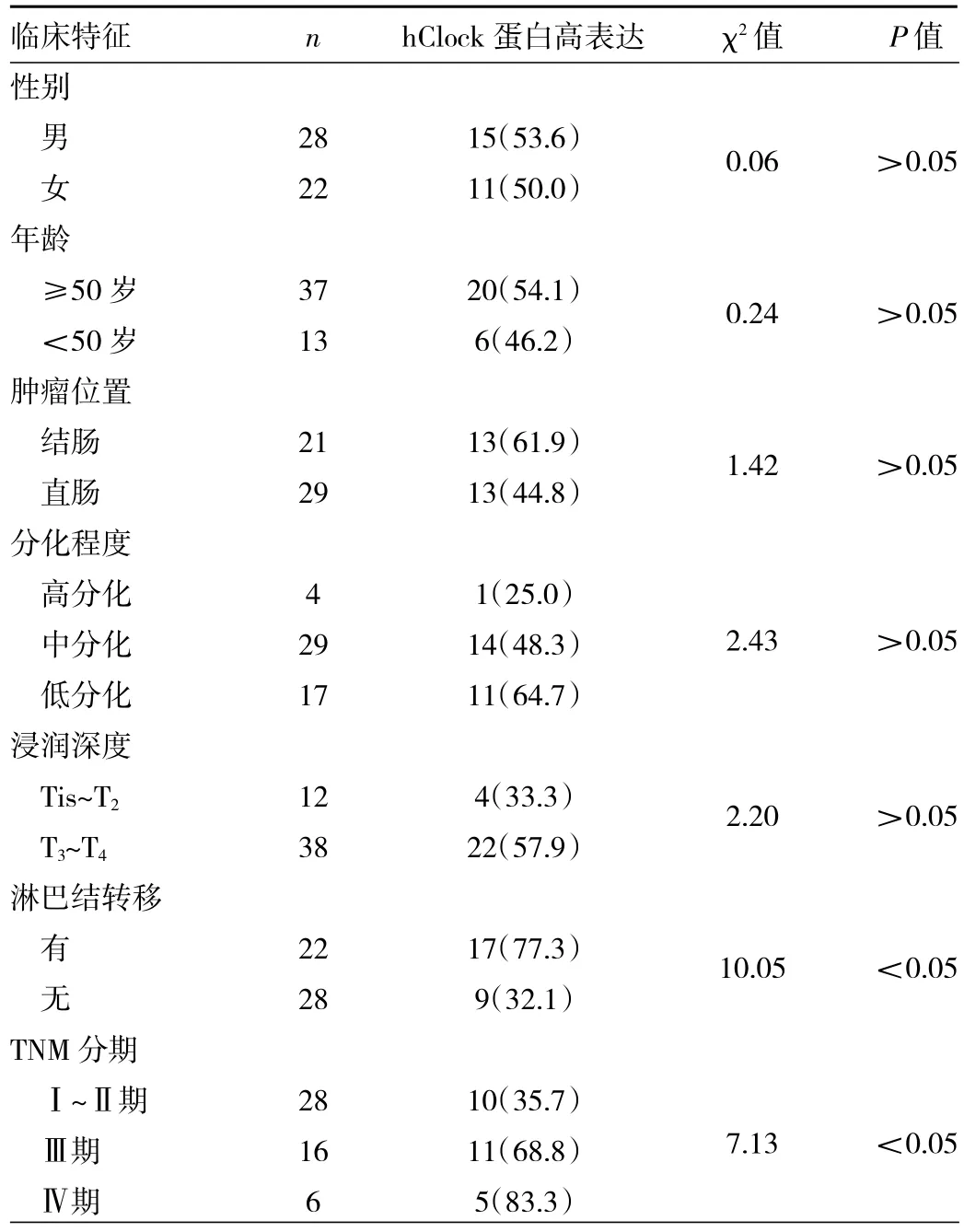
表1 不同臨床特征CRC患者癌組織hClock蛋白高表達率比較[例(%)]

圖1 miR-124高、低表達組結直腸癌(CRC)患者癌組織中hClock蛋白表達情況(a:miR-124高表達組;b:miR-124低表達組;免疫組化染色,×400)
2.4 miR-124生物信息學靶點預測 3種常用的靶點預測信息軟件(TargetScan、PicTar、miRNA.org)都預測到miR-124-3p可能與hClock 3'-非翻譯區相結合;經雙熒光素酶報告實驗驗證,推測hClock可能是miR-124的直接調控靶點,見圖2。
3 討論
當前,雖然CRC的治療策略有了較大的進步,但是患者預后仍較差。對CRC發生、發展的分子機制進行深入研究,可能對進一步完善治療策略具有重要價值[14-15]。生物鐘基因調控的晝夜節律紊亂可能是CRC發生、發展的內源性因素之一。但是作為核心生物鐘基因的hClock在CRC發生、發展中的具體調節機制尚未完全清楚。

表2 不同臨床特征CRC患者癌組織miR-124低表達率比較[例(%)]
本研究通過生物信息學對調節hClock的miRNA進行預測,發現miR-124直接與hClock 3'-非翻譯區相結合。相關研究表明,miR-124在CRC中表達下調,然后通過結合一些特異基因發揮抑癌基因作用;而miR-124表達下調可能與上游啟動子甲基化有關[14]。筆者推測在CRC中,miR-124啟動子甲基化可能是決定其表達下調而hClock表達上調的原因之一。為搞清楚這個問題,本研究對人CRC組織中miR-124及hClock表達進行了檢測,結果顯示不同TNM分期及有無淋巴結轉移患者癌組織中hClock蛋白高表達率比較,以及有無淋巴結轉移患者癌組織中miR-124低表達率比較,差異均有統計學意義;miR-124高表達組hClock蛋白表達的免疫組化評分明顯低于miR-124低表達組,CRC患者癌組織中miR-124相對表達量與hClock蛋白表達的免疫組化評分呈負相關。然后使用3種常用的靶點預測信息軟件,發現都能預測到hClock是miR-124的直接調控靶點。因此,筆者認為hClock是miR-124的直接調控靶點,miR-124通過與hClock 3'-非翻譯區結合,在轉錄后水平對hClock表達進行調節。
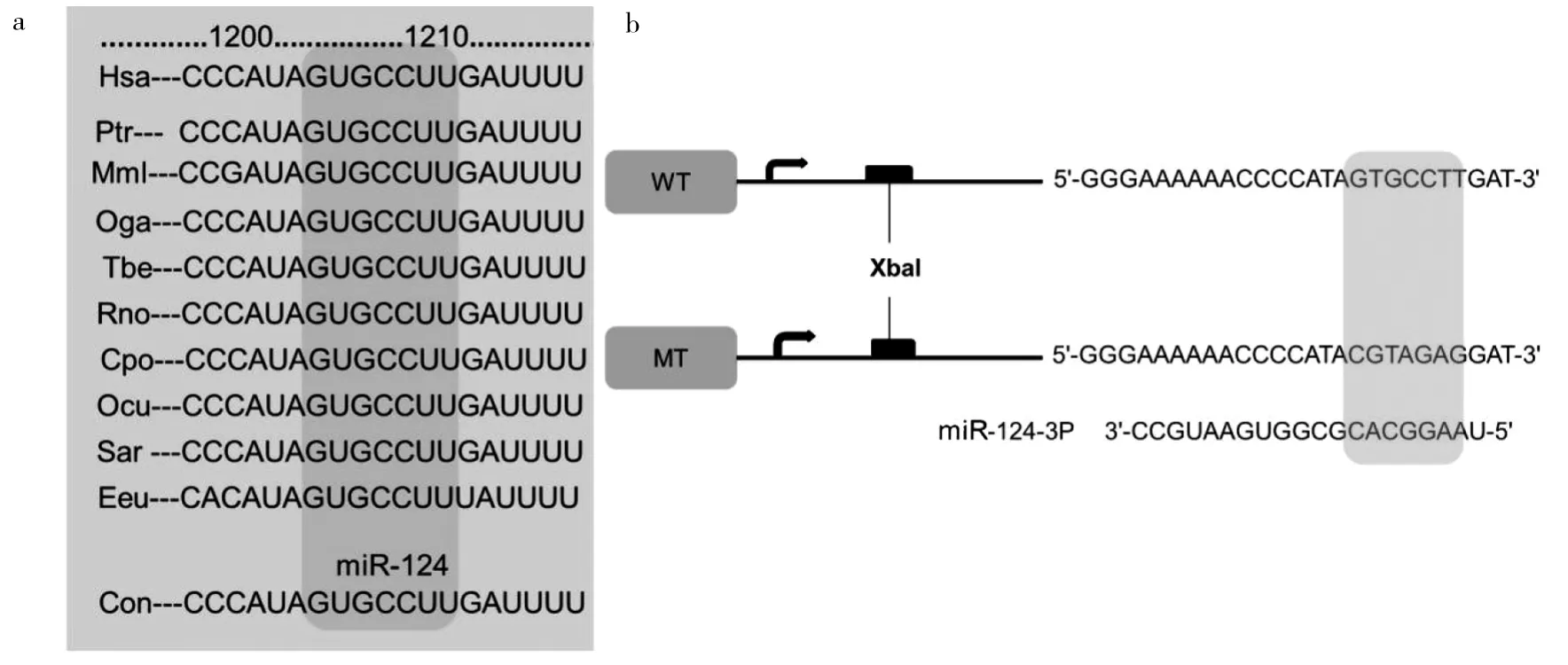
圖2 miR-124生物信息學靶點預測(a:在不同物種間,miR-124與hClock的3'-非翻譯區結合的靶序列是段保守序列;b:雙熒光素酶報告實驗)
綜上所述,miR-124通過調控hClock促進人CRC的進展;miR-124表達下調可能是促進人CRC進展的原因之一。本實驗結果為hClock的促癌作用及miR-124的抑癌作用提供了一定的證據,而在CRC細胞中hClock是否為miR-124的直接調控靶點,有待進一步實驗證實。

