基于SNP標記的西瓜種質資源遺傳多樣性分析
易麗聰 王運強 焦春海 姚明華 龔鈺 王舒景 戴照義
摘? ? 要:種質資源遺傳背景狹窄是當前西瓜育種面臨的一大瓶頸。利用449個SNP標記對64份西瓜材料進行遺傳多樣性分析,結果表明,平均多態性信息含量(PIC)為0.229,平均Neis多樣性指數(H) 為0.28,平均Shannon 多樣性指數(I)為 0.43,平均期望雜合度(He)為0.282;64份材料的最優群體結構數為4,各亞群材料的地理來源與遺傳關系沒有顯著相關性;材料之間的平均遺傳距離為0.175。農藝性狀統計分析表明,4個亞群在首雌花節位、坐果節位和果皮厚度3個性狀之間存在顯著差異。本研究將為西瓜種質資源創制、雜交育種的親本選擇和培育優異、適應性強的西瓜新品種提供理論依據。
關鍵詞:西瓜;種質資源;遺傳多樣性;SNP標記
中圖分類號:S651 文獻標志碼:A 文章編號:1673-2871(2020)12-008-06
Abstract: Watermelon is an important fruit in China, the narrow genetic background of germplasm resources is a bottleneck problem in watermelon breeding, 449 SNP markers were used to analyze the genetic diversity of 64 watermelon germplasms in this research. The results showed that, the average polymorphism information content (PIC) was 0.229, the average Nei's diversity index (H) was 0.28, the average Shannon's information index (I) was 0.43, and the average expected heterozygosity (He) was 0.282. The optimal subgroup number was 4, however, no significant correlation was found between the subpopulation and geographic origin. The average genetic distance between the 64 watermelon accessions was 0.175. According to the agronomic traits statistical analysis, the traits of the first female flower node, fruiting node and rind thickness were observed significant differences among the four subgroups. The results of this study will provide theoretical guidance for the creation of watermelon germplasm resources, the selection of parents in cross breeding and the breeding of new watermelon varieties with excellent and strong adaptability.
Key words: Watermelon; Germplasm; Genetic diversity; SNP markers
西瓜原產于非洲,在我國有上千年的栽培馴化歷史,不同生態區馴化產生了一系列形態特征差異明顯、各具特色的地方品種,如華北地區的‘三白瓜、蘭州的‘大花皮和江浙地區的‘馬鈴瓜等[1]。近年來,西瓜的種植面積和范圍迅速擴大,成為重要的經濟作物。目前,我國西瓜總生產面積達150萬hm2,面積、產量和銷量均居世界第一(FAOSTAT)。但是,長期的人工選擇和馴化也帶來許多問題,最突出的是育種材料遺傳多樣性狹窄[2-3],從而導致品種同質化嚴重,培育突破性新品種日益困難。
明確育種材料的遺傳背景有助于雜交育種中親本的選擇,進而提高培育雜種優勢明顯的新品種的效率。20世紀80年代,分子標記技術的出現迅速推動了對植物各性狀調控基因的定位、克隆和分子機制的解析[4-6]。在許多作物中與抗病、雄性不育、生育期等重要性狀相關的分子標記已經應用[7-10]。利用分子標記進行材料的遺傳背景鑒定和種質資源核酸指紋構建也在大部分植物中展開[11-13]。
西瓜是較早完成基因組測序的植物之一[14],北京市農林科學院蔬菜研究中心基于對西瓜屬7個種的414份資源的基因組重測序共鑒定出19 725 853個SNPs和6 675 290個InDels(Insertion-Deletion)標記[15]。該結果為西瓜種質資源鑒定、核酸指紋圖譜構建和基因定位提供了豐富的分子標記。在此基礎上,筆者挑選了覆蓋西瓜11條染色體的449個SNP位點,利用高通量SNP分型對64份西瓜自交系材料進行遺傳背景鑒定,解析其遺傳多樣性和群體結構,為西瓜雜交育種的親本選配和資源利用提供理論依據。
1 材料與方法
1.1 材料
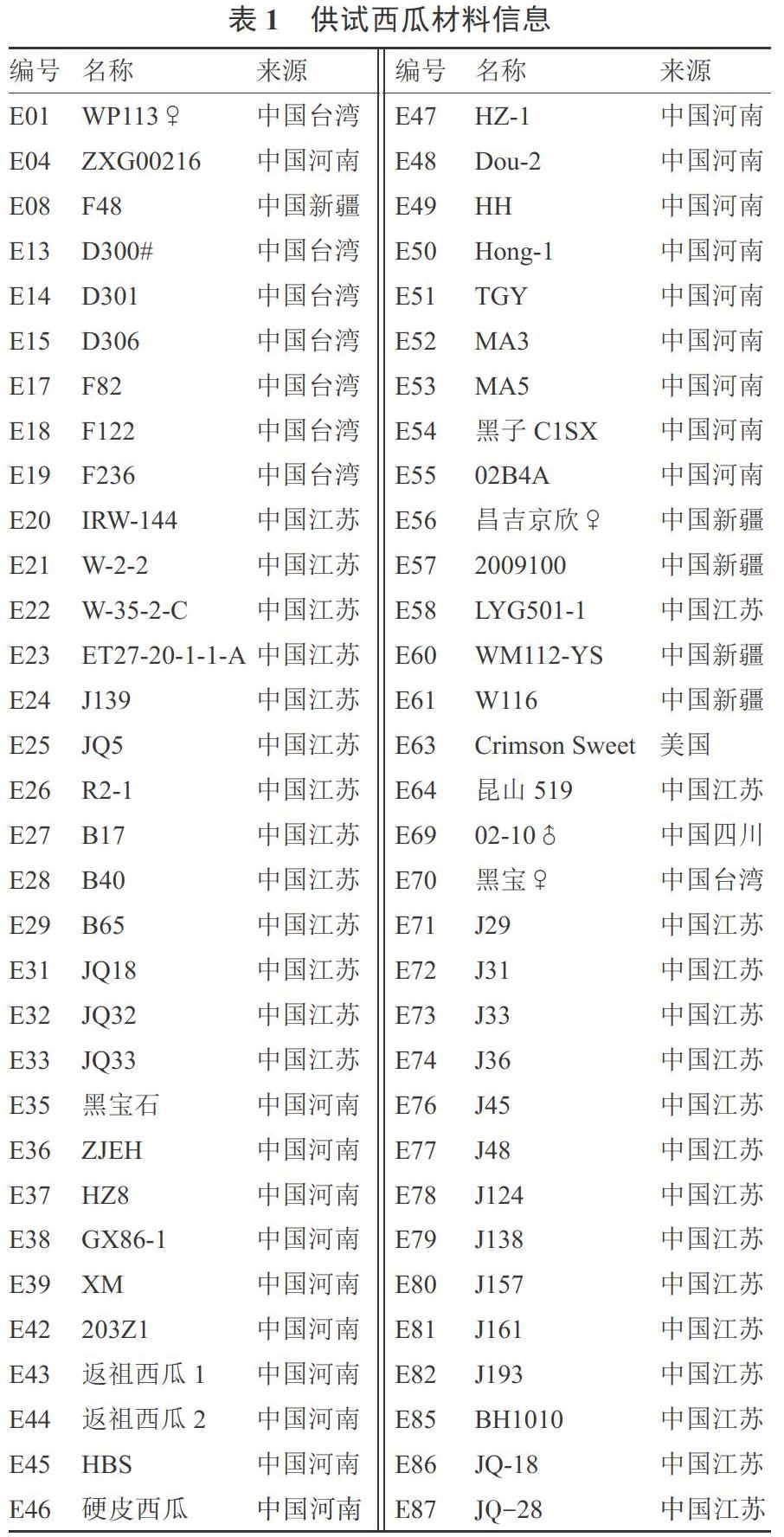
64份西瓜自交系材料為湖北省農業科學院經濟作物研究所收集并保存,材料編號、名稱和來源見表1。
1.2 表型性狀調查
64份自交系材料的表型數據引用戴照義等[16],這些材料于2013 年春季種植在湖北省農科院蔬菜基地,每份材料定植20株,坐瓜方式采用人工輔助授粉。性狀描述、數據采集和記錄參照《西瓜種質資源描述規范和數據標準》[17],每份材料取10株狀態良好、生長一致的植株進行性狀采集。可溶性固形物含量由手持式折光儀測定。
1.3 分子標記和基因型分析
SNP位點信息來源于公開發表的文獻[15]和葫蘆科作物基因組數據庫 (CuGenDB)(ftp://cucurbitgenomics.org/pub/cucurbit/reseq/watermelon/v2/)。選取在西瓜11條染色體上均勻分布的449個SNP位點進行測檢和分析。
2019年11月對64份西瓜資源進行浸種催芽(55 ℃溫湯浸種,32 ℃溫箱催芽),取1~2 cm長胚根,采用CTAB法提取總DNA,該試驗在蔬菜種質創新與遺傳改良湖北省重點實驗室完成。隨后將DNA送至武漢基諾賽克科技有限公司進行后續檢測和分析,主要步驟如下:首先用Qubit 3.0檢測DNA質量和濃度;再通過多重PCR捕獲目標SNP位點;最后利用Illumina 2500平臺進行SNP分型。
1.4 數據分析
使用Cervus 3.0.7 軟件計算多態性信息含量(PIC)。使用POPGENE 1.32 軟件計算Nei's基因多樣性指數(H)、Shannon 信息指數(I)和期望雜合度(He)。使用STRUCTURE 2.3.4軟件[18]對64份材料進行亞群劃分,burnin period 和MCMC iterations 參數分別為 10 000和100 000,亞群數目(K)設置為1~10個,每個K值獨立運算10次,根據ΔK法確定最佳亞群數。根據最大遺傳比例進行亞群歸類。使用PLINK 1.9[19]軟件進行主成分分析(PCA)。利用MEGA 7.0.14 [20]軟件計算材料的遺傳距離,構建基于遺傳距離的UPGMA聚類樹和基于SNP的系統發育樹。系統發育樹采用NJ(Neighbor-Joining)法,Bootstrap值設置為1 000。采用單因素方差分析(one-way ANOVA)和Tukeys多重比較統計性狀差異。
2 結果與分析
2.1 遺傳多樣性
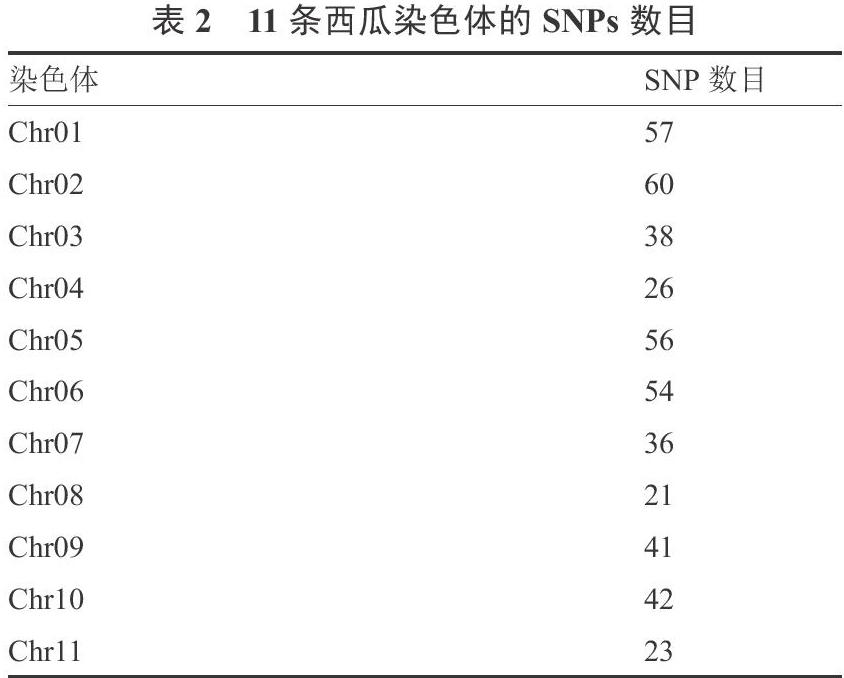
利用高通量SNP分型的方法對64份普通栽培西瓜材料進行檢測,共檢測到449個具有多態性的有效SNP位點,每條染色體的SNP位點見表2。所有位點均包含2個等位基因,位點PIC值在0.015~0.375之間,平均0.229。Neis 基因多樣性指數(H)在 0.016~0.500之間,平均0.28。平均Shannon 信息指數(I)為 0.43。期望雜合度(He)在0.016~0.504之間,平均0.282。
2.2 群體結構分析
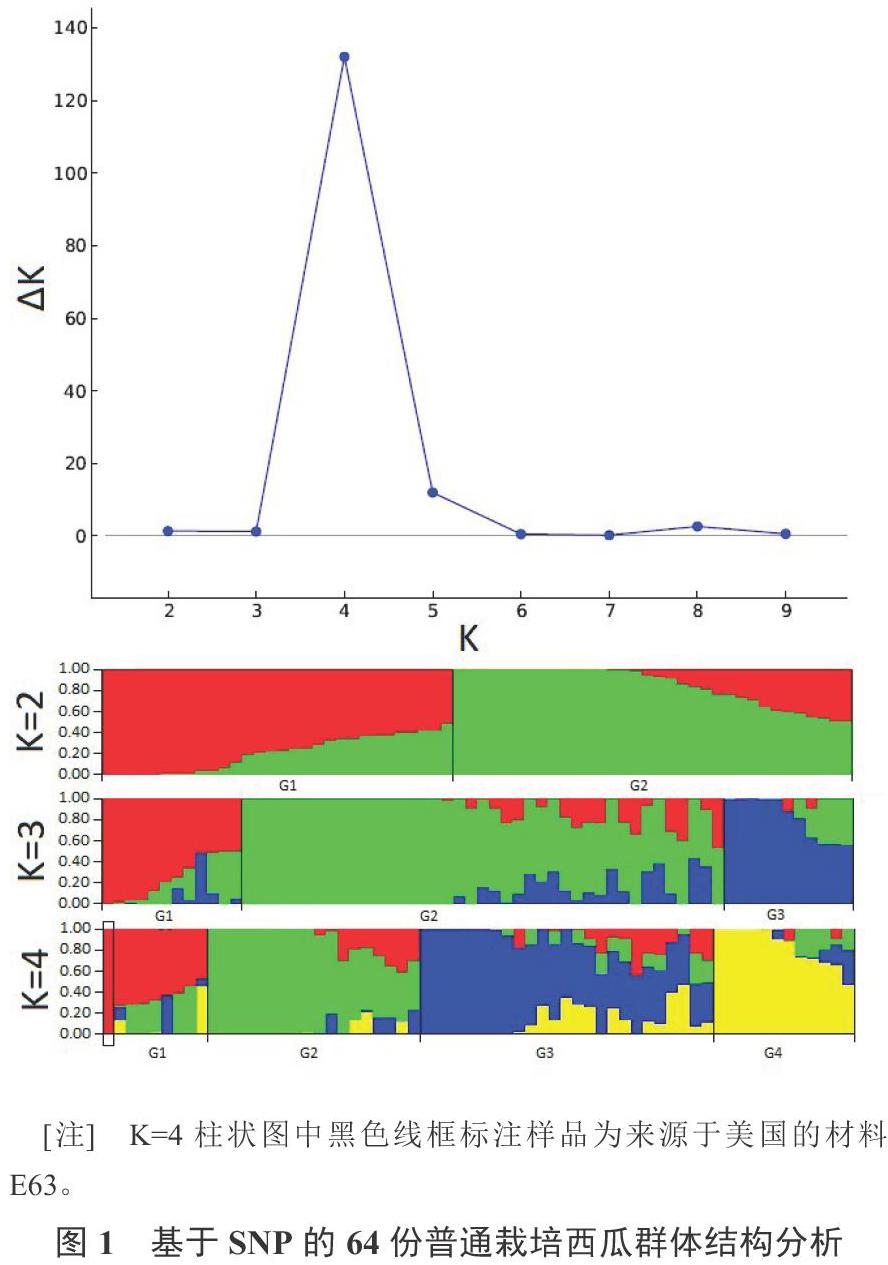
根據449個SNP位點的基因型數據進行群體結構分析,ΔK法確定64份材料的最佳亞群數為4(G1、G2、G3和G4)(圖1),4個亞群分別包含9份、18份、25份和12份材料。來源于美國的材料E63(‘Crimson Sweet)劃分到G1亞群(G1群組比例為0.998)。在所有亞群中,G3亞群材料的遺傳背景最為混雜。64份材料主要來源于江蘇(29份)、河南(20份)、臺灣(8份)和新疆(5份),對亞群和材料的來源地進行獨立性測驗,結果表明,亞群的劃分與材料來源無顯著相關性。
2.3 PCA分析
對64份西瓜材料進行主成分分析,前2個主成分分別解釋16.96% 和13.91%的變異(圖2)。PCA分析與群體結構分析結果的一致性較好,其中G3亞群的材料不能完全區分,部分散落在G1和G4亞群中,但G1、G2和G4亞群之間可以完全區分開。
2.4 聚類分析
64份材料之間的遺傳距離在0.000~0.393之間,平均0.175。材料E33(‘JQ33)和E63(‘Crimson Sweet)遺傳距離最遠,為0.393,分別屬于G4亞群和G1亞群。相互之間遺傳距離為0的材料較多,在G2、G3和G4亞群內部均有相似度極高的材料。根據遺傳距離構建UPGMA聚類樹,64份材料被劃分為7類(圖3-A):其中G2和G4亞群的聚類效果最好,分別聚集在Ⅶ類和Ⅳ類;G1亞群材料可進一步劃分為3類(Ⅰ-Ⅲ);G3亞群大部分材料聚類在一起(Ⅵ類),有少部分分散在其他類中。根據SNP數據構建系統發育樹,64份材料可以劃分為7個大的分枝(圖3-B),其中G2和G4亞群的材料分別聚類在分枝Ⅰ和分枝Ⅶ,G1和G3亞群的少部分材料聚類在一起或混在其他亞群中。基于遺傳距離的UPGMA聚類和基于SNP的系統發育樹一致性較好。
2.5 亞群性狀變異分析
利用單因素方差分析和多重比較檢測不同亞群部分農藝性狀的差異,包括首雌花節位、坐果節位、果皮厚度、中心可溶性固形物含量和種子千粒重。結果表明,4個亞群的中心可溶性固形物含量和種子千粒重沒有顯著性差異,但在首雌花節位、坐果節位和果皮厚度上存在顯著差異(圖4)。G1、G2、G3和G4亞群的平均首雌花節位分別為10.2±1.9節、9.6±1.2節、7.8±1.3節和8.2±0.9節,G3和G4亞群首雌花節位極顯著低于G1和G2。G1、G2、G3和G4亞群的平均坐果節位分別為18.2±5.3節、13.1±2.6節、18.1±3.6節和17.9±1.9節,G2亞群的平均坐果節位極顯著低于其他3個亞群。4個亞群的平均果皮厚度分別為1.01±0.29、1.01±0.17、0.78±0.21和0.72±0.30 cm,G4亞群的平均果皮厚度顯著小于G1和G2亞群,同時G3亞群的平均果皮厚度極顯著小于G2亞群。
3 討論與結論
遺傳多樣性豐富的種質資源是創造優異新品種的基礎。西瓜作為外來引入物種,早期育種可用的資源并不多,導致現有大部分西瓜品種遺傳背景狹窄,差異化程度低。分子標記技術是鑒定和評價西瓜種質資源遺傳多樣性的有效手段,對于挖掘和利用優異西瓜種質、拓寬育種材料遺傳背景和提高育種效率有重要意義。
西瓜基因組序列和重測序數據的公布,極大地促進了西瓜種質分子鑒定和分子輔助育種的進程[14-15]。張海英等[21]利用23對SSR標記對西瓜屬全部7個種的1 197份資源進行遺傳多樣性評估,發現1 197份資源的平均Neis 基因多樣性指數為0.56,Shannon 信息指數平均為 0.99,期望雜合度值平均為0.56。郭祿芹等[22]利用SSR標記對來源于美國、中國 、南非、印度、加納和尼日利亞、土耳其、日本等國家的167份西瓜資源進行研究,表明167份西瓜的平均Shannon 信息指數和平均期望雜合度分別為0.94和0.52。筆者基于SNP標記對63份西瓜國內來源和1份美國來源(表1)的自交系材料進行遺傳多樣性分析,其平均Neis 基因多樣性指數、平均Shannon 信息指數和平均期望雜合度分別為0.28、0.43和0.282。通過比較發現,本研究得出的材料間遺傳多樣性明顯偏低,主要原因是本研究選用的材料幾乎全為國內育成的商業品種,而前人則是利用來源更為廣泛的資源,包括近緣種、野生種、半野生種、國外品種和地方品種等。因此,進一步收集種類豐富的國內外地方品種進行遺傳多樣性評價對西瓜資源的開發利用更有理論指導意義。此外,上述結果表明,國內西瓜品種改良還有很大空間,通過引入國外品種和充分利用來源更為廣泛的地方種、野生種質等創制新的育種材料將有效提高我國西瓜品種的多樣性。
分類學上將栽培西瓜劃分為4個生態型:東亞型、美國型、新疆-俄羅斯型和中國華北型[1]。本研究的群體結構分析表明,64份西瓜的最優亞群數為4(圖1),其中G3亞群有較大部分資源的遺傳背景較為混雜。通過分析各亞群材料的來源地,發現亞群的劃分與地區來源無顯著相關性(p = 0.339),說明國內育種資源交流較為頻繁。本研究中唯一的國外資源E63(‘Crimson sweet,美國)被劃分到G1亞群,其G1亞群比例為0.998,該亞群其他8份資源的G1群組比例在0.731~0.470之間,說明該亞群材料主要為美國生態型血統。由于缺乏明確的其他生態型材料,故而不能確定其他3個亞群材料的血統組成。對64份材料的5個農藝性狀的統計分析發現,不同亞群材料的中心可溶性固形物含量和種子千粒重沒有顯著差異,但首雌花節位、坐果節位和果皮厚度存在顯著性差異。該結果體現了高糖、較小籽粒等與品質相關的性狀是共同的育種目標,但由于各地區的氣候差異,熟性和耐裂性等與適應性相關的性狀有所不同。
綜上所述,本研究利用分布于西瓜全基因組的449個SNP標記對64份栽培西瓜進行遺傳多樣性分析,結果表明,大部分國內資源的遺傳背景相似,且不同地區之間存在相似度極高的材料。因此,在未來的西瓜雜交育種和改良中應在了解和掌握親本材料性狀特征和遺傳背景的基礎上,引入遺傳多樣性更為豐富的野生資源、國外品種和地方品種,適當拓寬親本間的遺傳距離。
參考文獻
[1] 中國農業科學院鄭州果樹研究所,中國園藝學會西甜瓜專業委員會,中國園藝學會西甜瓜協會,等.中國西瓜甜瓜[M].北京:中國農業出版社,2000:20-21.
[2] WU S,WANG X,REDDY U,et al.Genome of ‘Charleston Gray,the principal American watermelon cultivar,and genetic characterization of 1365 accessions in the U.S.National Plant Germplasm System watermelon collection[J].Plant Biotechnology Journal,2019,17(12):2246-2258.
[3] ZHANG H Y,WANG H,GUO S G,et al.Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,Citrullus lanatus (Thunb.)Matsum.& Nakai[J].Euphytica,2012,186(2):329-342.
[4] INGHELANDT D,MELCHINGER A E,LEBRETON C,et al.Population structure and genetic diversity in a commercial maize breeding program assessed with SSR and SNP markers[J].Theoretical and Applied Genetics,2010,120(7):1289-1299.
[5] GAO Q,YUE G D,LI W Q,et al.Recent progress using high-throughput sequencing technologies in plant molecular breeding[J].Journal of Integrative Plant Biology,2012,54(4):215-227.
[6] CHEN H D,XIE W B,HE H,et al.A high-density SNP genotyping array for rice biology and molecular breeding[J].Molecular Plant,2014,7(3):541-553.
[7] 朱玉君,樊葉楊,王惠梅,等.應用分子標記輔助選擇培育兼抗稻瘟病和白葉枯病的水稻恢復系[J].分子植物育種,2014,12(1):17-24.
[8] 王飛名,孔德艷,劉國蘭,等.分子標記輔助選擇改良‘黃華占的褐飛虱抗性與抗旱性[J].上海農業學報,2020,36(3):9-14.
[9] 李怡斐,蔣曉英,張世才,等.加工型辣椒細胞質雄性不育育性基因分子標記及輔助育種[J].分子植物育種,2016,14(4):946-952.
[10] 宋偉,蘇愛國,邢錦豐,等.京724玉米自交系S型細胞質雄性不育系分子標記輔助選育研究[J].玉米科學,2016,24(1):33-36.
[11] GARCIA-MAS J,OLIVER M,GOMEZ-PANIAGUA H,et al.Comparing AFLP,RAPD and RFLP markers for measuring genetic diversity in melon[J].Theoretical and Applied Genetics,2000,101(5/6):860-864.
[12] 劉軍,許美榮,趙志偉,等.絲瓜種質資源遺傳多樣性的SSR與SRAP分析[J].中國瓜菜,2010,23(2):1-4.
[13] NINJUDENWAR N,AWUKU F J,DIERS B,et al.Genetic diversity,population structure and key phenotypic traits driving variation within soybean (Glycine max) collection in Ghana[J].Plant Breeding,2019,138(5):577-587.
[14] GUO S G,ZHANG J G,SUN H H,et al.The draft genome of watermelon (Citrullus lanatus)and resequencing of 20 diverse accessions[J].Nature genetics,2013,45(1):51-58.
[15] GUO S G,ZHAO S J,SUN H H,et al.Resequencing of 414 cultivated and wild watermelon accessions identifies selection for fruit quality traits[J].Nature Genetics,2019,51(11):1616-1623.
[16] 戴照義,王運強,劉志雄,等.西瓜種質資源的遺傳多樣性分析[J].中國瓜菜,2015,28(6):5-9.
[17] 馬雙武,劉君璞,王吉明,等.西瓜種質資源描述規范和數據標準[M].北京:中國農業出版社,2005:9-53.
[18] PRITCHARD J K,STEPHENS M,DONNELLY P.Inference of population structure using multilocus genotype data[J].Genetics,2000,155(2):945-959.
[19] SHAUN P,BENJAMIN N,KATHE T B,et al.PLINK:a tool set for whole-genome association and population-based linkage analyses[J].The American Journal of Human Genetics,2007,81(3):559-575.
[20] KUMAR S,STECHER G,TAMURA K.MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular biology and evolution,2016,33(7):1870-1874.
[21] ZHANG H Y,FAN J G,GUO S G,et al.Genetic diversity,population structure, and formation of a core collection of 1197 Citrullus accessions[J].HortScience,2016,51(1):23-29.
[22] 郭祿芹,趙世豪,朱華玉,等.167份西瓜種質材料的遺傳多樣性分析[J].中國瓜菜,2018,31(1):5-11.

