酸性條件下根皮苷對低酯果膠流變特性、 抗氧化活性及微觀結構的影響
張舒翼,丑述睿,崔惠軍,王撼辰,劉 璇,李 斌,
(1.沈陽農業大學食品學院,遼寧 沈陽 110866;2.農業農村部農產品加工綜合性重點實驗室,中國農業科學院,北京 100193)
多酚與果膠是食品中常見的成分,且都具有良好的生物活性,擁有減肥、降血糖、抗癌、防輻射等 功效[1-3]。果膠是由聚α-(1,4)-D-半乳糖醛酸與甲酯形式的羧基組成,平均分子質量為50 000~150 000 Da的聚合物多糖[4]。果膠根據酯化程度可分為高酯果膠和低酯果膠(low ester pectin,LEP)[5]。高甲氧基果膠是指酯化度大于50%的果膠,而酯化度小于50%的則為LEP。果膠的甲氧基含量高低決定了高酯果膠和LEP的不同性質和不同的凝膠機制[6-7]。而因僅需要少量的可溶性固形物和一定量的多價金屬離子即可形成凝膠的凝膠機制,常被作為膠凝劑應用于生產低糖低熱量健康食品[8]。此外,LEP在醫藥品、化妝品等領域應用范圍也相當廣闊,其作為安全的食品添加劑用于制造健康食品、保健品的前景廣闊,消費者訴求廣泛,在市場上供不應求,所占市場份額逐年增長。果膠有較多功能特性,研究表明,LEP作為一種健康安全的可溶性膳食纖維可以預防多種疾病,如糖尿病和結腸癌[9]。用不同方法改性后的LEP還被證明具有抗癌、降低膽固醇、減少體內重金屬離子含量等作用,還可在生物體內作細胞載體、藥物載體,具備一定的抗凝血功效[10]。
多酚是水果、蔬菜中常見且含量豐富的生物活性物質,其作為抗氧化劑在食品、醫藥品中的應用也越來越普遍。根皮苷是根皮素的葡萄糖苷,化學式為C12H24O10?2H2O,屬于二氫查爾酮類物質,是蘋果多酚的重要特征組分,主要分布在蘋果屬植物中,而在其他屬中只有少量[11]。研究表明根皮苷及其衍生物具有降血糖、降脂減肥、抗炎、抗氧化、改善肝纖維化、提高膜通透性等作用[12-15]。因此被廣泛應用于食品、飲料、食品添加劑、醫藥和化妝品中。近年來關于多酚-果膠間相互作用及多酚-果膠復合物的功能特性的研究越來越受到關注。研究表明結構上不同的多酚可以與果膠大分子結合,果膠可借助與酚酸及其他可能的多酚化合物的共價連接交聯構建空間三維結構[16]。梁迪等[17]研究表明,加入蘋果多酚后,多酚-果膠復合膜液的抗氧化性增強,表觀黏度增加,機械強度增強。Xu Juan等[18]研究表明,制備多種尺寸的果膠/多酚珠可用于水下軟物質的無污染熒光跟蹤;Soohwan等[19]研究表明使用Ca2+進行多酚綴合果膠后,綴合物相比純果膠水凝膠有更高的剪切模量和抗氧化性質。通過自由基清除實驗可證實多酚在與果膠偶聯后仍具有抗氧化活性[20]。因此多酚-果膠復合物在生物醫學、化妝品、食品和制藥工業等各領域具有新的應用潛力。而LEP作為結構復雜的大分子質量多糖化合物,其凝膠特性及流變學特性決定了其實際應用 方式[21-22]。為了探究蘋果多酚的重要特征組分根皮苷對LEP凝膠、流變性的影響,考察與根皮苷復合后LEP-根皮苷復合物的抗氧化活性以及微觀結構的變化,為 LEP-多酚類化合物復配體系的開發及其在食品、藥品領域的應用提供理論參考依據。本實驗以LEP和根皮苷的復合物為原料,研究不同根皮苷添加量條件下根皮苷-LEP復合凝膠的流變性、質構特性、抗氧化性及微觀結構的變化,從而確定該復合凝膠在生產過程中的最適添加量,為根皮苷-LEP體系的應用提供理論參考依據。
1 材料與方法
1.1 材料與試劑
低酯蘋果果膠(酯化度20%) 上海天宸生物科技有限公司;根皮苷(純度98%) 成都康輝生物科技有限公司;ABAP(純度97%)、DCFH-DA 上海麥克林生物科技有限公司。其余試劑均為國產分析純。
1.2 儀器與設備
AX124ZH/E電子天平 奧豪斯(常州)有限公司;NB-HJ-6A多頭磁力攪拌器 鄭州南北儀器設備有限 公司;Infinite M200PRO酶標儀 美國Thermo公司;S4800掃描電子顯微鏡 日本日立公司;Brookfield CT-3質構儀 中科美儀(北京)科技有限公司;DHR-1流 變儀 美國TA公司。
1.3 方法
1.3.1 樣品制備
使用無水乙醇溶解根皮苷,加入pH值為4.2的檸檬酸-檸檬酸鈉緩沖溶液,加熱至60 ℃,在1 000 r/min磁力攪拌條件下緩慢加入LEP-蔗糖混合粉末,65 ℃磁力攪拌1.5 h,使LEP完全溶解。緩慢滴入氯化鈣,70 ℃繼續磁力攪拌30 min。最終配制成100 mL體積分數15%乙醇溶液,LEP質量分數為1%,蔗糖質量為15 g,氯化鈣含量為45 mg/g,根皮苷添加量分別為0%、0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%的根皮苷-LEP復合凝膠體系,在4 ℃冰箱中靜置24 h,待測。
1.3.2 質構性測定
使用質構儀對根皮苷-LEP復合凝膠體系進行分析[23]。采用TPA測試模式,使用P/0.5探頭,測前速率1.00 mm/s;測試速率1.00 mm/s;返回速率1.00 mm/s,觸發力35 g;壓縮變形程度為40%。每組樣品測試3 次,結果取平均值。
1.3.3 流變性測定
參考相關文獻[24-25],采用平板-平板測量系統,平行板直徑40 mm,設置間隙1 mm,使用稱量勺挖取適量樣品于平行板上,待平行板下壓后,刮去多余樣品,使用甲基硅油密封防止水分蒸發。
靜態剪切流變測定:在25 ℃條件下,設置剪切速率從0~300 s-1上升,再從300~0 s-1下降,測定過程中剪切應力和黏度的變化情況。采用Power-Law模型對所得數據點進行擬合,用R2表示方程擬合精度。Power-Law方程如式(1)所示:

式中:σ為剪切應力/Pa;K為稠度系數/(Pag sn);γ為剪切速率/s-1;n為流體指數。
動態黏彈性測定:在25 ℃條件下,設置掃描應變值為1%,振蕩頻率設定為0~10 Hz,測定不同樣品損耗角正切tanδ的變化情況。
在25 ℃條件下,設置掃描應變值為1%,振蕩角頻率設定為0~100 rad/s,測定儲能模量(G’)、損耗模量(G”)的變化情況。
動態時間掃描測定:設置溫度為25 ℃,固定振蕩頻率1 rad/s,掃描應變1%,觀察不同樣品的G′、tanδ在3 600 s內的變化。
動態溫度掃描測定: 設置溫度掃描范圍25~80 ℃,以2 ℃/min的速率從80 ℃開始降溫,固定振蕩頻率1 Hz,保留時間300 s,觀察不同樣品的G′與tanδ隨溫度的變化情況。
1.3.4 過氧化氫自由基清除能力(hydrogen peroxide radical scavenging capacity,HPSC)分析
取893 μL 1.0 mmol/L KOH溶液于10 mL試管,再加107 μL 2.48 mmol/L DCFH-DA,混勻,避光反應5 min(可以用錫箔紙包裹),然后加7 mL磷酸緩沖溶液(pH 7.4),獲得DCFH溶液,待用。稱取0.275 g ABAP,溶解在5 mL的緩沖溶液中,現用現配制成200 mmol/L的ABAP溶液,在4 ℃條件下,可保存4~6 h。用磷酸緩沖液將樣品稀釋成300 倍的樣液,加入60 μL樣液到96 孔板上,再加入60 μL DCFH。將96 孔板放入到熒光酶標儀中進行測定,每孔加入40 μL 200 mmol/L的ABAP。反應在40 min內達到最大熒光性。采用Ascent軟件處理數據。計算平均熒光面積(對于提取液和標準品的反應時間動力學曲線AUC)并且計算抗氧化能力。根據式(2)計算抗氧化能力[26]:

式中:SA為樣品和標準品的熒光積累量;CA為空白對照的熒光積累量。
由劑量-反應曲線計算出樣品的EC50值(每個樣品引起50%抑制(HPSC=0.5)所需要的劑量)。 用μmol/mL表示樣品抗氧化能力,以VC計,每個樣品至少平行測定3 次。
1.3.5 微觀結構的觀察
將制好樣品平鋪于培養皿中,放入超低溫冰箱中冷凍,再轉移至-50 ℃真空冷凍干燥機內,冷凍干燥72 h。將干燥后的樣品固定在雙面導電的樣品臺上,使用離子濺射儀使樣品具有導電性。在3 000放大倍率下,使用掃描電子顯微鏡觀察樣品微觀結構,選擇具有代表性的視野記錄拍照[27]。
1.4 數據處理
所得數據使用Origin 8.0和Microsoft Excel軟件繪制相關圖表。每次測試前需更換樣品,且每組實驗均重復3 次。
2 結果與分析
2.1 根皮苷對LEP質構特性的影響
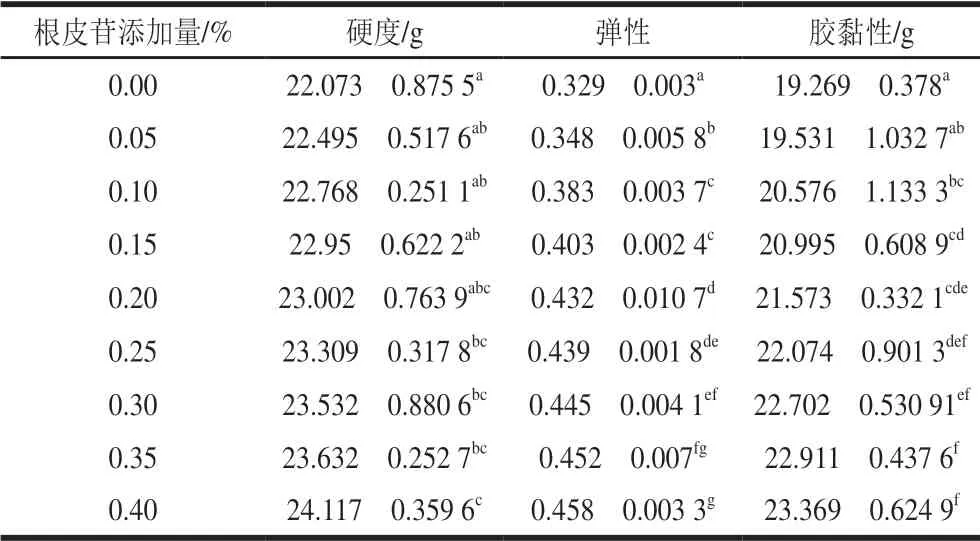
表 1 根皮苷添加量對根皮苷-LEP復合體系的硬度、彈性和膠黏性的影響Table 1 Hardness, elasticity and gumminess of phlorizin-LEP mixed systems with different concentrations of phlorizin
如表1所示,隨著根皮苷添加量從0.05%增加至0.40%,體系硬度、彈性和膠黏性呈上升趨勢。這說明根皮苷添加量從0.00%增加到0.40%的過程中,始終可以增強LEP的凝膠強度。
2.2 根皮苷對LEP流變特性的影響
2.2.1 靜態剪切流變特性
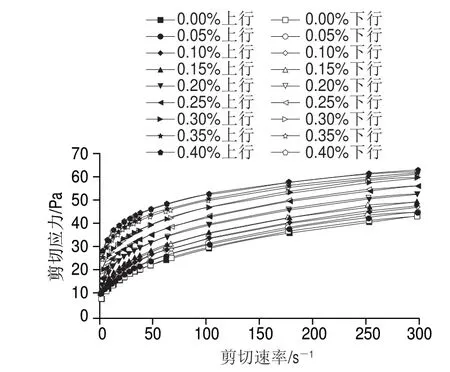
圖 1 根皮苷-LEP復合體系剪切應力隨剪切速率變化曲線Fig. 1 Shear stress versus shear rate curves of phloretin-LEP mixed systems
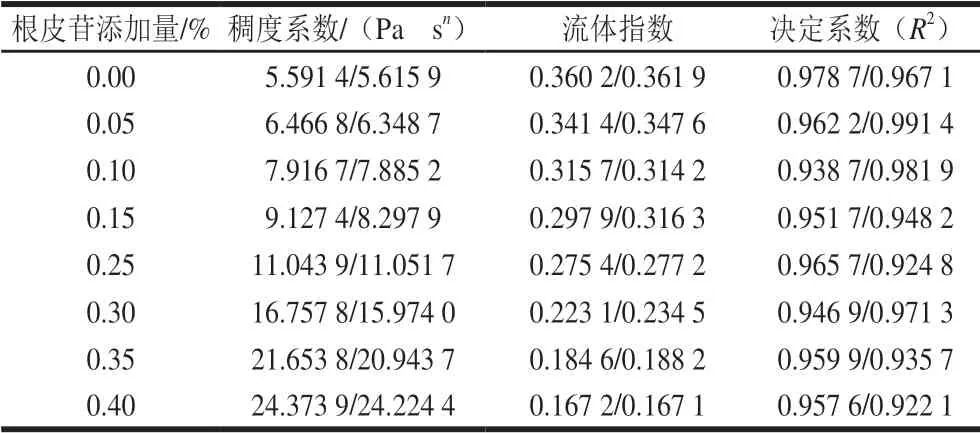
表 2 根皮苷-LEP復合體系Power-Law方程擬合參數Table 2 Power-Law parameters for phloretin-LEP mixed systems
由圖1可知,隨著剪切速率的增大,復合體系的剪切應力隨之增大。根皮苷添加量越高,復合體系剪切應力越大。在升速和降速的過程中,曲線走勢較為重合,這表明該體系具有良好的觸變性能[28]。在根皮苷添加量從0.00%增加到0.40%過程中,體系的剪切應力隨之逐漸增大,當根皮苷的添加量從0.00%增加到0.10%時,體系的剪切應力小幅增加,繼續添加根皮苷至0.30%,剪切應力增幅變大,根皮苷添加量從0.30%繼續增加到0.40%時,體系的剪切應力增幅逐步減緩。體系隨著剪切速率的增加黏稠度逐漸降低,表現出典型的剪切變稀的非牛頓流體的特性。與不添加根皮苷的對照組相比,添加根皮苷的LEP凝膠體系的黏度增加。這可能是因為,一部分的LEP在溶液中呈現出鏈狀結構,與Ca2+相互纏結,形成“蛋盒”模式結合區[29],而另一部分帶負電荷的LEP與根皮苷通過靜電作用結合,LEP中部分甲基與根皮苷的吡喃雜環(C環)之間發生了一定的疏水相互作用,同時在根皮苷的羥基與LEP的毛狀區域之間產生了大量的氫鍵,使得分子間作用力逐漸增強,分子鏈間以及分子間的相互纏結也加劇[30]。根皮苷的加入可能導致了更多的果膠大分子鏈內與鏈間相互纏結增多,產生了根皮苷-LEP復合凝膠體系,使得由分子間相對運動引起的體系流動阻力增大,令體系剪切難度增大從而使體系黏度增加[31]。
根據Power-Law模型對數據點進行擬合,由表2可知,決定系數R2均在大于0.92,這表明模型具有較高的擬合精度。曲線流體指數小于1,表示在剪切速率的變化范圍(0~300 s-1)內,體系屬典型的假塑性流體。添加根皮苷后,復合凝膠體系的稠度系數升高,隨著根皮苷添加量的提高,體系表觀黏度也增大,流體指數減小。流體指數代表流體假塑性程度,說明隨著根皮苷添加量的提升,體系表現出更強的假塑性,剪切變稀現象 增強[32]。這可能是因為根皮苷和LEP與水之間發生了大量的氫鍵聯結,形成了致密穩定的三維空間結構,使得體系的黏度升高。
2.2.2 動態黏彈流變特性
通過動態流變學的特性研究根皮苷-LEP復合凝膠體系的動態黏彈性,利用動態黏彈性借以表征果膠與根皮苷之間的三維網絡結構[33]。G’為樣品彈性的反映指標,G”為樣品黏性的反映指標[34]。由圖2A可知,體系的G’和G”均隨角頻率的增加而增加,并且G’均大于G”,說明體系主要表現為彈性[35],膠體行為較為突出[36]。同時也能發現隨著根皮苷添加量增加,體系的G’和G”均有提高,說明體系的彈性逐漸增強。這可能是由于大量根皮苷加入之后,與LEP和水之間存在氫鍵作用力,加強了果膠的凝膠結構,形成了空間位阻[37],由于網狀結構的形成,復合體系彈性性能增強。高分子化合物中,分子內部的摩擦力會導致鏈狀分子運動滯后,與交變應力的運動產生不一致的現象,因此會產生應力與應變的相位差角損耗角δ,tanδ即為G”與G’的比值[38]。如圖2B所示,體系tanδ隨著頻率增大而下降,說明頻率越大,LEP的鏈間運動越易發生,tanδ值均在0.1~1之間,表明樣品主要顯現出彈性,這是典型的弱凝膠體系特征[39],當添加量從0.10%增加到0.30%時,彈性增強現象更加突出。可能是由于這期間根皮苷與果膠間相互作用大范圍發生。而添加量從0.30%變化到0.40%時,這種增強趨勢減弱,說明根皮苷與果膠的作用位點逐步飽和,其增強果膠凝膠性能作用不再明顯。
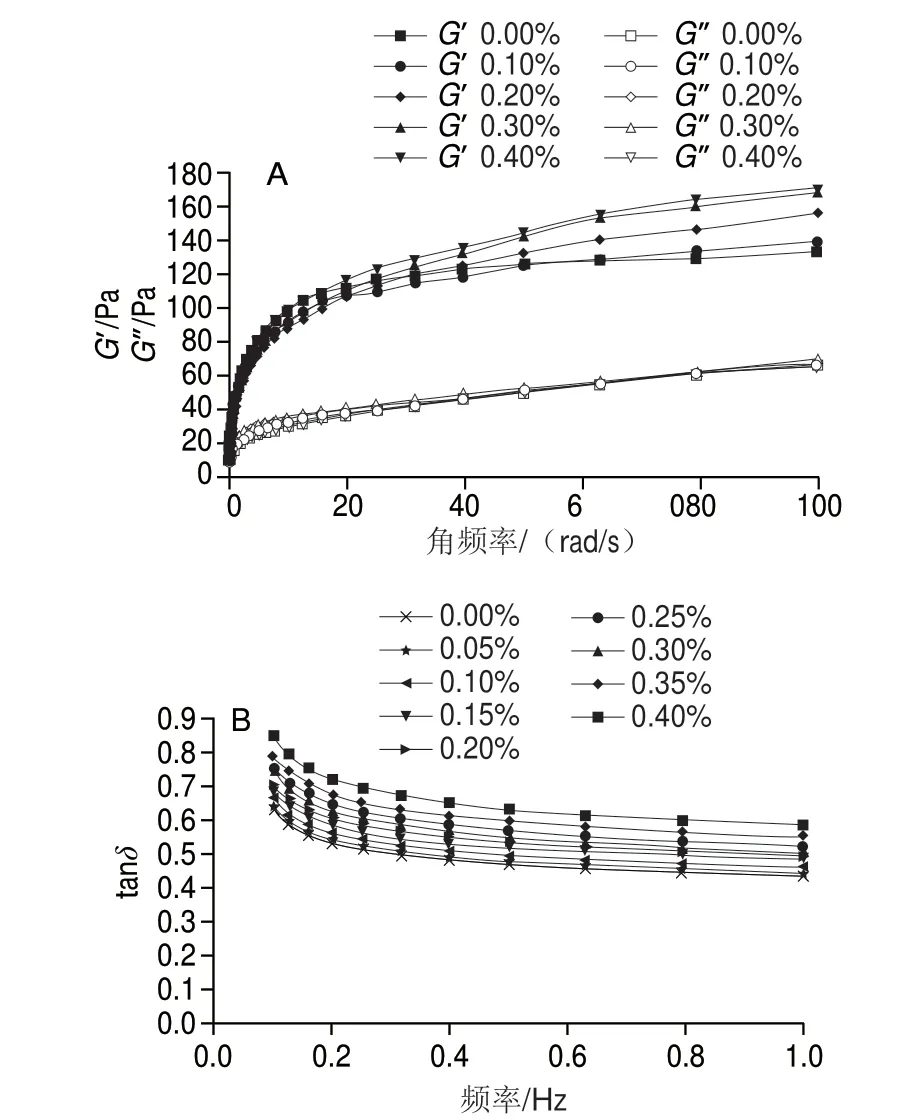
圖 2 根皮苷-LEP復合體系動態模量(A)和tanδ(B)隨頻率變化曲線Fig. 2 Curves of dynamic modulus (A) and tanδ (B) of phloretin-LEP mixed systems as a function of frequency
2.2.3 動態溫度掃描
由圖3可知,隨著溫度的升高,G’不斷減小,體系的彈性降低,可能是由于溫度升高導致了果膠內部凝膠結構的巨大變化[40]。高溫下,體系分子運動劇烈,果膠分子鏈間相互纏繞被打亂,導致凝膠強度降低,彈性性能變小,低溫下具有較高G’,說明低溫時分子內部結構較為有序,凝膠強度較強。添加根皮苷的果膠凝膠與單一的果膠凝膠體系相比有著相對較高的G’,在根皮苷添加量為0.1%~0.3%時增加顯著,而添加量大于0.3%后,體系的G’增加趨勢變緩。適量的根皮苷能夠使果膠凝膠分子間交聯作用加強,這可能是因為根皮苷分子中存在較多羥基,增加凝膠分子間氫鍵的形成,使凝膠結構致密,不易被高溫破壞。
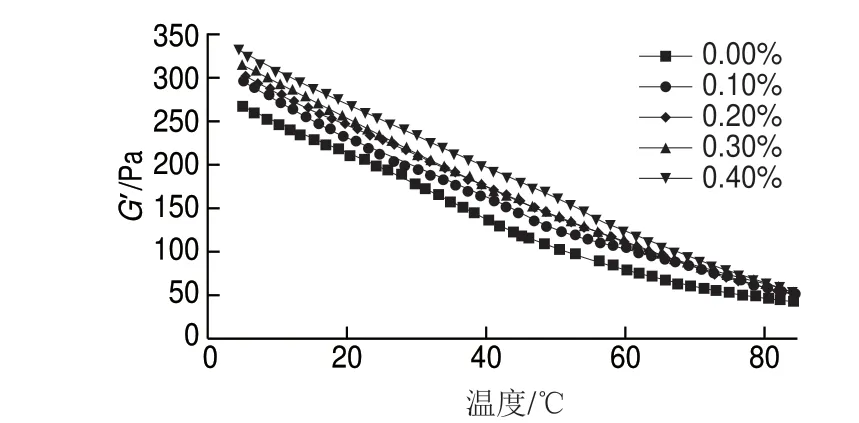
圖 3 根皮苷-LEP復合體系G’隨溫度變化曲線Fig. 3 Curves of storage modulus of phloretin-LEP mixed systems as a function of temperature
2.2.4 動態時間掃描
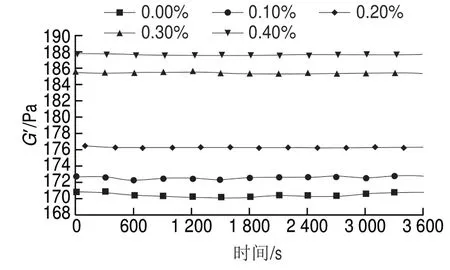
圖 4 根皮苷-LEP復合體系G’隨時間變化曲線Fig. 4 Time-dependent curves of storage modulus of phloretin-LEP mixed systems
由圖4可知,隨著根皮苷添加量的增大,體系的G’增大。這可能是由于根皮苷分子中的羥基與LEP毛狀區域間存在氫鍵導致分子間交聯作用加強,使凝膠結構致密,當根皮苷添加量從0.20%增加至0.30%時這一現象更為顯著,這與動態黏彈體現出的性質相一致。
2.3 根皮苷對LEP-HPSC的影響
如圖5所示,空白對照為不添加根皮苷與蔗糖的果膠溶液,陽性對照為僅添加蔗糖制備的果膠溶液,空白對照的HPSC為1.486 1 μmol/mL,添加蔗糖制備的陽性對照則為1.517 0 μmol/mL,說明15%的蔗糖添加量對復合體系產生了少量的抗氧化性影響,但并不顯著。對比相同根皮苷與蔗糖添加量的根皮苷溶液和根皮苷-LEP復合體系的抗氧化性,可以發現,在與LEP復合之后,復合體系的抗氧化性略優于單獨根皮苷-蔗糖或者單獨果膠-蔗糖體系,說明兩者的復合可能發生了一定的協同抗氧化作用。從整體看,隨著根皮苷添加量的增加,無論是根皮苷溶液還是根皮苷-LEP復合體系的HPSC均呈現上升趨勢,可能是由于根皮苷添加量受其溶解度限制而添加較少,稀釋倍數較大,使得上升幅度較小,但是上升趨勢較為明顯,說明該實驗結果可信。這可能是由于根皮苷與LEP復合后,促使果膠形成了更為穩定的結構,從而對根皮苷產生了保護作用,因而提升了彼此的抗氧化能力。
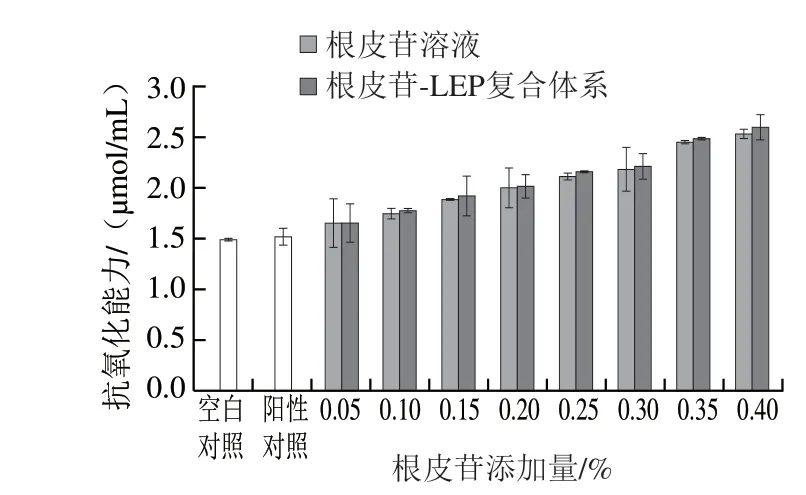
圖 5 不同根皮苷添加量樣品的HPSCFig. 5 HPSC of phloretin-LEP mixed systems
2.4 根皮苷對低酯蘋果果膠微觀結構的影響
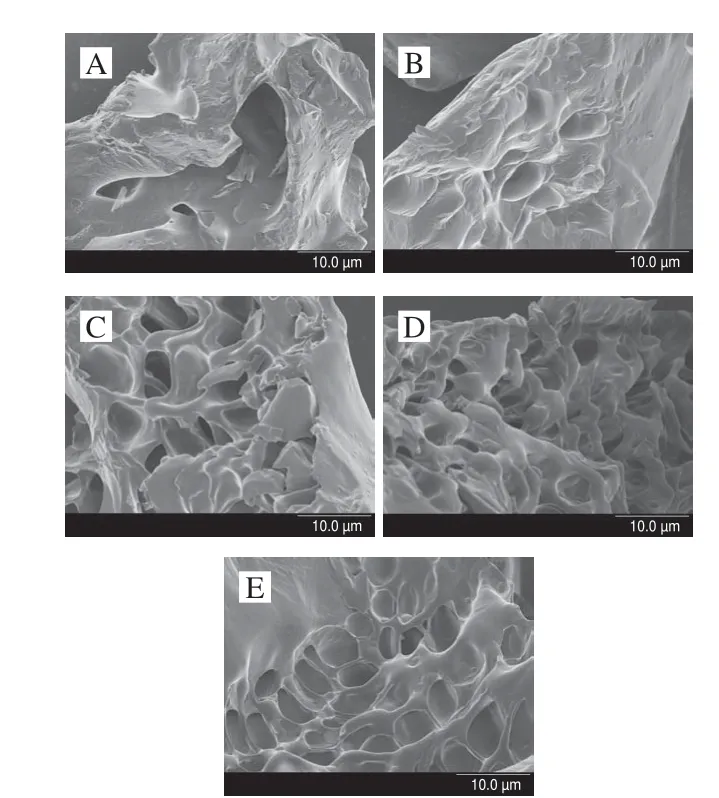
圖 6 根皮苷-LEP復合體系掃描電子顯微鏡圖(×3 000)Fig. 6 SEM photomicrographs of phloretin-LEP mixed systems (× 3 000)
如圖6A所示,當不添加根皮苷時凝膠表面粗糙,而與根皮苷結合的果膠表面變得光滑,這說明添加的根皮苷對果膠多糖鏈結構產生了影響[41]。圖6B~E可以看出,根皮苷的加入對復合體系微觀結構的影響較為明顯,隨著根皮苷添加量的增大,凝膠結構中孔隙增多,結構變得更加致密,連續性增強。由圖6B可看出,添加0.10%的根皮苷后,復合體系內部產生了較為明顯的孔狀結構,但其余部分的平滑區域仍舊較多;當根皮苷添加量為0.20%時,大部分的平滑區域內已經產生較為明顯的空隙,已有出現蜂窩狀結構的趨勢(圖6C)。由圖6D、E可以看出,當根皮苷添加量為0.30%時已經出現了規整致密的蜂窩網狀結構,當根皮苷添加量達到40%時,這種結構更加均勻,空隙更加勻稱,形狀更加規整。其對應了流變學測定的結果。當根皮苷添加量從0.10%上升到0.30%時,根皮苷與LEP之間通過氫鍵相互作用開始形成網狀三維結構,當添加量達到0.30%時該結構已經基本形成,繼續添加對其影響減小。隨著添加量的增大可以發現體系中平滑的LEP結構有所減少,呈現更加明顯的蜂窩結構,體系中孔洞開始變得規則而致密的,鏈狀果膠之間形成的架構的連續性增強,體系在宏觀上表現出彈性增大,凝膠結構更加穩定,與流變學測定的結果相吻合,并從一定程度上可以解釋根皮苷與LEP復合后抗氧化能力協同增強的現象。
3 結 論
采用質構和流變學方法分析了根皮苷對LEP凝膠性能的影響。結果表明,添加根莖苷對果膠凝膠的G’、G”和tanδ值均都有影響,隨著根皮苷添加量的增加,根皮苷-LEP復合凝膠體系的硬度、膠黏性、彈性均增加,凝膠強度增強。在整個添加范圍內,隨著根皮苷添加量的增加,形成了復合凝膠體系。G’、G”和tanδ值均隨之增大,表現出更強的凝膠強度,表明根皮苷的添加有利于果膠的形成。
考察不同添加量的根皮苷對根皮苷-LEP復合體系抗氧化能力的影響,發現根皮苷與LEP復合后,兩者之間產生了協同抗氧化作用,并且根皮苷添加量越多,復合體系抗氧化能力越強。
采用掃描電子顯微鏡觀察凝膠的微觀形貌。結果表明,隨著根皮苷添加量的增加,果膠凝膠產生了更多的網狀結構,且當根皮苷添加量在0.30%以上,該結構表現得更加均勻致密。說明根皮苷的加入使得果膠形成了穩定的三維網狀結構。
本研究實驗結果說明,酸性條件下制備低酯蘋果果膠,適量添加根皮苷,可促進低酯鈣果膠凝膠的形成,增強其凝膠強度,復合體系具有更加穩定的結構。根皮苷可提高LEP的抗氧化性,為根皮苷-LEP體系的應用提供理論依據。有必要進一步研究根皮苷-LEP在不同產品中的作用,拓寬根皮苷-LEP復合凝膠體系在功能性食品行業中的應用。

