老年急性缺血性腦卒中后抑郁患者睡眠障礙現狀及與血清IL-1、IL-2、5-HT和Hypocretin的相關性
祝善堯 葛偉 張歡 陳貴海
(安徽醫科大學附屬巢湖醫院 1神經內科,安徽 合肥 238000;2睡眠障礙科)
腦卒中后抑郁(PSD)是腦卒中后常見并發癥,對腦卒中后神經功能恢復、康復和生活質量有顯著負面影響,約1/3腦卒中患者可發生PSD〔1〕,睡眠障礙是PSD患者最常見、嚴重影響患者生活質量的并發癥之一。PSD睡眠障礙發病機制尚無定論,目前研究認為代謝障礙、炎性反應、神經遞質功能失調等是PSD睡眠障礙的可能因素〔2〕。白細胞介素(IL)-1、IL-2等細胞因子可調節機體炎性反應和免疫狀態,對神經遞質分泌合成、生理代謝等可產生明顯影響,在非器質性抑郁癥、缺血性腦疾病等發病機制中有重要地位〔3〕。5-羥色胺(HT)、下丘腦外側區分泌素(Hypocretin)是大腦重要神經遞質,5-HT在抗抑郁、睡眠調節中均有重要作用,Hypocretin可調控清醒和快速眼球運動(REM)睡眠〔4〕。目前少有IL-1、IL-2、5-HT和Hypocretin與PSD睡眠障礙的相關性研究,IL-1、IL-2、5-HT和Hypocretin在PSD睡眠障礙發生、發展中機制尚不清楚,本研究在分析PSD患者睡眠障礙現狀的基礎上,探討IL-1、IL-2、5-HT、Hypocretin與PSD睡眠障礙的關聯性。
1 資料與方法
1.1一般資料 納入標準:①經顱腦CT或磁共振成像(MRI)證實一側腦組織受損,首次診斷腦卒中,符合2014年中國急性缺血性腦卒中診斷標準〔5〕;②符合《中國精神障礙分類與診斷標準》中抑郁診斷標準〔6〕,漢密爾頓抑郁量表(HAMD)評分≥7分;③年齡≥60周歲;④發病時間<1年;⑤認知功能正常、無交流障礙,能完成量表測評;⑥患者及其家屬知情同意并簽署同意書。排除標準:①發病前既已存在抑郁癥和睡眠疾病;②合并腫瘤、感染、心肺腎等器官衰竭患者;③嚴重精神性疾病患者;④認知障礙、失語、視覺障礙、無法配合完成量表評估患者;⑤研究期間服用抗抑郁藥物患者;⑥抵觸本研究者。選擇2016年7月至2018年12月安徽醫科大學附屬巢湖醫院住院部收治的腦卒中患者共152例,根據是否發生PSD將患者分為PSD組和非(N)PSD組,另選擇60例門診體檢老年人為健康對照組,均排除急性缺血性/出血性腦卒中和抑郁的可能。本研究獲得醫院倫理會批準,嚴格遵循倫理學原則,患者均知情并自愿加入本研究,簽署知情同意書,診療過程中保證患者隱私和安全。
1.2臨床資料收集 登記患者個人資料如:性別、年齡、基礎疾病(高血壓、糖尿病、冠心病、打鼾史、吸煙、飲酒等),測量身高、體重,計算體重指數(BMI),測量頸圍。記錄患者美國國立研究院腦卒中評定量表(NIHSS)評分、改良RANKIN量表(MRS)評分、HAMD評分、改良Barthel指數(MBI)評分。
1.3研究方法
1.3.1抑郁程度評估 由專業評定人員應用HAMD量表對PSD患者進行抑郁程度評價,共17項,得分0~54分,分數越高表示抑郁程度越重,其中HAMD 評分<7分為正常,7~17分為輕度抑郁,18~24為中度抑郁,>24分為重度抑郁〔7〕。
1.3.2多導睡眠(PSG)監測 監測前1 d禁用鎮靜藥物、含酒精、咖啡、濃茶等飲料,監測當天不午休,使用美國德邦PSG監測儀進行夜間7 h以上睡眠監測,記錄口鼻氣流、眼動圖、腦電圖、肌電圖、心電圖、鼾聲指數、血氧飽和度、胸腹動、睡眠結構、睡眠呼吸功能等。經電腦自動分析后統計相關數據,專業睡眠呼吸醫師人工分析修正后記錄睡眠全程,分為睡眠潛伏期、REM潛伏期、REM-1、REM-2、REM-3期、REM期,計算睡眠效率(REM-1、REM-2、REM-3期、REM期占總睡眠時長的百分比)。
1.3.3匹茲堡睡眠質量指數(PSQI)量表〔8〕該量表從睡眠質量(1分較好,2分較差,3分很差)、入睡時間(0分≤15 min,1分16~30 min,2分31~60 min)、睡眠時間(0分≥7 h,1分>6 h且<7 h;2分>5 h且≤6 h,3分≤5 h)、睡眠效率(睡眠效率=睡眠時間/床上時間×100.00%,0分睡眠效率≥85.00%,1分睡眠效率75.00%~84.00%,2分睡眠效率66.00%~74.00%,3分睡眠效率≤65.00%)、睡眠障礙(0分無,1分1次/w,2分2次/w,3分1 w≥3次)、催眠藥物(0分無,1分1次/w,2分2次/w,3分1 w≥3次)、日間功能障礙(0分無,1分偶爾,2分有時,3分經常)評定患者睡眠質量,分數0~21分,分數越高代表睡眠質量越差。PSQI量表重測信度0.994,7個維度的Cronbach α系數為0.832〔9〕。根據文獻〔10〕標準將PSQI≥7分定義為睡眠障礙,PSQI 7~14分為輕度睡眠障礙、PSQI>14分為嚴重睡眠障礙。
1.3.4臨床樣本采集與檢測方法 患者于入院后次日清晨空腹抽取靜脈血(對照組于體檢當日上午采血)5~10 ml,分別注入枸櫞酸鈉抗凝真空采血管。經離心分離血清后置于-70℃ DW-86L386型超低溫冰箱(青島海爾醫用低溫科技有限公司)保存,24~48 h上機測定。Elx800酶標儀(美國BioTek公司)采用酶聯免疫吸附試驗檢測IL-1、IL-2、5-HT、Hypocretin水平,試劑盒購自深圳邁瑞生物醫療公司。室內質控數據均在控,實驗檢測嚴格按照檢驗科標準作業程序(SOP)文件進行。
1.4統計學分析 采用SPSS25.0軟件進行單因素方差分析、LSD-t檢驗、獨立樣本t檢驗、Kruskal WallisH檢驗、Logistic多重線性回歸分析。
2 結 果
2.1基線資料比較 152例腦卒中患者中PSD組69例,NPSD組83例,3組性別、年齡、BMI、合并糖尿病、高脂血癥、冠心病、打鼾史,飲酒史均無統計學差異(P>0.05),PSD組和NPSD組頸圍、合并高血壓、吸煙史、睡眠障礙發生率與對照組比較差異均有統計學意義(P<0.05)。PSD組睡眠障礙發生率、NIHSS評分、MRS評分、HAMD評分顯著高于NPSD組(P<0.05),MBI評分顯著低于對照組(P<0.05),見表1。
2.2PSQI評估結果 PSD組睡眠質量、入睡時間、睡眠時間、睡眠效率、睡眠障礙、催眠藥物、日間功能障礙評分均顯著高于NPSD組和對照組(P<0.05),NPSD組顯著高于對照組(P<0.05)。PSD組不同抑郁程度患者睡眠質量、入睡時間、睡眠時間、睡眠效率、睡眠障礙、催眠藥物、日間功能障礙評分差異顯著(P<0.05),重度抑郁組最高,其次是中度抑郁組和輕度抑郁組,各組間差異具有統計學意義(P<0.05),見表2。
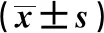
表1 3組基線資料比較
與對照組比較:1)P<0.05;與PSD組比較:2)P<0.05

表2 各組PSQI評分比較分)
與對照組比較:1)P<0.05;與NPSD組比較:2)P<0.05;與輕度抑郁組比較:3)P<0.05;與中度抑郁組比較:4)P<0.05;表3同
2.3PSG檢測結果 PSD組總睡眠時長顯著短于NPSD組和對照組(P<0.05),睡眠潛伏期、REM潛伏期、REM-1期睡眠效率顯著長于NPSD組和對照組(P<0.05),REM-2期、REM-3期、REM期睡眠效率顯著短于NPSD組和對照組(P<0.05),NPSD組睡眠潛伏期、REM-1期睡眠效率顯著高于對照組(P<0.05),REM-2期、REM-3期、REM期睡眠效率顯著低于對照組(P<0.05),總睡眠時長、REM潛伏期與對照組無統計學差異(P>0.05)。PSD組不同抑郁程度患者睡眠潛伏期、REM潛伏期、睡眠效率差異顯著(P<0.05),重度抑郁組總睡眠時長顯著短于輕度抑郁組(P<0.05),與中度抑郁組之間無統計學差異(P>0.05);重度抑郁組睡眠潛伏期、REM潛伏期、REM-1期占睡眠效率最長,其次是中度抑郁組和輕度抑郁組,各組間差異具有統計學意義(P<0.05);重度抑郁組REM-2期、REM-3期、REM期睡眠效率最短,其次是中度抑郁組和輕度抑郁組,各組間差異具有統計學意義(P<0.05),見表3。
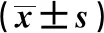
表3 各組PSG檢測對比結果
2.4血清IL-1、IL-2、5-HT、Hypocretin比較 PSD組血清IL-1、IL-2、Hypocretin顯著高于NPSD組和對照組(P<0.05),NPSD組顯著高于對照組(P<0.05),PSD組5-HT顯著低于NPSD組和對照組(P<0.05),NPSD組顯著低于對照組(P<0.05)。PSD組不同睡眠狀態組血清IL-1、IL-2、5-HT、Hypocretin水平差異顯著(P<0.05),嚴重睡眠障礙組血清IL-1、IL-2、Hypocretin水平最高,其次是輕度睡眠障礙組和睡眠正常組,各組間差異具有統計學意義(P<0.05),嚴重睡眠障礙組血清5-HT水平最低,其次是輕度睡眠障礙組和睡眠正常組,各組間差異具有統計學意義(P<0.05),見表4。
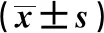
表4 各組血清IL-1、IL-2、5-HT、Hypocretin比較
與對照組比較:1)P<0.05;與NPSD組比較:2)P<0.05;與睡眠正常組比較:3)P<0.05;與輕度睡眠障礙組比較:4)P<0.05
2.5影響PSD患者睡眠障礙的因素分析 以PSD患者是否患有睡眠障礙為因變量(0=否,1=是),以HAMD評分、NIHSS評分、MRS評分、MBI評分、IL-1、IL-2、5-HT、Hypocretin為應變量進行多重線性回歸分析,逐步法排除無關變量(P>0.05),最終HAMD評分、5-HT、Hypocretin、IL-1、IL-2均與PSD睡眠障礙的發生獨立相關,見表5。

表5 影響PSD患者睡眠障礙的回歸分析結果
3 討 論
20.00%~40.00%腦卒中患者伴有睡眠-覺醒障礙,腦卒中可損害睡眠-覺醒神經結構引起器質性睡眠增多〔11〕。相關研究發現腦卒中后患者可出現睡眠時間延長、覺醒度降低和睡眠結構紊亂,即便在腦卒中后1年神經功能逐漸恢復后睡眠結構仍有異常〔12〕。PSD是腦卒中后常見并發癥,患者多出現消極情緒、興趣索然、悲觀消沉等負性情感增加表現和睡眠障礙,睡眠障礙可刺激兒茶酚胺分泌,促進血小板聚集,增加腦卒中復發風險〔13〕。因此關注PSD患者睡眠障礙對了解睡眠障礙發生機制,指導臨床治療有極大幫助。
Suh等〔14〕報道顯示腦卒中后睡眠障礙發生率高達44.20%,睡眠障礙與抑郁癥顯著相關(P=0.044),提示睡眠障礙是腦卒中后常見并發癥,而抑郁可加重睡眠障礙。本研究分別從PSQI評分、PSG檢測主客觀兩個角度觀察PSD患者睡眠障礙現狀和特點,發現PSD組患者PSQI各個維度評分均顯著高于對照組,驗證 PSD與睡眠障礙的相關性。睡眠障礙與患者軀體化、焦慮情緒呈正相關,腦卒中后患者肢體癱瘓影響患者獨立生活和工作能力,經濟收入減少,患者喪失安全感和價值感,同時疾病增加家庭經濟負擔,患者心理承受壓力巨大,生活能力降低嚴重影響患者生活質量,因此容易出現焦慮、恐懼、悲觀、絕望、抑郁等消極情緒和惡劣心境,引起睡眠障礙,而睡眠質量下降又可以加重身心癥狀,形成惡性循環〔15〕。本研究腦卒中患者不論是否發生PSD均出現一定程度睡眠結構破壞,表現為總睡眠時間縮短和睡眠效率的下降,覺醒增多、睡眠潛伏期增多,而PSD患者上述問題更為嚴重,且隨抑郁程度的增加而增加,分析原因可能為:5-HT是大腦重要神經遞質,廣泛分布于大腦皮層和神經突觸內,為自體活性物質可使人產生愉悅感,腦組織梗死發生時可阻斷5-HT能神經通路,導致分泌5-HT減少,降低神經活動興奮度,導致抑郁的發生〔16〕,而5-HT是引起快速眼動的重要神經遞質〔17〕,這也從分子生物學角度解釋了抑郁與睡眠障礙的關系。
神經-內分泌-免疫是相互聯系和相互作用的一個整體系統,共同調節和維持體內環境穩定狀態〔18,19〕。大腦、免疫系統形成雙向調控網絡,大腦組織受損時,免疫細胞大量激活可導致生理、行為、情感、認知等方面發生明顯變化。促炎細胞因子不僅在腦卒中、PSD中扮演重要角色,在睡眠障礙發生過程中也起到重要作用。相關研究發現非器質性抑郁癥患者血清IL-1、IL-18、超敏C反應蛋白(hs-CRP)細胞因子水平高于無抑郁癥人群〔20〕,說明炎性細胞因子作為聯絡網神經遞質,參與了抑郁癥發病機制。裝載腦特殊蛋白小鼠敲除IL-1受體后,非快速眼球運動(NREM)睡眠延長,REM睡眠減少,提示IL-1受體具有調節睡眠作用〔21〕。本研究觀察PSD組患者血清IL-1、IL-2水平明顯升高,高于NPSD組和對照組,睡眠障礙越重患者血清IL-1、IL-2水平越高,回歸分析IL-1、IL-2與PSD睡眠障礙相關,一方面為腦卒中炎性病理發生機制提供了證據,另一方面說明炎性細胞因子IL-1、IL-2可能參與PSD后睡眠障礙和炎性病理機制的發生發展過程。
與覺醒相關的神經遞質功能失調是導致腦卒中后睡眠障礙的主要因素,5-HT是介導感覺傳遞的神經遞質,5-HT能和去甲腎上腺素能神經元軸突通過丘腦、基底節區到達額葉皮質,腦梗死累及上述部分可影響5-HT能和去甲腎上腺素能神經通路,引起5-HT和去甲腎上腺素分泌下降,產生睡眠-覺醒障礙〔22〕。睡眠障礙患者5-HT水平偏低,神經系統興奮性偏高,表現為難以入睡或進入深度睡眠〔23〕。Hypocretin是廣泛分布于下丘腦區域的神經肽,由神經元分泌,通過丘腦中線核向大腦皮層投射,激活皮層引起覺醒,減少睡眠和REN睡眠時間〔24〕。腦梗死可阻斷Hypocretin信號通路,損害Hypocretin神經元和投射系統,擾亂神經遞質間相互調節,干擾睡眠-覺醒調節。本研究觀察PSD組患者血清Hypocretin水平高于NPSD組和對照組,且隨睡眠障礙程度加重而升高,5-HT水平明顯低于NPSD組和對照組,隨睡眠障礙程度加重而降低,Hypocretin升高、5-HT降低增強了促覺醒作用,加重患者覺醒-睡眠障礙,導致睡眠障礙發生。回歸分析Hypocretin、5-HT是PSD睡眠障礙的發生顯著相關,驗證了Hypocretin、5-HT在 PSD睡眠障礙中發揮重要調節作用,可能參與PSD睡眠障礙發生發展。
綜上,腦卒中后PSD患者睡眠障礙發病率較高,睡眠障礙程度與抑郁程度密切相關,炎性反應和神經遞質功能失調可能是導致PSD睡眠障礙的原因。本研究創新之處在于探討了PSD睡眠障礙可能的發病機制,在同類研究中少有。不足之處在于樣本數量有限,采用主觀評價量表PSQI為評價睡眠障礙的標準,導致主觀惡化睡眠質量評測結果的可能,望在以后研究中尋求更為可靠的評價指標、增加樣本數量進一步證實研究結果的可靠性。

