miR-142-3p靶向HMGB1逆轉乳腺癌細胞MCF-7對阿霉素的耐藥性
梁 璐,岑慧裕,洪 超,蔡曉彤,林忠曉,杜玲然,余細勇
(廣州醫科大學藥學院、廣東省分子靶標與臨床藥理學重點實驗室,廣東 廣州 511436)
乳腺癌是女性最常見的惡性腫瘤,也是女性癌癥相關死亡的第二大原因[1]。乳腺癌的標準治療方法是手術切除、放療和輔助化療。阿霉素(doxorubicin,DOX)常作為一線化療藥物用于治療乳腺癌[2]。目前,盡管開發出了療效高、毒性小的化療藥物,但化療耐藥性仍是預后不良的主要原因。因此,了解阿霉素耐藥的分子機制可能會改善臨床治療效果。在眾多機制研究中,治療誘導的自噬是抗腫瘤治療的新機制[3]。
自噬是一個進化上保守的過程,其特征是通過細胞的降解和循環來形成新的細胞[4]。越來越多的證據表明,自噬有助于腫瘤化療耐藥的形成和各種壓力下的癌細胞存活[3]。最近,自噬抑制劑被用來提高癌癥對化療的敏感性[3]。因此,自噬抑制劑聯合治療可能有助于提高乳腺癌細胞對化療的敏感性。據報道,miRNAs可通過自噬調節化療和放療[3]。
MicroRNAs (miRNAs)是一類新的小分子非編碼內源性RNAs,其長度為19~25個核苷酸[5]。miRNAs可以通過切割、破壞靶向mRNAs的穩定性或阻止其翻譯,轉錄后負性調節靶基因的表達[5]。miR-142-3p最初在造血細胞中被鑒定,并作為T細胞急性淋巴細胞白血病的致癌標志物[6]。此外,miR-142-3p被廣泛報道作為腫瘤抑制因子,參與到腫瘤發生、生長、侵襲等病理過程[7]。
高遷移率族蛋白1(high-mobility group box 1,HMGB1)是一種非組蛋白核DNA結合蛋白,屬于高遷移率族蛋白超家族。HMGB1參與了DNA的組織和調節基因轉錄,在炎癥、細胞分化和腫瘤細胞遷移等多種細胞過程中發揮作用[8]。同時,抑制HMGB1的表達可以破壞端粒穩態,抑制DNA損傷的修復,從而提高乳腺癌細胞的敏感性[8]。因此,HMGB1可能是促進乳腺癌化療敏感性的關鍵基因。為了探討miR-142-3p在自噬和促進乳腺癌化療敏感性中的調節作用,我們研究了miR-142-3p在提高人乳腺癌細胞系MCF-7細胞化療敏感性中的作用以及miR-142-3p與HMGB1之間的關系,本文將重點探討miR-142-3p通過靶向 HMGB1 參與乳腺癌化療敏感性調控的分子機制。
1 材料與方法
1.1 材料
1.1.1細胞 人乳腺癌細胞系MCF-7,購自中國科學院細胞庫。
1.1.2試劑 阿霉素(貨號:HZB1357)購于華中海威基因科技有限公司;DMEM 培養基(貨號:12491-015)、胎牛血清(貨號:10099)購于美國 Gibco 公司;胰蛋白酶(貨號:T2601)、青-鏈霉素溶液(貨號:ZS507)、MTT(貨號:M2128)、DMSO(貨號:D2650)購自美國 Sigma公司;GAPDH抗體(貨號:TA-08)、抗兔二抗(貨號:ZDR-5118)、抗鼠二抗(貨號:ZDR-5117)購自北京中杉金橋;HMGB1抗體(貨號:ABM24D3)、Atg5抗體(貨號:EPR1755)購自Abcam公司;LC3抗體(貨號:L8918)購自Sigma公司;Lipofectamine 2000(貨號:11668027)、 Trizol(貨號:10296010)購自美國Invitrogen公司;熒光素酶報告試劑盒(貨號:KA3714)購自美國Promege公司;Annexin V-FITC 細胞凋亡檢測試劑盒(貨號:C1067S)購自碧云天生物公司,Quantitect?逆轉錄試劑盒(貨號:204145)購自德國Qiagen公司。
1.1.3儀器 低溫高速離心機(德國 Hettich 公司);垂直電泳槽、轉膜儀(美國 Bio-Rad 公司) ;超凈工作臺( 蘇州儀器廠);CO2培養箱( Thermo);-80℃冰箱(Thermo Fisher Scientific Inc);酶標儀(美國加利福尼亞州森尼維爾市分子設備公司);Agilent StrataGene Mx3000P QPCR(Agilent Technologies);流式細胞儀(Becton Dickinson-Facsort)。
1.2 方法
1.2.1細胞系 以親本MCF-7細胞(人乳腺癌細胞系)為材料,通過加入濃度逐漸升高的DOX處理細胞,建立阿霉素耐藥的MCF-7細胞系MCF/DOX。所有細胞均用含有10% FBS和1%青-鏈霉素的DMEM,在5% CO2、37 ℃恒溫培養箱中培養。MCF-7/DOX細胞在含1.0 mg·L-1DOX培養液中培養,以維持MCF-7/DOX細胞耐藥性。
1.2.2MTT法 用MTT法測定細胞存活率和細胞毒性。按照說明書操作。酶標儀測量490 nm處的吸光度值(OD值)。未經DOX處理的細胞作為對照。按公式:細胞存活率/%=OD處理/OD對照×100%,求出各組的存活率,重復3次。計算并評價細胞存活率。
1.2.3細胞凋亡測定 采用Annexin V-FITC/PI雙染聯合流式細胞儀檢測細胞凋亡情況。用胰蛋白酶消化1 μmol·L-1DOX處理48 h后的各組細胞,收集細胞懸液并用PBS洗滌兩次。每組加入5 μL Annexin V-FITC, 4 ℃下避光孵育10 min,加入10 μL PI 孵育10 min后,采用流式細胞儀讀取各組凋亡率。
1.2.4生物信息學預測和雙熒光素酶報告分析 在熒光素酶報告實驗中,為了研究miR-142-3p是否調控HMGB1的表達,用QPCR方法從人類基因組DNA中擴增出含有miR-142-3p結合序列的HMGB1基因的3′UTR片段的野生型(WT)及其突變體(MT)并構建空白對照組(NC)。并將其插入PGL3熒光素酶載體中螢火蟲熒光素酶基因的3′UTR中。然后通過Lipofectamine 2000將WT或MT-pgl3-HMGB1-3′UTR與miR-NC、miR-142-3p、anti-miR-NC或anti-miR-142-3p聯合轉染細胞。24 h后收集細胞,按照雙熒光素酶報告分析試劑盒說明書,測定各組細胞中的熒光值。
1.2.5細胞轉染 miR-142-3p mimics和相應陰性對照miRNA control、si-HMGB1、pcDNA-HMGB1和相應陰性對照(si-NC,pcDNA)的siRNA購自上海吉瑪公司。將細胞接種到12孔板中,在5% CO2、37 ℃培養箱中培養24 h。隨后,根據說明書使用Lipofectamine 2000對細胞進行轉染,然后在5% CO2、37 ℃培養箱中孵育6 h。隨后,用含有10% FBS的DMEM更換掉每孔中的培養基并孵育48 h。通過QPCR和Western blot測定轉染率。
1.2.6實時熒光定量 PCR( QPCR)用TRIzol試劑提取總RNA。用Quantitect?逆轉錄試劑盒將500 ng的總RNA逆轉錄成cDNA。QPCR中使用的引物序列如下。取2 μL cDNA 于實時熒光定量PCR儀按SYBR Green PCR Master Mix說明書進行QPCR,反應條件:95 ℃激活5 min,95 ℃ 15 s、60 ℃ 30 s,72 ℃ 1 min共50個循環。

Tab 1 Primers of QPCR
1.2.7Western blot 用RIPA提取細胞總蛋白質,BCA液測定總蛋白質濃度,取等量的各組蛋白上樣,使用SDS-PAGE凝膠,在100 V恒壓下電泳,250 mA 恒流轉膜,5% 脫脂奶粉封閉1 h,一抗 HMGB1(1 ∶5 000)、Agt5(1 ∶5 000)、LC3(1 ∶1 000)和GAPDH(1 ∶10 000)4 ℃孵育過夜,二抗孵育1 h,HRP化學發光液顯色。

2 結果
2.1 MCF-7和MCF-7/DOX細胞的特性驗證用不同濃度的DOX(0.1625、0.3125、0.625、1.25、2.5、5 μmol·L-1)處理MCF-7和MCF-7/DOX細胞48 h。Fig 1A的MTT結果顯示,與MCF-7/DOX細胞相比,MCF-7細胞對DOX的敏感性更高(P<0.05)。此外,用western blot和QPCR分別檢測MCF-7和MCF-7/DOX細胞中HMGB1和自噬相關蛋白(Atg5、LC3-Ⅰ和LC3-Ⅱ)的水平,與MCF-7細胞相比,HMGB1在MCF-7/DOX細胞中的表達更高 (P<0.05)(Fig1B和C)。同時,MCF-7/DOX細胞中的自噬相關蛋白Atg5和LC3-Ⅰ轉化產生的LC3-Ⅱ積累更明顯(P<0.05)(Fig 1D)。綜上所述,HMGB1和自噬可能與乳腺癌細胞耐藥性的產生有關。
2.2 miR-142-3p對MCF-7和MCF-7/DOX細胞的影響為了研究miR-142-3p在乳腺癌化療耐藥中的作用,我們用QPCR檢測了MCF-7和MCF-7/DOX細胞中miR-142-3p的表達水平。Fig 2A 的 QPCR 結果顯示,與MCF-7細胞相比,MCF-7/DOX細胞中的miR-142-3p表達明顯降低(P<0.05) 。隨后,我們用miR-142-3p mimics提高miR-142-3p在MCF-7/DOX細胞中的表達(Fig 2B)。此外,miR-142-3p mimics 還可以提高MCF-7/DOX細胞對阿霉素的敏感性并且增強凋亡細胞比率(Fig 2C和D)(P<0.05)。上述結果表明,miR-142-3p的過表達可以提高MCF-7/DOX細胞對藥物的敏感性。
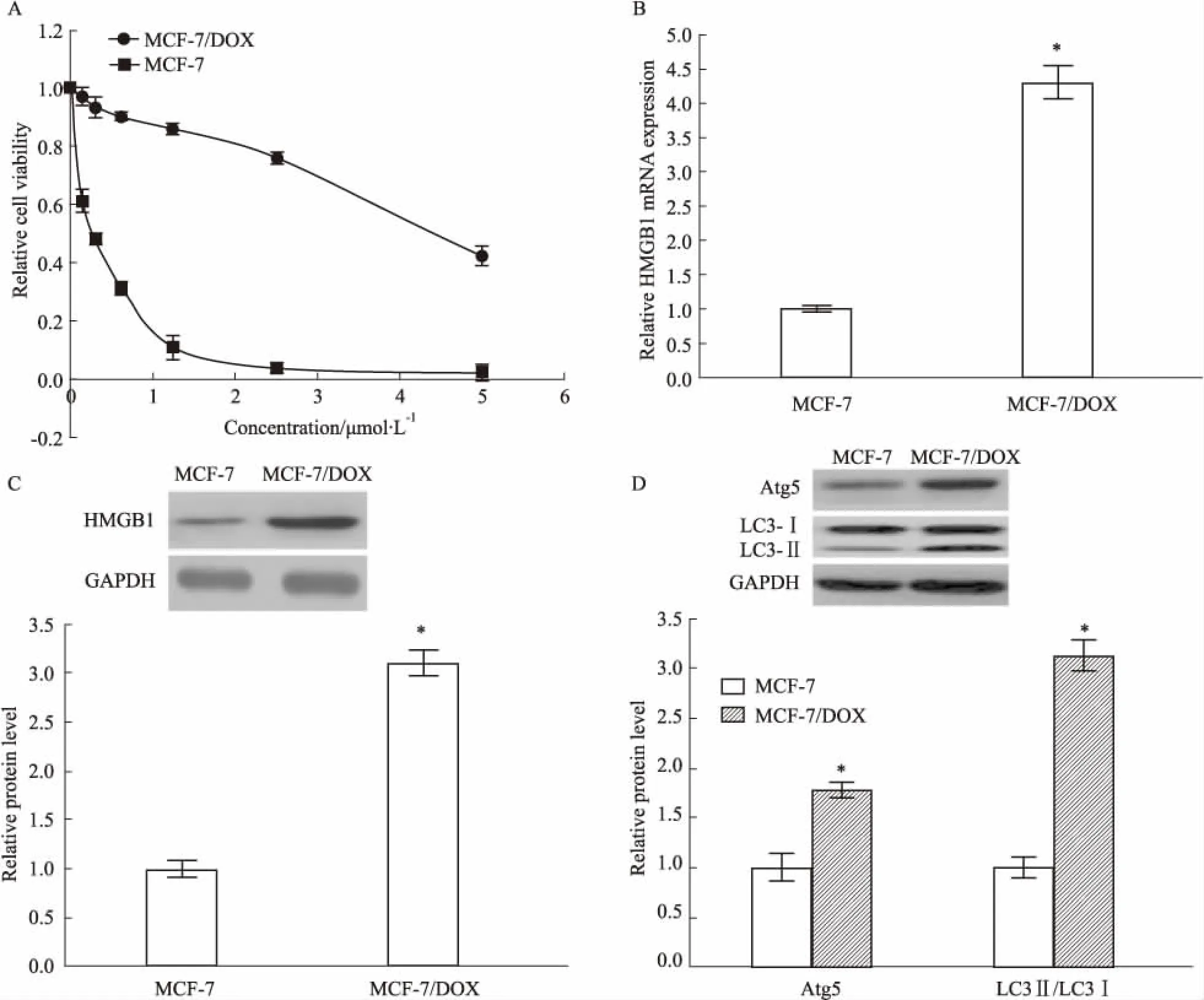
Fig 1 Levels of HMGB1 and autophagy-related proteins in MCF-7/DOX and
A:Cell survival rates were detected by MTT assay in MCF-7 and MCF-7/DOX treated with various concentrations (0.1625,0.3125,0.625,1.25,2.5,5 μmol· L-1) of DOX for 48 hours; B,C and D:The levels of HMGB1 and autophagy-related proteins (Atg5,LC3-Ⅰ and LC3-Ⅱ). (D) MCF-7 and MCF-7/DOX cells were detected by Western blot and QPCR,respectively.*P<0.05vsMCF-7 cells.

Fig 2 Effect of miR-142-3p on MCF-7 and MCF-7/DOX
A:QPCR analysis of the relative miR-142-3p expression in parental MCF-7 and DOX-resistant MCF-7/DOX cells.*P<0.05vsMCF-7 cells. B:QPCR analysis of relative miR-142-3p expression in MCF-7/DOX cells transfected with miR-142-3p mimic.*P<0.05vsmiR-NC in MCF-7/DOX cells. C:MTT assay was applied to determine the IC50value in miR-NC or miR-142-3P transfected MCF-7/DOX cells after treatment with different doses of DOX (0.1625,0.3125,0.625,1.25,2.5,and 5 μmol·L-1) for 48 h.*P<0.05vsmiR-NC in MCF-7/DOX cells. D:Transfected MCF-7/DOX cells were treated with or without DOX for 48h,followed by the assessment of apoptotic rate by flow cytometry,respectively.*P<0.05vsmiR-NC in MCF-7/DOX cells. E. The statitics of apoptotic cells.*P<0.05 vs miR-NC in MCF-7/DOX cells.
2.3 miR-142-3p靶向HMGB1通過生物信息學分析結果顯示,miR-142-3p可能靶向調控HMGB1(Fig 3A)。為了確定miR-142-3p是否可以直接靶向HMGB1,我們在MCF-7/DOX 細胞中開展雙熒光素酶報告基因實驗。結果發現:在MCF-7/DOX 細胞中,與 Scramble 組相比,miR-142-3p mimics能夠抑制野生型 PGL3-WT-HMGB1 熒光素酶活性(P<0.05)。而當結合位點突變后miR-142-3p mimics對突變型 pGL3-MT-HMGB1熒光素酶活性無抑制效果( Fig 3B)(P<0.05)。隨后用Western blot檢測HMGB1的蛋白水平,如Fig 3C所示,miR-142-3p mimics可降低HMGB1的表達(P<0.05)。這說明HMGB1和 miR-142-3p在乳腺癌細胞中表達呈負相關。
2.4 沉默HMGB1提高乳腺癌細胞對阿霉素的敏感性我們通過沉默MCF-7/DOX細胞中的HMGB1的表達來研究HMGB1的潛在機制 (Fig 4A)。如Fig 4B 和C所示,下調HMGB1可提高MCF-7/DOX細胞對阿霉素的敏感性并且增強凋亡細胞比率(P<0.05)。
2.5 miR-142-3p通過抑制自噬相關蛋白的表達,靶向HMGB1增強乳腺癌細胞的化療敏感性為了研究miR-142-3p與HMGB1相互作用調節藥物敏感性的機制,分別用miR-NC、miR-142-3p 或miR-142-3p +pcDNA-HMGB1轉染MCF-7/DOX細胞。結果表明,HMGB1的過表達則大大削弱了MCF-7/DOX細胞中miR-142-3p產生的阿霉素敏感性(Fig 5A)(P<0.05)。此外,HMGB1的過表達逆轉了MCF-7/DOX細胞中的miR-142-3p對凋亡的促進作用(Fig 5B)(P<0.05)。這些結果表明,通過靶向HMGB1,miR-142-3p提高了乳腺癌細胞對阿霉素的敏感性。用 Western blot檢測乳腺癌細胞自噬相關蛋白水平的表達,miR-142-3p的過表達顯著降低了MCF-7/DOX細胞中自噬相關蛋白Atg5和LC3-Ⅱ/ LC3-Ⅰ的水平,而HMGB1的過表達有效地恢復了miR-142-3p導致的自噬相關蛋白水平的降低(Fig 5C)(P<0.05)。綜上所述,通過靶向HMGB1抑制自噬,miR-142-3p提高了乳腺癌細胞對化療藥物的敏感性。

Fig 3 HMGB1 expression inhibitedby miR-142-3p via binding to its
A:Diagram of putative miR-142-3p binding sequence in HMGB1 3′UTR and its mutant in luciferase reporter assay. B:Luciferase reporter assay was performed to measure luciferase activity in MCF-7/DOX cells,respectively. C:Western blot analysis of HMGB1 protein levels in MCF-7/DOX cells.*P<0.05vsmiR-NC in MCF-7/DOX cells.
3 討論
阿霉素是治療各種癌癥最常用的抗癌藥物之一。然而,阿霉素產生耐藥性是臨床上常見的事件。研究表明,耐藥性的發展與癌細胞中的miRNAs表達改變密切相關[9]。miRNAs被廣泛認為是細胞凋亡、細胞周期進展、生長、增殖和癌癥耐藥性的關鍵調節因子[5]。在乳腺癌治療中,一系列的miRNAs參與了化療敏感性的調節,如miR-186-5p[10]和miR-129-5p[11]。miR-142-3P參與多種惡性腫瘤細胞的增殖和轉移。例如,miR-142-3p的過度表達可以抑制骨肉瘤細胞[12]、宮頸癌[13]和結腸癌[14]的增殖。在本研究中,我們發現,miR-142-3p的過表達可增加MCF-7細胞對阿霉素的敏感性。
HMGB1作為一種自噬和凋亡調節因子,可以調節炎癥、細胞分化、細胞遷移和腫瘤的發生和發展[12]。在非小細胞肺癌[13]、心肌細胞[14]中發現HMGB1是miR-142-3p的直接作用靶點。隨后,我們進一步揭示了miR-142-3p增強乳腺癌細胞對阿霉素敏感性的作用機制。通過生物信息學和熒光素酶報告實驗,我們發現HMGB1是miR-142-3p的直接作用靶點,HMGB1在許多類型的腫瘤中過表達,包括乳腺癌[15]。我們發現與親本MCF-7細胞相比,在MCF-7/DOX細胞中HMGB1的mRNA和蛋白質水平都有很高的表達。此外,沉默HMGB1增強了阿霉素敏感性,并促進了阿霉素誘導的MCF-7/DOX細胞凋亡。同時,在MCF-7/DOX細胞中,HMGB1過表達后則大大削弱了miR-142-3p產生的阿霉素敏感性。上述結果表明,miR-142-3p通過靶向HMGB1增強了耐藥細胞系對阿霉素的敏感性。
自噬是細胞自我消化的過程,通過降解和再利用細胞中那些不需要的或功能失調的成分來維持細胞的穩態[4]。自噬在腫瘤發育中起著雙重作用。自噬可以清除突變或錯誤折疊的蛋白質,并在腫瘤形成初期減輕細胞應激,起到抑制作用;另一方面,自噬使腫瘤細胞在應激條件下形成藥物化療的屏障[3]。因此,我們推測抑制自噬可克服耐藥性,有利于癌癥治療。我們的結果表明,阿霉素可導致自噬活性增加,miR-142-3p的過度表達通過抑制自噬顯著提高了阿霉素誘導細胞凋亡的能力。miR-142-3p/HMGB1參與乳腺癌細胞的增殖和凋亡過程,為提高乳腺癌對藥物的敏感性提供了新的靶點,具有一定應用價值。

Fig 4 Sensitivity of breast cancer cells to DOX enhanced by
A:Western blot analysis of HMGB1 protein level in transfected MCF-7/DOX cells. B:MTT assay was applied to determine the cell viability and DOX. IC50value in si-NC- or si-HMGB1-transfected MCF-7/DOX cells after treatment with different doses of DOX (0.1625,0.3125,0.625,1.25,2.5,and 5 μmol· L-1) for 48 h. C:Flow cytometry analysis of apoptosis in si-NC or si-HMGB1-transfected MCF-7/DOX cells with or without DOX treatment.*P<0.05vssi-NC in MCF-7/DOX cells.D. The statitics of apoptotic cells.*P<0.05vssi-NC in MCF-7/DOX cells.

Fig 5 Drug sensitivity of breast cancer cells enhancedby miR-142-3p upregulationthrough suppressing
A:Transfected MCF-7/DOX cells were treated with different doses of DOX (0.1625,0.3125,0.625,1.25,2.5,and 5 μmol· L-1) for 48 h,respectively,then MTT assay was used to determine the cell viability and IC50value. B:Transfected MCF-7/DOX cells were treated with 3 μmol· L-1DOX for 48 h,respectively,followed by the detection of apoptotic rate by flow cytometry. C:The level of autophagy related proteins Atg5,LC3-Ⅰ and LC3-Ⅱ in MCF-7/DOX cells transfected with miR-NC,miR-142-3p,or miR-142-3p +pcDNA-HMGB1 were detected by Western blot.*P<0.05 vs miR-142-3p in MCF-7/DOX cells.

