腫瘤相關(guān)巨噬細(xì)胞研究進(jìn)展①
楊 黎 張 毅
(鄭州大學(xué)第一附屬醫(yī)院生物細(xì)胞治療中心和腫瘤中心,鄭州 450052)

楊 黎,博士,副研究員,碩士生導(dǎo)師,國際留學(xué)生導(dǎo)師,河南省衛(wèi)生科技創(chuàng)新型人才,留學(xué)美國芝加哥大學(xué)。擔(dān)任中國研究型醫(yī)院學(xué)會(huì)生物治療學(xué)專業(yè)委員會(huì)委員、中國抗癌協(xié)會(huì)腫瘤與微生態(tài)專業(yè)委員會(huì)委員、中國抗癌協(xié)會(huì)腫瘤代謝專業(yè)委員會(huì)免疫代謝學(xué)組全國委員、中華醫(yī)學(xué)會(huì)醫(yī)學(xué)細(xì)胞生物學(xué)分會(huì)第六屆委員會(huì)青委會(huì)委員等學(xué)術(shù)兼職。主持國家自然科學(xué)青年基金1項(xiàng)及省部級(jí)項(xiàng)目6項(xiàng)。共發(fā)表相關(guān)論文70余篇,其中以第一作者在Mol Cancer、J Hematol Oncol、J Immunother Cancer、Cancer Lett、Oncoimmunology等雜志發(fā)表SCI文章19篇。主要從事腫瘤微環(huán)境及腫瘤固有信號(hào)通路對(duì)腫瘤免疫的調(diào)控機(jī)制研究。

張 毅,博士,教授,博士生導(dǎo)師,河南省特聘教授,鄭州大學(xué)一附院生物細(xì)胞治療中心主任,河南省腫瘤免疫和生物治療重點(diǎn)實(shí)驗(yàn)室主任,曾在歐美留學(xué)和工作10余年。擔(dān)任中國研究型醫(yī)院學(xué)會(huì)生物治療學(xué)專業(yè)委員會(huì)副主任委員、中國醫(yī)藥質(zhì)量管理協(xié)會(huì)細(xì)胞治療質(zhì)量控制與研究專業(yè)委員會(huì)副主任委員等學(xué)術(shù)兼職。承擔(dān)國家自然科學(xué)基金6項(xiàng)和國家重點(diǎn)研發(fā)計(jì)劃項(xiàng)目2項(xiàng)。在Nat Cell Biol、J Clin Invest、Mol Cancer、Cancer Res、Oncogene、Oncoimmunology、Nat Commun、Cancer Immunol Res等雜志發(fā)表SCI論文152篇。從事腫瘤免疫基礎(chǔ)研究和臨床應(yīng)用三十余年,主要研究方向?yàn)槟[瘤微環(huán)境調(diào)控免疫抑制作用的相關(guān)機(jī)制、影響T細(xì)胞分化和功能的分子機(jī)制、腫瘤免疫治療新策略(靶向?qū)嶓w瘤的 CAR-T、TCR-T細(xì)胞和新抗原臨床應(yīng)用)的臨床試驗(yàn)研究等。
腫瘤微環(huán)境是腫瘤發(fā)生發(fā)展所依賴的土壤,由免疫細(xì)胞、成纖維細(xì)胞和血管內(nèi)皮細(xì)胞等共同組成,其中免疫細(xì)胞是主要成分,因此炎癥是腫瘤微環(huán)境的一個(gè)重要標(biāo)志[1]。腫瘤微環(huán)境中的免疫細(xì)胞與腫瘤細(xì)胞相互作用,影響腫瘤的發(fā)生、發(fā)展及轉(zhuǎn)移[2]。腫瘤相關(guān)巨噬細(xì)胞(tumor-associated macrophages,TAMs)是腫瘤微環(huán)境中重要的免疫細(xì)胞,其通過調(diào)控腫瘤微環(huán)境介導(dǎo)腫瘤進(jìn)展[3,4]。
一般來講,單核/巨噬細(xì)胞可極化為M1型或M2型巨噬細(xì)胞。M1型巨噬細(xì)胞也稱為經(jīng)典激活的巨噬細(xì)胞,由IFN-γ等促炎性細(xì)胞因子和免疫刺激性細(xì)胞因子(如IL-12、IL-23)誘導(dǎo)而成,這些細(xì)胞因子參與Ⅰ型輔助性T(T helper 1,Th1)細(xì)胞反應(yīng)。而TAMs被認(rèn)為更類似于M2型巨噬細(xì)胞[5],亦被稱為替代激活的巨噬細(xì)胞,由Th2細(xì)胞因子(如IL-4、IL-10和IL-13)激活。TAMs在炎癥和癌癥的關(guān)系方面起著重要作用。隨著TAMs與惡性腫瘤之間的關(guān)系不斷被揭示,TAMs被認(rèn)為是腫瘤潛在的治療靶點(diǎn)。因此,本文總結(jié)了TAMs的來源、極化、如何參與腫瘤進(jìn)展,以及其作為腫瘤治療靶點(diǎn)的研究進(jìn)展。
1 TAMs的來源
組織中的巨噬細(xì)胞最初被認(rèn)為是來源于骨髓,然而,來自于原始卵黃囊前體的局部自我維持的肺泡和腹腔巨噬細(xì)胞、庫普弗細(xì)胞、表皮朗格漢斯細(xì)胞和腦小膠質(zhì)細(xì)胞被稱為組織駐留巨噬細(xì)胞。雖然有證據(jù)表明各類巨噬細(xì)胞可以在腫瘤中共存,但招募的巨噬細(xì)胞占TAMs的大多數(shù)。目前,還無法評(píng)估這些巨噬細(xì)胞在不同腫瘤不同進(jìn)展階段中的各自作用,仍需要進(jìn)一步研究。
骨髓來源的外周血單核細(xì)胞在腫瘤微環(huán)境中基質(zhì)細(xì)胞和腫瘤細(xì)胞分泌的趨化因子的作用下,被招募至腫瘤局部并進(jìn)一步分化為TAMs。無論巨噬細(xì)胞來自卵黃囊還是骨髓,CSF1均是大多數(shù)巨噬細(xì)胞的主要調(diào)節(jié)因子和趨化因子[6]。CCL2與其受體CCR2的結(jié)合直接介導(dǎo)了單核細(xì)胞招募至原發(fā)和轉(zhuǎn)移瘤中[7]。在異種移植瘤模型中發(fā)現(xiàn),VEGFA可以趨化單核細(xì)胞,并在IL-4作用下極化為TAMs。在人乳腺癌動(dòng)物模型中發(fā)現(xiàn),CCL18與其受體PITPNM3結(jié)合,協(xié)同CSF2介導(dǎo)了巨噬細(xì)胞的招募[8]。在結(jié)腸癌模型中發(fā)現(xiàn),巨噬細(xì)胞的招募是通過CCL20結(jié)合其受體CCR6介導(dǎo)的,該趨化因子的缺失導(dǎo)致了單核細(xì)胞和/或TAMs的下調(diào)及腫瘤的消退[9]。CXCL12/CXCR4軸介導(dǎo)了TAMs的累積,并與B16惡性黑色素瘤的進(jìn)展相關(guān)[10]。
2 TAMs的極化
在腫瘤微環(huán)境中TAMs一般表現(xiàn)為M2型巨噬細(xì)胞的特征,表達(dá)抗炎性細(xì)胞因子、清除受體、血管生成因子和蛋白酶的水平高于M1型巨噬細(xì)胞。這些抗炎性細(xì)胞因子可以重塑腫瘤免疫抑制微環(huán)境,進(jìn)而促進(jìn)腫瘤進(jìn)展。TAMs的極化不受其所在部位本身影響,而是受到其所在特定微環(huán)境的信號(hào)作用所致。影響TAMs極化的因素包括腫瘤細(xì)胞來源的因子、腫瘤微環(huán)境、巨噬細(xì)胞自分泌因子及穩(wěn)態(tài)失衡因素。
2.1腫瘤細(xì)胞來源的因子 腫瘤細(xì)胞產(chǎn)生的多種因子可以促進(jìn)巨噬細(xì)胞向M2型極化。研究發(fā)現(xiàn),結(jié)腸癌細(xì)胞來源的CSF1可促進(jìn)巨噬細(xì)胞的招募和極化[11]。趨化因子CCL2、CCL3和CCL14刺激多發(fā)性骨髓瘤中巨噬細(xì)胞的增殖和極化[12]。IL-10抑制了巨噬細(xì)胞中促炎性細(xì)胞因子和趨化因子的產(chǎn)生,導(dǎo)致巨噬細(xì)胞向M2型極化[13]。IL-4與CSF1協(xié)同作用,誘導(dǎo)M2型巨噬細(xì)胞極化[14]。最近的研究表明,腫瘤細(xì)胞來源的微顆粒介導(dǎo)了TAMs的極化,促進(jìn)了腫瘤進(jìn)展[15]。此外,前列腺癌細(xì)胞來源的Cathelicidin相關(guān)抗菌肽再教育巨噬細(xì)胞向M2型極化[16]。可溶性MHCⅠ類鏈相關(guān)分子通過激活STAT3信號(hào)通路誘導(dǎo)巨噬細(xì)胞向免疫抑制表型轉(zhuǎn)變[17]。
2.2腫瘤微環(huán)境 一旦外周血單核細(xì)胞被招募至腫瘤部位,腫瘤微環(huán)境則迅速促進(jìn)其分化成TAMs。腫瘤微環(huán)境中的多種細(xì)胞分泌細(xì)胞因子調(diào)節(jié)巨噬細(xì)胞極化,包括CD4+細(xì)胞分泌的Th2型細(xì)胞因子IL-4[18],調(diào)節(jié)性T細(xì)胞分泌的IL-10[19],及B細(xì)胞分泌的免疫球蛋白[20]。Th2細(xì)胞來源的IL-13亦可能對(duì)TAMs極化發(fā)揮促進(jìn)作用,因?yàn)镮L-13和IL-4信號(hào)級(jí)聯(lián)重疊可導(dǎo)致STAT6激活,盡管體內(nèi)實(shí)驗(yàn)尚未證實(shí)[21]。此外,間充質(zhì)基質(zhì)細(xì)胞來源的MFG-E8已被證實(shí)可增強(qiáng)巨噬細(xì)胞向M2型極化[22]。
2.3巨噬細(xì)胞自分泌因子 最近報(bào)道稱,巨噬細(xì)胞自身來源的MIF是黑色素瘤小鼠中TAMs極化的重要決定因素[23]。MIF缺失或應(yīng)用MIF拮抗劑可以明顯減弱TAMs極化,并降低TAMs中促血管生成基因的表達(dá)。另外,腫瘤浸潤的巨噬細(xì)胞可產(chǎn)生IL-10促進(jìn)自我極化[24]。另一項(xiàng)研究發(fā)現(xiàn),巨噬細(xì)胞自分泌CXCL12調(diào)節(jié)自身向具有免疫抑制功能的方向分化[25]。
2.4穩(wěn)態(tài)失衡 低氧可以促進(jìn)腫瘤進(jìn)展及轉(zhuǎn)移,主要通過HIF介導(dǎo),HIF亦可調(diào)節(jié)巨噬細(xì)胞的功能[26]。HMGB1、細(xì)胞外ATP等與巨噬細(xì)胞表面Toll樣受體(toll-like receptor,TLR)結(jié)合,導(dǎo)致巨噬細(xì)胞功能改變。研究還發(fā)現(xiàn),TLR2和TLR6信號(hào)通路均能通過誘導(dǎo)巨噬細(xì)胞TNF-α的產(chǎn)生促進(jìn)肺癌進(jìn)展[27]。腫瘤細(xì)胞來源的細(xì)胞外基質(zhì)(Extracellular matrix,ECM),包括二聚糖和透明質(zhì)酸,可以通過TLR2和TLR4信號(hào)通路促進(jìn)TAMs極化[28]。至關(guān)重要的是,這些ECM成分在非炎癥組織中并不與TLRs結(jié)合,而是在蛋白酶裂解或與活性氧或氮相互作用后成為TLRs配體,從而形成檢測(cè)炎癥和組織破壞的感應(yīng)通路。此外,在白血病干細(xì)胞微環(huán)境中TAMs亦可由骨髓來源的其他抑制細(xì)胞分化而來[29]。
3 TAMs調(diào)控腫瘤進(jìn)展
TAMs在促進(jìn)腫瘤進(jìn)展中起著至關(guān)重要的作用,包括促進(jìn)腫瘤發(fā)生和進(jìn)展、形成免疫抑制微環(huán)境、促進(jìn)轉(zhuǎn)移及建立癌前轉(zhuǎn)移微環(huán)境、促進(jìn)腫瘤血管生成(圖1)。
3.1促進(jìn)腫瘤發(fā)生和進(jìn)展 TAMs聯(lián)系著炎癥和癌癥。2009年,癌癥相關(guān)的炎癥首次被定義為癌癥的標(biāo)志之一。有證據(jù)表明,炎癥微環(huán)境促進(jìn)了腫瘤上皮細(xì)胞和浸潤免疫細(xì)胞(如巨噬細(xì)胞)的基因不穩(wěn)定性。最近,TAMs來源的炎性細(xì)胞因子IL-23和IL-17被證明與癌癥進(jìn)展密切相關(guān)[30]。Kupffer細(xì)胞可以通過分泌有絲分裂原促進(jìn)肝細(xì)胞癌進(jìn)展,該機(jī)制依賴于NF-κB信號(hào)通路[31]。另有數(shù)據(jù)表明,TAMs來源的IL-6通過STAT3信號(hào)通路促進(jìn)肝癌的發(fā)生發(fā)展[32],TAMs來源的IL-10通過STAT1信號(hào)通路促進(jìn)非小細(xì)胞肺癌的發(fā)生發(fā)展[33]。這些結(jié)果揭示,腫瘤浸潤的巨噬細(xì)胞在癌癥的發(fā)生和發(fā)展過程中起著重要的作用。
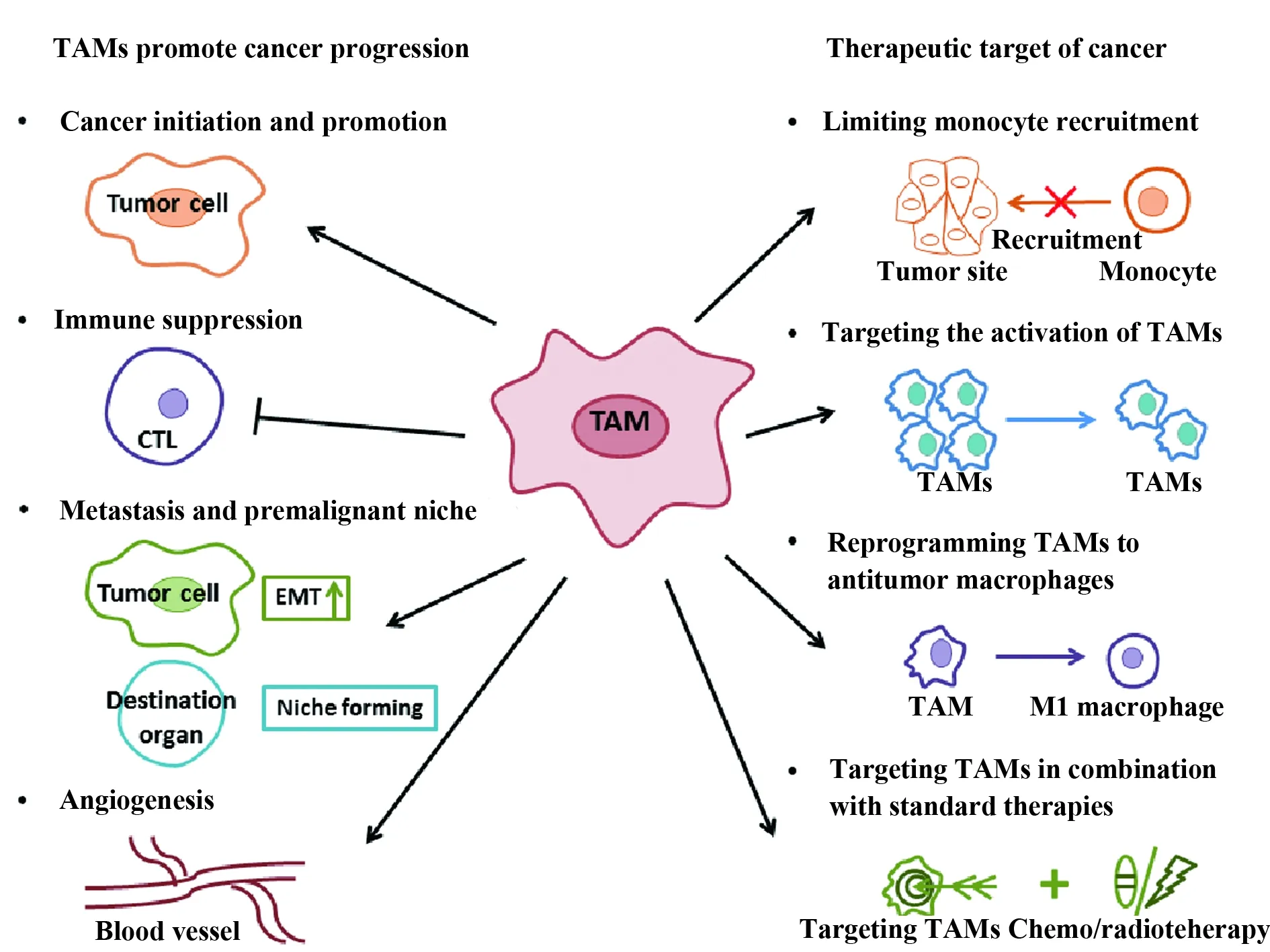
圖1 TAMs促進(jìn)腫瘤進(jìn)展的機(jī)制及其作為腫瘤治療靶點(diǎn)的策略Fig.1 TAMs promote tumor progression and clinical applic-ation of TAMs as a therapeutic target for cancer
3.2形成免疫抑制微環(huán)境 TAMs是腫瘤微環(huán)境中主要的免疫調(diào)節(jié)細(xì)胞,參與抑制細(xì)胞毒性T淋巴細(xì)胞的抗腫瘤效應(yīng)。惡性胸腔積液中TAMs分泌TGF-β增多,導(dǎo)致T細(xì)胞抗腫瘤效應(yīng)降低[34,35]。在小鼠腫瘤模型中,TAMs抑制CD8+T細(xì)胞的增殖,在一定程度上通過誘導(dǎo)iNOS或Arginase I產(chǎn)生ROS,導(dǎo)致免疫抑制作用[36]。TAMs產(chǎn)生的IL-10可誘導(dǎo)共刺激分子PD-L1在單核細(xì)胞中的表達(dá),從而抑制細(xì)胞毒性T淋巴細(xì)胞抗腫瘤效應(yīng)[37]。此外,TAMs來源的PGE2、IL-10、吲哚胺2,3-雙加氧酶在調(diào)節(jié)性T細(xì)胞(T regulatory cells,Tregs)的誘導(dǎo)過程中發(fā)揮重要作用,TAMs來源的CCL17、CCL18、CCL22是Tregs的重要趨化因子,Tregs進(jìn)一步抑制腫瘤微環(huán)境中T細(xì)胞的免疫效應(yīng)作用[38]。
3.3促進(jìn)轉(zhuǎn)移及建立癌前轉(zhuǎn)移微環(huán)境 TAMs促進(jìn)腫瘤進(jìn)展的機(jī)制還包括增強(qiáng)腫瘤轉(zhuǎn)移和建立轉(zhuǎn)移前微環(huán)境[39]。在人移植瘤模型中研究發(fā)現(xiàn),TAMs來源的CCL18促進(jìn)腫瘤細(xì)胞侵襲和轉(zhuǎn)移[40]。腫瘤細(xì)胞通過ECM遷移是腫瘤轉(zhuǎn)移所必需的,而TAMs被認(rèn)為可以通過ECM促進(jìn)腫瘤細(xì)胞的遷移和侵襲[41]。TAMs可以產(chǎn)生蛋白酶,包括組織蛋白酶B、MMP2、MMP7和MMP9,并可裂解ECM,為腫瘤細(xì)胞的轉(zhuǎn)移提供通道和途徑。
上皮間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transit-ion,EMT)在腫瘤進(jìn)展和轉(zhuǎn)移中發(fā)揮重要作用。因此,闡明EMT的調(diào)控機(jī)制將大大提高我們對(duì)腫瘤遷移和侵襲的認(rèn)識(shí)。越來越多的證據(jù)表明,EMT是TAMs與腫瘤細(xì)胞相互作用之后腫瘤變化的重要特征,TAMs來源的相關(guān)因子在EMT的發(fā)生發(fā)展過程中發(fā)揮重要作用[42]。
根據(jù)動(dòng)物模型的研究結(jié)果發(fā)現(xiàn),TAMs在腫瘤形成轉(zhuǎn)移前微環(huán)境中起著關(guān)鍵作用。腫瘤組織中TAMs分泌的TNF-α、VEGF和TGF-β可以通過血流運(yùn)輸?shù)桨衅鞴伲T導(dǎo)局部巨噬細(xì)胞產(chǎn)生S100A8和血清淀粉樣蛋白A3,這些因子進(jìn)一步招募巨噬細(xì)胞和腫瘤細(xì)胞進(jìn)入靶器官中,促進(jìn)轉(zhuǎn)移灶的形成[43]。因此,TAMs被認(rèn)為不僅可以影響局部微環(huán)境,還會(huì)影響全身的巨噬細(xì)胞,從而導(dǎo)致腫瘤的進(jìn)展。
3.4促進(jìn)腫瘤血管生成 一些研究表明,TAMs水平與腫瘤中血管數(shù)量密切相關(guān)。低氧是腫瘤血管生成的主要驅(qū)動(dòng)因素。腫瘤低氧區(qū)域,特別是壞死組織發(fā)現(xiàn)巨噬細(xì)胞大量聚集。巨噬細(xì)胞上HIF-1的表達(dá)調(diào)控多種基因的轉(zhuǎn)錄,如調(diào)控VEGF在腫瘤缺氧部位的血管生成。基因分析結(jié)果顯示,TAMs可以產(chǎn)生VEGF、TNF-α、IL-1β、IL-8 (CXCL8)、PDGF、bFGF、胸苷醛糖、MMPs和其他分子,參與腫瘤血管生成,為腫瘤的生長(zhǎng)提供營養(yǎng)[44]。在原位和轉(zhuǎn)基因腫瘤模型中發(fā)現(xiàn),Tie2+TAMs與腫瘤血管系統(tǒng)密切相關(guān),促進(jìn)血管生成,且依賴于內(nèi)皮細(xì)胞產(chǎn)生的血管生成素-2和沿血管系統(tǒng)分布的TAMs上Tie2受體的表達(dá)[45]。
4 TAMs作為腫瘤治療的靶點(diǎn)
如上所述,在不同的癌癥模型中TAMs促進(jìn)腫瘤生長(zhǎng),TAMs數(shù)量的增加與多種腫瘤的不良預(yù)后密切相關(guān)。因此,靶向TAMs是一種新的癌癥治療策略,包括限制單核細(xì)胞招募、靶向TAMs活化、重編程TAMs為抗腫瘤活性及靶向TAMs與標(biāo)準(zhǔn)治療聯(lián)合應(yīng)用四個(gè)方面(圖1)。
4.1限制單核細(xì)胞招募 靶向TAMs的策略之一是阻斷單核細(xì)胞向腫瘤組織趨化。由于CCL2/CCR2軸在單核細(xì)胞招募過程中起著重要作用,因此靶向該通路是非常有效的腫瘤治療方法。CCL2阻斷劑(carlumab,CNTO88)在動(dòng)物模型中已被證明可以抑制多種腫瘤的生長(zhǎng)。一項(xiàng)針對(duì)轉(zhuǎn)移性去勢(shì)難治性前列腺癌的Ⅱ期臨床試驗(yàn)研究顯示,雖然carlumab抗體耐受性良好,但是單一應(yīng)用該抗體既無法阻斷CCL2/CCR2軸,也沒有顯示抗腫瘤活性(NCT00992186)[46]。Brana等人的研究結(jié)果與之類似,carlumab聯(lián)合四種化療方案治療實(shí)體瘤,患者耐受性良好,但未觀察到血清中CCL2的下調(diào)及明顯的腫瘤消退反應(yīng)(NCT01204996)。然而,其他研究結(jié)果表明,應(yīng)用carlumab抗體患者耐受性良好,并出現(xiàn)短暫的CCL2抑制及初步的抗腫瘤活性反應(yīng)(NCT00537368)[47]。
Sanford等人研究發(fā)現(xiàn),CCR2拮抗劑(PF-04136309)可阻斷CCR2+單核細(xì)胞從骨髓向腫瘤部位募集,抑制胰腺癌生長(zhǎng)和遠(yuǎn)處轉(zhuǎn)移[48]。一項(xiàng)Ⅰb期臨床試驗(yàn)研究應(yīng)用PF-04136309聯(lián)合FOLFIRINOX化療方案治療腫瘤(NCT01413022),結(jié)果顯示該療法安全且耐受性強(qiáng),并具有一定的腫瘤客觀反應(yīng)率[49]。此外,CCR2特異性人源化抗體(MLN1202)的有效性在臨床試驗(yàn)研究中得到了證實(shí)(NCT01015560)。
CD11b中和單克隆抗體已被證明可以有效防止髓系細(xì)胞向腫瘤部位募集。已有研究表明,應(yīng)用Mac-1(CD11b/CD18)抗體可以改善小鼠鱗狀細(xì)胞癌異種移植瘤的放療反應(yīng),并可減少表達(dá)MMP-9和S100A8髓系細(xì)胞的瘤內(nèi)浸潤[50]。
4.2靶向TAMs活化 使用不同策略靶向TAMs活化亦是有效的腫瘤治療方法。CSF1/CSF1R信號(hào)通路在骨髓單核細(xì)胞的產(chǎn)生和腫瘤組織中TAMs極化方面起著關(guān)鍵作用。因此,CSF1/CSF1R信號(hào)通路是一種具有廣闊前景的癌癥治療靶點(diǎn)。動(dòng)物模型研究發(fā)現(xiàn),CSF1基因缺失可顯著降低乳腺癌和神經(jīng)內(nèi)分泌瘤的轉(zhuǎn)移及延緩腫瘤進(jìn)展[51]。基于以上結(jié)果,多項(xiàng)應(yīng)用CSF1/CSF1R抑制劑的臨床試驗(yàn)研究已經(jīng)完成或正在進(jìn)行。
巨噬細(xì)胞表面標(biāo)志物可作為有效的治療靶點(diǎn)。甘露糖受體CD206可看作巨噬細(xì)胞特異性靶點(diǎn)。與CD206受體結(jié)合的單鏈肽被連接到納米載體上,選擇性靶向CD206+TAMs[52]。Legumain是一種應(yīng)激蛋白,屬于天冬酰胺內(nèi)肽酶家族成員,其在TAMs中過表達(dá),可作為一種有效的治療靶點(diǎn)[53]。利用免疫毒素結(jié)合的單克隆抗體靶向巨噬細(xì)胞表面標(biāo)志物清道夫受體A和CD52,已在卵巢癌中進(jìn)行了研究[54]。此外,alemtuzumab(抗CD52抗體)治療腫瘤的研究正在進(jìn)行臨床試驗(yàn)(NCT00637390,NCT00073879)。
Trabectedin(ET743,Yondelis)通過誘導(dǎo)單核巨噬細(xì)胞的凋亡來減少腫瘤組織中TAMs的數(shù)量[55,56]。目前,trabectedin已獲得歐盟委員會(huì)的上市批準(zhǔn),用于治療卵巢癌和軟組織肉瘤,并在2015年獲FDA批準(zhǔn)用于治療不可切除的轉(zhuǎn)移性脂肪肉瘤或平滑肌肉瘤[57]。
4.3重編程TAMs為抗腫瘤活性 如前所述,巨噬細(xì)胞的關(guān)鍵特征之一是具有可塑性,這使得其能夠根據(jù)腫瘤微環(huán)境的不同改變表型。因此,將TAMs重編程為抗腫瘤表型是一種非常具有潛力的腫瘤治療策略。抗腫瘤巨噬細(xì)胞(M1型)具有良好的清除和破壞腫瘤細(xì)胞的能力[58]。我們前期研究結(jié)果顯示,銅綠假單胞菌在治療惡性胸腔積液過程中,可以將CD163+TAMs極化為M1型巨噬細(xì)胞,提示重編程CD163+TAMs可作為惡性胸腔積液潛在的治療策略[59]。
目前,納米顆粒逐漸被應(yīng)用于極化TAMs為抗腫瘤表型的方法。Zanganeh等[60]發(fā)現(xiàn)納米氧化鐵(ferumoxytol)能顯著抑制小鼠皮下腺癌的生長(zhǎng),并伴有腫瘤組織中M1型巨噬細(xì)胞的增加。二氧化錳納米顆粒通過誘導(dǎo)TAMs極化為M1型巨噬細(xì)胞,從而增強(qiáng)化療反應(yīng)[61]。負(fù)載IL-12的納米顆粒可以逆轉(zhuǎn)巨噬細(xì)胞具備抗腫瘤功能[62]。
CD40是巨噬細(xì)胞表面標(biāo)記物,CD40激動(dòng)劑與吉西他濱聯(lián)合應(yīng)用治療不可切除的胰腺癌,結(jié)果發(fā)現(xiàn)該方法通過增強(qiáng)抗腫瘤巨噬細(xì)胞的功能,促使腫瘤消退[63]。ChiLob7/4是嵌合CD40單克隆抗體,能夠誘導(dǎo)巨噬細(xì)胞促炎性細(xì)胞因子的產(chǎn)生,一項(xiàng)針對(duì)常規(guī)治療耐藥的表達(dá)CD40實(shí)體瘤和彌漫大B淋巴瘤的Ⅰ期臨床試驗(yàn)研究結(jié)果顯示,該療法具有廣闊的應(yīng)用前景[64](NCT01561911)。靶向CD40分子的其他臨床試驗(yàn)研究目前正在進(jìn)行中(NCT01103635)。
應(yīng)用TLR激動(dòng)劑、抗CD40抗體和IL-10抗體通過激活NF-κB信號(hào)通路,極化TAMs為抗腫瘤表型[65]。一種STAT3小分子抑制劑(WP1066)可以逆轉(zhuǎn)惡性腦膠質(zhì)瘤患者的免疫耐受,選擇性誘導(dǎo)共刺激分子CD80、CD86和IL-12在外周血和腫瘤浸潤的巨噬細(xì)胞上的表達(dá),誘導(dǎo)巨噬細(xì)胞向抗腫瘤表型極化[66]。目前一項(xiàng)臨床試驗(yàn)正在研究這種藥物治療復(fù)發(fā)性惡性腦膠質(zhì)瘤及轉(zhuǎn)移(NCT01904123)。
Thymosin-α是一種免疫調(diào)節(jié)激素,可以再教育TAMs為樹突狀細(xì)胞,產(chǎn)生高水平的促炎性細(xì)胞因子,參與抗腫瘤免疫反應(yīng)。此外,一些臨床試驗(yàn)研究已證實(shí),Thymosin-α可以延長(zhǎng)轉(zhuǎn)移性黑色素瘤和進(jìn)展期非小細(xì)胞肺癌患者的生存期[67]。
β-glucan是一種酵母來源的多聚糖,可以極化TAMs為M1型巨噬細(xì)胞,是一種強(qiáng)有力的抗腫瘤免疫調(diào)節(jié)劑[68]。在一項(xiàng)Ⅱ期臨床試驗(yàn)研究中,應(yīng)用β-glucan聚合物(PGG)顯示出適當(dāng)?shù)目鼓[瘤活性[69](NCT00912327)。
4.4靶向TAMs與標(biāo)準(zhǔn)治療聯(lián)合應(yīng)用 放療和化療是許多癌癥的有效治療方法。研究表明放療后腫瘤組織中髓系細(xì)胞浸潤增加。然而,放化療后腫瘤細(xì)胞和基質(zhì)細(xì)胞之間的相互作用仍不明確。在動(dòng)物模型中發(fā)現(xiàn),放療后腫瘤DNA受損、細(xì)胞凋亡及缺氧增加,可導(dǎo)致巨噬細(xì)胞的招募及促進(jìn)腫瘤進(jìn)展[70]。更引人注目的是,阻斷CSF1R信號(hào)通路增強(qiáng)了其他幾種標(biāo)準(zhǔn)療法的療效,CSF1R的阻斷已被證明可提高化療對(duì)胰腺癌的療效[71]。因此,認(rèn)為靶向TAMs治療與標(biāo)準(zhǔn)治療相結(jié)合是腫瘤有效的治療手段。
5 結(jié)語
本文就TAMs的起源、極化、功能及臨床應(yīng)用方面進(jìn)行了闡述。TAMs在腫瘤的發(fā)生發(fā)展過程中起著關(guān)鍵作用。因此,更好地了解TAMs在臨床上的應(yīng)用,尤其是作為腫瘤治療的靶點(diǎn)將是至關(guān)重要的。靶向TAMs是一種很有前途的腫瘤治療策略。近期正在進(jìn)行的關(guān)于TAMs的體內(nèi)外實(shí)驗(yàn)、臨床前和臨床試驗(yàn)研究均顯示了令人鼓舞的結(jié)果。我們相信,未來靶向TAMs將會(huì)應(yīng)用于腫瘤患者的治療。

