細胞焦亡研究進展①
黃清宇 杜楚江 張雨竹 曹宏偉 郝慧芳
(內蒙古大學生命科學學院,呼和浩特 010021)
細胞死亡在機體發育、維持內環境穩態和疾病的發生發展過程中起關鍵作用,人們對細胞死亡的認識經歷了一個漫長的過程,隨著研究的不斷深入細化,基于不同的劃分標準,細胞死亡也有多種不同的種類。程序性細胞死亡方式(programmed cell death,PCD)可以分為裂解性細胞死亡和非裂解性細胞死亡[1], 細胞凋亡(apoptosis)是非裂解性死亡的形式,不會引起炎癥反應的發生[2]。壞死性凋亡(necroptosis)和細胞焦亡(pyroptosis)屬于裂解性細胞死亡的類型,這兩種死亡使得細胞內含物外漏,引起炎癥反應,因此稱為炎癥性死亡[3,4]。除此之外,關于細胞死亡的研究還在不斷地進行,如近些年研究發現的新型細胞壞死方式——鐵死亡(ferroptosis)[5]。研究細胞死亡的機制可為一些疾病的基礎研究和臨床治療提供新的思路。
細胞焦亡是最近幾年新發現的一種細胞程序性死亡的方式,是機體中主要的非特異性防御機制,在拮抗外部病原體入侵和感知內源危險信號中發揮著不可替代的作用。本文就近年來細胞焦亡的發現和命名、形態學和分子特征、分子機制和焦亡相關的疾病進行綜述。
1 細胞焦亡的發現和命名
早在1992年,Zychlinsky等[6]在實驗中觀察到弗氏志賀菌可誘導感染的宿主巨噬細胞發生裂解性死亡。這種裂解性死亡的形式具有細胞凋亡的部分特征,例如染色質凝集、DNA斷裂及有半胱氨酸蛋白酶(Caspase)活性依賴性,因此,最初這種死亡方式被認為是凋亡。2001年,華盛頓大學學者Cookson等[7]研究表明,該死亡形式具有Caspase-1活性依賴性,而不同于Caspase-3活性依賴的細胞凋亡。他們首次將細胞焦亡定義為Caspase-1依賴的細胞死亡的形式。“pyro”是火的意思,表明這種程序性細胞死亡引起炎癥反應,而“ptosis”是落下的意思,表明其程序性死亡的本質。2014,2015年邵峰院士研究團隊發現細胞焦亡還可以由胞質內LPS對Caspase-4/5/11激活所引起,活化的Caspase-4/5/11通過對Gasdermin家族蛋白的切割最終誘發細胞焦亡。因此,他們把細胞焦亡定義為Gasdermin家族介導的細胞程序性壞死[8,9]。
2 細胞焦亡的形態學和分子特征
2.1細胞凋亡與細胞焦亡 長期以來,人們一直認為細胞凋亡是唯一的細胞程序性死亡方式,對其形態學特征及分子機制已經有了一個較深入、完善的了解。細胞凋亡起始表現為細胞表面的微絨毛等特化結構逐漸消失,細胞皺縮并與周圍細胞分離,胞質和核染色質固縮,在細胞內特異性核酸內切酶作用下,核染色質斷裂降解為約180~200 bp或其整數倍核苷酸小片段,直到后期凋亡細胞的內容物包裹細胞質膜形成凋亡小體,被附近的間質細胞或巨噬細胞吞噬。在此期間細胞膜保持一定的完整性,故不引發炎癥反應。將凋亡細胞中的DNA提取出來經過瓊脂糖凝膠電泳,會呈現出梯狀條帶,即DNA ladders,用轉移酶介導的dUTP缺口末端標記測定法(TdT-mediated dUTP nick-end labeling,TUNEL)和對翻轉到細胞外側的磷脂酰絲氨酸敏感的Annexin V檢測,呈現出染色陽性[10,11],如表1所示。
細胞焦亡在形態學上兼具細胞壞死和凋亡的部分特點,細胞發生焦亡時,細胞核濃縮、染色質DNA隨機斷裂降解,細胞膜上出現眾多孔隙,細胞膜失去調控物質進出的能力,細胞喪失內外離子平衡,發生滲透性腫脹進而膜破裂,釋放出細胞內容物等活性物質,激發機體的免疫反應,募集更多的炎癥細胞,并擴大了炎癥反應。經過TUNEL和Annexin V染色呈現陽性[1,3],如表1所示。
2.2細胞焦亡的分子特征
2.2.1Caspase家族 半胱天冬酶(Caspase)家族是細胞質中具同源性、相似結構特征的蛋白水解酶,可在下游靶蛋白天冬氨酸殘基后的肽鍵進行有選擇地識別切割。在正常的細胞中,Caspase蛋白通常都是以沒有活性的酶原狀態(Pro-caspase)存在,氨基酸序列水解后變為有活性的Caspase才能發揮其作用。至今為止,在哺乳動物中已經得到證實有15種Caspase家族成員,在人類中已經發現了13種Caspase,在小鼠中有11種Caspase[12]。根據結構和功能的差異,Caspase可以分成凋亡類和炎性類兩種。其中凋亡Caspase包括Caspase-2/3/6/7/8/9/10,以Caspase-3為代表,與細胞凋亡有關;炎性 Caspase包括Caspase-1/4/5/11/12/13/14,介導炎癥反應[13,14]。炎性Caspase-1和Caspase-4/5/11的激活最終引發了細胞焦亡的發生,其發生的具體分子機制將在下一部分詳細講述。
2.2.2Gasdermin家族 Gasdermins是功能多樣的蛋白質家族,在多種細胞類型和組織中表達,人類Gasdermins由Gasdermin A(GSDMA)、Gasdermin B(GSDMB)、Gasdermin C(GSDMC)、Gasdermin D(GSDMD)、Gasdermin E(GSDME,又稱DFNA5)和Pejvakin(PJVK,又稱DFNB59)組成[15]。除PJVK外,所有Gasdermins均有保守的雙結構域排列:C-末端結構域(GSDM-C)和N-末端結構域(GSDM-N),N末端具有成孔活性,具有誘導細胞發生焦亡的特征[16,17]。
GSDMA、GSDMB主要在食道、腸道細胞中表達,與脫發、哮喘及炎癥疾病等相關。人類GSDMC蛋白在胃、食管、脾的上皮細胞中表達,在胃癌等癌癥細胞中被抑制,生物學功能尚在研究[18]。GSDMD、GSDME廣泛表達于不同細胞組織,GSDMD可被炎性Caspase-1、4、5、11特異性激活,切割成GSDMD-N(p30片段)和GSDMD-C(p20片段),GSDMD-C存在于胞質中,GSDMD-N具有親脂特性,與細胞膜內側的磷脂酰肌醇、細菌質膜外側的心磷脂特異性結合,在膜中寡聚化并形成直徑為10~16 nm的孔[19],通過該孔分泌較小直徑的底物,最終導致膜破裂,釋放出整個細胞內容物[20]。GSDME在受到化療藥物、腫瘤壞死因子(tumor necrosis factor,TNF)和病毒感染刺激時,可被凋亡信號通路的Caspase-3活化,對細胞膜打孔,將本應發生凋亡的細胞轉化為焦亡[21,22]。通常GSDME會在正常細胞中高水平表達,而癌細胞經過DNA甲基化和組蛋白等表觀遺傳修飾[23],多數處于GSDME抑制表達或低水平表達狀態,在“凋亡刺激”下,高表達GSDME的正常細胞發生焦亡可能是常規化療藥物產生毒副作用的原因之一。
表1 凋亡和焦亡的特征
Tab.1 Features of apoptosis and pyroptosis

FeaturesApoptosisPyroptosisCell morphological featuresThe cells shrink and become smallerThe cells develop osmotic swelling, become larger, and eventual lysisChanges in plasma membraneThe plasma membrane remained largely intact until it became apoptotic bodiesThe integrity of the membrane is lost, and pores form in the plasma membraneChanges in chromosomesChromatin DNA is cleaved to approximately 180-200 bp or its integer nucleotide fragmentsRandom fragmentation of chromatin DNA occursInflammatory reactionThere is no intracellular content release and no in-flammatory responseThe proinflammatory intracellular contents release and cause a cascade of amplified inflammatory re-sponses
3 細胞焦亡的機制研究
當微生物外源或內源性感染宿主細胞時,位于胞質內的模式識別受體(pattern recognition receptor,PRR)經由病原體相關分子模式(pathogen-associated molecular pattern,PAMP)和損傷相關分子模式(damage-associated molecular pattern,DAMP)進行識別并結合相應配體,組裝形成胞漿內的多蛋白復合物,激活炎性Caspase-1和Caspase-4/5/11而進一步切割GSDMD蛋白對細胞膜進行打孔,促進細胞焦亡的發生。同時炎性小體作用于下游分子,促進炎癥細胞因子(如IL-1β、IL-18、IL-6等)、趨化因子、黏附分子等的成熟并通過破裂的細胞膜釋放到細胞外,募集并激活更多炎癥細胞,放大局部和全身的炎癥反應[4]。現有的研究表明,焦亡的激活途徑分為由炎癥小體激活Caspase-1的經典細胞焦亡途徑和被胞質脂多糖(lipopolysaccharide,LPS)激活Caspase-4/5/11的非經典細胞焦亡途徑。
3.1經典細胞焦亡途徑
3.1.1炎性小體 炎性小體(inflammasome)是一類多蛋白復合物,主要類型包括NLRP3、NLRP1、NLRC4、AIM2等,其概念在2002年由Tschopp實驗室[24]首次提出,可在宿主天然免疫反應中識別多種外源或內源性入侵的微生物、刺激性和損傷信號,與細胞死亡有密切的關系。炎性小體的基本結構主要有PRRs、凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和pro-caspase-1(CASP1)三部分[25,26]。其中,PRRs識別危險信號分子,細胞受到不同的信號刺激,相應的炎性小體會通過各種激活方式被激活發揮作用。ASC接頭蛋白分子可通過其同源蛋白互作結構域PYD(pyrin domain,PYD)和C端半胱天冬酶募集域(C-terminal caspase recruitment domain,CARD)的寡聚化來募集上下游的PRRs和Pro-caspase-1,組裝成炎性小體進行下游的信號轉導。ASC不是NLRP1和NLRC4組裝炎性小體的必要結構,但在一定程度上可以協助NLRP1和NLRC4易于Caspase-1的活化[27]。Caspase-1作為效應分子,在細胞中以無活性的酶原狀態Pro-caspase-1存在,被ASC招募激活,活化的Caspase-1剪切促炎因子前體Pro-IL-1β和Pro-IL-18,促進IL-1β和IL-18的成熟與釋放,招募更多的炎癥細胞聚集,擴大炎癥反應,提高機體先天性免疫防御能力,達到保護宿主細胞的目的[28]。
NLRP3是目前為止研究最深入的炎性體,由PYD、核苷酸結合寡聚化結構域(nucleotide binding oligomerization domain,NOD),亮氨酸富集重復序列(leucine-rich repeats,LRR)和CARD結構域構成,可被大多數病毒、細菌、真菌的DNA或RNA、細菌穿孔素、紫外線等外源性危險信號分子和ATP、晶體等內源性危險信號分子所激活[29-31],在該過程中,NEK7作為一種與有絲分裂紡錘體形成和中心體分離密切相關的重要蛋白質,能夠調節平衡細胞分裂和炎性體活性,可激活NLRP3以應答經典和非經典刺激。NLRP1是第一個被報道可形成炎性復合物的NOD樣受體(NLRs),人類僅具有一種NLRP1蛋白,但小鼠NLRP1蛋白具有多態性,編碼3個旁系同源物:NLRP1a,1b和1c。人NLRP1含有N末端PYD,NOD,LRR,FIIND結構域(domain with function to find,FIIND)和C末端的CARD結構域,而小鼠NLRP1分子缺乏PYD[29]。在FIIND結構域的自蛋白水解作用下,含有保護性抗原和致死因子的炭疽芽孢桿菌毒素可通過N-末端接頭區域誘導激活NLRP1炎性體,通過ASC依賴性募集激活Caspase-1形成炎性體復合物或通過CARD-CARD相互作用與Caspase-1直接結合。 NLRC4的初步研究表明其與凋亡蛋白酶激活因子(APAF1)有一定的相似性,包含LRR、NOD、CARD結構域[32],主要受革蘭氏陰性菌的刺激而激活,致病菌如傷寒沙門氏菌亞種T3SS將效應蛋白釋放到細胞溶膠中,這些致病相關蛋白被NAIPs家族識別,再進一步招募NLRC4來組裝形成炎癥小體復合物。AIM2是雙鏈DNA(dsDNA)的細胞溶質受體,由PYD和具有200個氨基酸重復的結構域(HIN200)組成[29,33],HIN結構域的帶正電荷的表面與DNA結合,PYD募集ASC以組裝炎性體復合物。
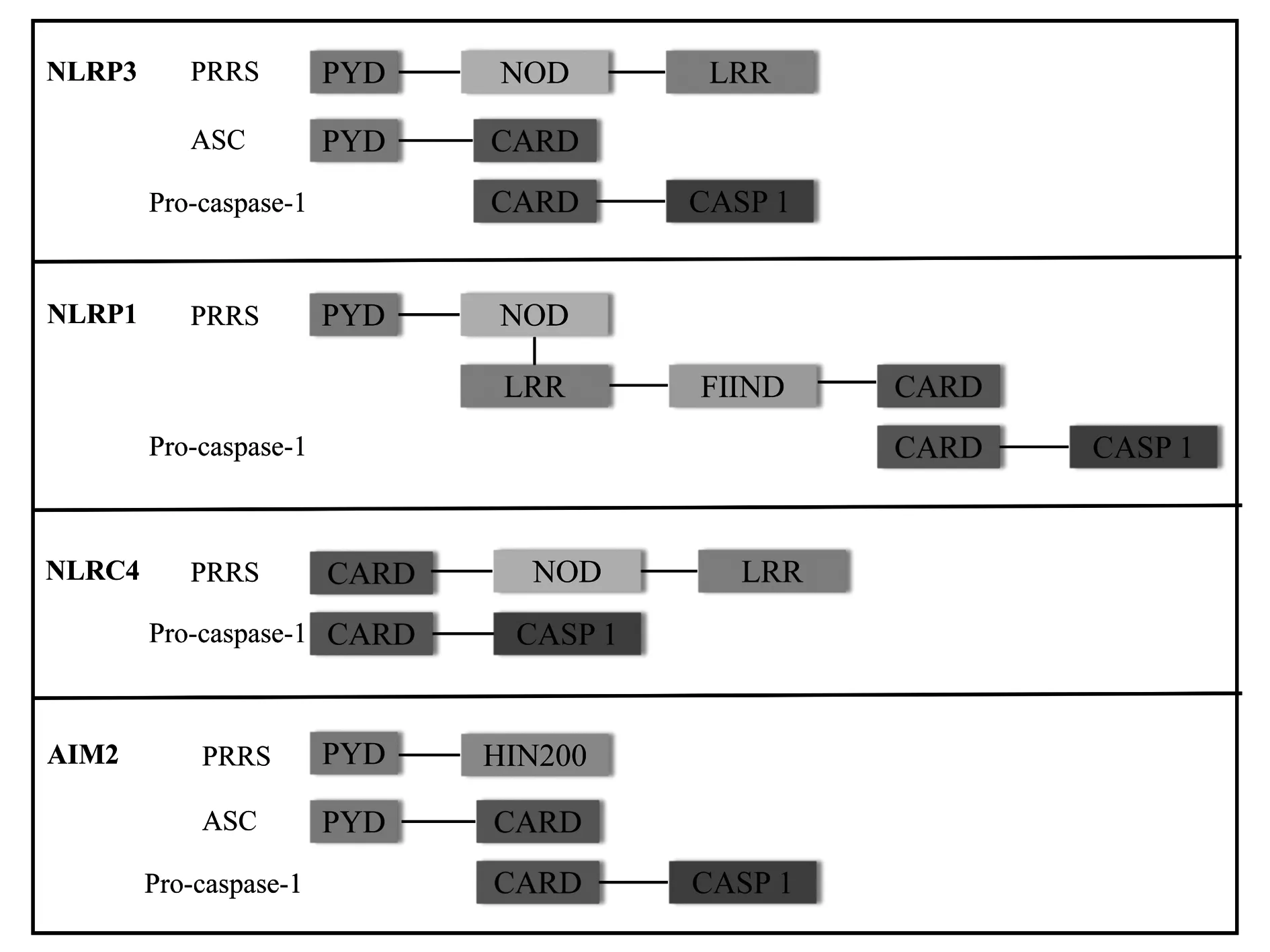
圖1 炎性小體結構示意圖Fig.1 Structure schematic diagram of inflammasomes
3.1.2炎性小體激活經典細胞焦亡通路 經典細胞焦亡途徑的激活主要依賴于PRRs接受危險信號分子刺激,通過ASC招募Pro-caspase-1組裝形成炎性小體,激活Caspase-1分子進一步切割下游GSDMD目的蛋白,促進細胞焦亡的發生。新的研究表明,GSDMD蛋白是炎性 Caspase的共同底物,是細胞焦亡的效應執行蛋白,形象地被稱為“殺手蛋白”,在兩條焦亡通路中均扮演著關鍵的角色。在細胞內環境中,GSDMD蛋白存在于細胞質中,可接受經典焦亡途徑中被激活的Caspase-1和非經典焦亡途徑中被激活的Caspase-4/5/11刺激,在特定位點將GSDMD蛋白分割成親脂性N端結構域和親水性C端結構域,其中N端結構域可與生物膜結合,在膜內側聚集形成孔道,水分子侵入細胞,觸發細胞焦亡[34],如圖2所示。炎性小體的激活和GSDMD蛋白在細胞焦亡中起著十分重要的作用,其具體的激活信號通路之間并不是獨立發揮作用,而是相互聯系和影響,其過程還有待深入研究。
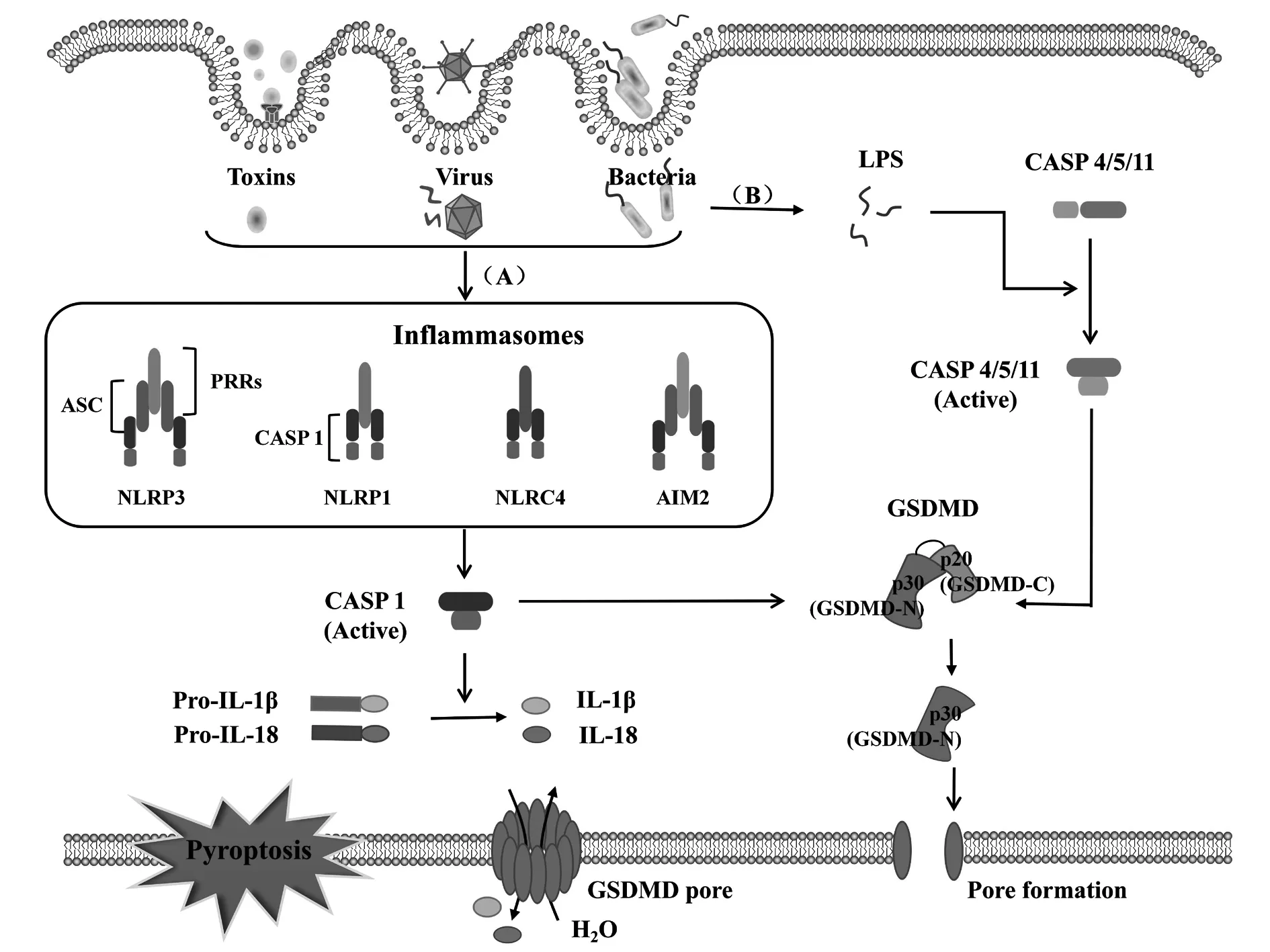
圖2 經典焦亡途徑與非經典焦亡途徑Fig.2 Canonical pyroptosis pathway and noncanonical pyroptosis pathway
3.2非經典細胞焦亡途徑 大量研究發現,細胞中還存在非依賴Caspase-1的細胞焦亡途徑,與經典途徑不同,非經典焦亡途徑依賴于Caspase-4/5/11的激活。在受到胞質內LPS刺激后,小鼠Caspase-11和它的人類對應物Caspase-4/5可與LPS的保守結構脂質A直接結合被激活,活化的Caspase-4/5/11進一步切割GSDMD蛋白并促進細胞焦亡的發生[35,36],如圖2所示。隨著研究的不斷深入細化,一些新的分子機制逐漸被發現。Pannexin-1是細胞膜上的通道蛋白,控制小分子物質進出,在非經典焦亡LPS進行免疫應答的過程中發揮重要作用,Caspase-11的激活會導致Pannexin-1蛋白斷裂形成通路,將ATP釋放到細胞外,當P2X7受體受到ATP長期反復的刺激時,P2X7通道開放使K+、Na+、Ca2+外流,打破細胞膜內外離子平衡,細胞發生滲透性腫脹進而膜破裂,最終導致細胞死亡[37]。
4 相關疾病與展望
大量研究和數據表明細胞焦亡普遍涉及感染性疾病、神經性疾病、動脈粥樣硬化、自身免疫性等多種疾病的發生轉歸過程中,并且在癌癥的發展進程中也發揮重要作用。早期細胞焦亡的發現和初步研究都是建立在細菌感染的模型基礎上,在弗氏志賀氏桿菌、李斯特桿菌等細菌被證實可誘導細胞發生焦亡后[38-41],近年來也接連驗證了肺炎鏈球菌[42]、耐藥性金黃色葡萄球菌[43]及免疫缺陷類病毒[44]等感染機體可激活Caspase-1,并誘導發生細胞焦亡,引發多種感染性疾病。近年來神經系統疾病的研究中也發現腦缺血、腦損傷、帕金森癥、阿爾茲海默癥等疾病均與Caspase-1介導的經典細胞焦亡有關,涉及IL-1β和IL-18的表達升高和炎癥反應的發生[45]。研究已經證實,通過沉默NLRP1或阻斷Caspase-1的信號轉導可以對疾病的發生發展起明顯的抑制作用,因此認為Caspase-1是感染性和神經系統疾病的重要靶點。細胞焦亡在動脈粥樣硬化(atherosclerosis,AS)和動脈粥樣硬化斑塊的形成中起促進作用,體外實驗驗證了[46]血漿中氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)可以引起細胞中脂質堆積沉降,促使巨噬細胞膽固醇化,激活NLRP3釋放Caspase-1分子誘導細胞焦亡發生,引發并放大炎癥反應的同時加速了動脈粥樣硬化,若對NLRP3進行基因沉默阻斷其信號途徑,可使病情得到控制,起保護作用。當宿主免疫系統應答出現異常時,細胞焦亡引起的炎癥級聯反應吸引更多的免疫細胞到這一區域,引起惡性循環造成對免疫系統嚴重的破壞,引發類風濕性關節炎、系統性紅斑狼瘡(SLE)等自身免疫性疾病,相關研究表明通過抑制相應病原體激活的炎癥小體,可使Caspase-1表達下調,降低IL-1β和IL-18的血清表達水平,有效改善疾病的惡化情況[47,48]。一直以來,以艾滋病為首的免疫系統缺陷類疾病都沒有有效的治療方案,如何抑制受感染的T細胞發生焦亡并提高機體免疫力會對這類疾病的預防和治療提供新的思路和更有效的方法。Gasdermins家族蛋白廣泛參與到肝癌、胃癌、乳腺癌等多種腫瘤的發生發展中,研究人員指出GSDME誘導細胞焦亡具有可調性[19-21],針對腫瘤細胞的免疫原性可采用特異性的藥物進行治療,為化療耐藥提供了新思路,更具體的作用機制和怎樣提高治療效果并減少對患者的毒副作用亟待更深入細致的研究。
焦亡是一種新的程序性炎癥死亡,其經典通路由Caspase-1依賴性介導,通過炎性小體和Caspase-1的結合、激活、釋放細胞內容物,非經典炎性體通路由Caspase-4/5/11介導,通過LPS激活Caspase-4/5/11誘發細胞焦亡[49]。炎性體生物學處于不斷發展中,細胞死亡的機制擴展了關于炎性體的現有知識。然而,還有許多模式識別受體的功能和特異性配體仍然未知,PRRs激活和細胞穩態之間的相互作用及其對生理功能的影響仍在研究中,了解受體激活機制和配體識別的受體結構對于設計新的免疫療法將是至關重要的。細胞焦亡作為機體天然免疫反應理論研究、多種炎癥和免疫性相關疾病的模型逐漸成為科研工作者們關注的焦點,與機制研究較為完整的細胞凋亡相比,還存在很多尚未闡明的關鍵科學問題。細胞焦亡作為一種病理性的細胞主動裂解性死亡方式,一方面,焦亡的發生有助于消除病原體并防止感染,另一方面,過量的Caspase激活可導致級聯炎癥反應。細胞焦亡與多種疾病的發生發展密切相關,進一步研究Gasdermins家族的調控機制與相關疾病發生轉歸的關系,將對疾病的預防診斷、臨床新型藥物的研發提供更直接有效的幫助。

