小龍蝦腸道產纖維素酶細菌的分離與鑒定
馮光志 石慧 劉博 吳玉婷 王月琳 石玉
(武漢設計工程學院食品與生物科技學院,武漢 430205)
纖維素生物質是地球上最豐富的可再生資源之一[1]。我國擁有豐富的纖維素資源,但因不能得到及時有效的利用,不僅造成了資源浪費,也給自然環境帶來了巨大威脅[2]。纖維素酶屬于一種多酶復合體,主要包括內切葡聚糖酶(Endoglucanase,EG),外切 β-1,4-葡聚糖酶(Exglucanase,CBH)和β-1,4-葡聚糖酶(β-glucosidase,簡稱 BG)3種,只有和組分酶共同作用時才能將纖維素徹底水解為葡萄糖并應用于工業生產[3]。通過微生物產酶降解纖維素具有反應條件溫和,無污染等優點[4]。目前,從自然界中獲取的纖維素降解菌,由于其酶產量、酶穩定性、酶系組成和酶的催化效率等因素限制,應用于工業生產的菌株非常有限,纖維素酶的生產遠遠不能滿足工業的需求。
克氏原螯蝦(Procambarus clarkii),俗稱小龍蝦,屬甲殼綱(Crustacea)、十足目(Decapoda)、蝲蛄科(Cambaridae)、原螯蝦屬(Procambarus)動物[5]。目前,小龍蝦養殖產業飛速發展,由最初的養殖和簡單的加工出口不斷發展完善,成為集育苗、養殖、加工、餐飲、銷售、休閑旅游、文化等為一體的綜合產業。然而,小龍蝦養殖大都仍采用玉米、小麥、野雜魚等天然餌料或其他蝦蟹飼料替代以及一些人工配合飼料產品,存在飼料利用率低,糞便污染養殖環境,小龍蝦生長性能低下等問題。從小龍蝦腸道中分離高產纖維素酶的土著細菌,制備小龍蝦腸道微生物源微生物制劑,開發小龍蝦專屬功能飼料已迫在眉睫。小龍蝦為雜食性動物,在天然條件下主要攝食有機物碎屑、藻類、水生植物的根、葉及碎片,特別喜食汁多肥嫩的綠色植物,如水浮蓮、綠萍和水葫蘆等,可見小龍蝦具有很強的纖維素降解能力。小龍蝦腸道微生物是小龍蝦降解纖維素和半纖維素的主要驅動力。因此,在小龍蝦腸道內有望篩選到高產纖維素酶的優良菌株,服務于小龍蝦飼料產業。
目前,國內外對克氏原螯蝦的研究主要集中于其行為學[6-7]、種群結構與分布[8-9]及疾病與免疫方面[10-12],對營養飼料方面的研究也主要集中在蛋白質、脂肪等方面[13],而對于小龍蝦腸道細菌的相關研究卻鮮有報道。本研究采用純培養法,從小龍蝦腸道中分離篩選產纖維素酶的細菌,進行形態學和分子生物學初步鑒定,對高活性菌株進行基因組掃描分析,一方面期望獲得全新的高產纖維素酶的優良菌株以及基因資源;另一方面,也為研究小龍蝦腸道菌群結構和纖維素的降解機制提供理論支撐,為創制新型小龍蝦飼料開辟新途徑。
1 材料與方法
1.1 材料
1.1.1 小龍蝦取自本校小龍蝦養殖基地蝦池。養殖基地位于湖北省武漢市湯遜湖旁,共有8個10 m×5 m的蝦池。投喂飼料購自湖北渴望牧業有限責任公司,扶龍牌龍蝦配合飼料。
1.1.2 主要試劑和儀器以及培養基 羧甲基纖維素鈉,國藥集團化學試劑有限公司;2×TaqMasterMix,北京寶日醫生物技術有限公司;PCR 儀,Bio-Rad公司。LB培養基:胰蛋白胨10 g,NaCl 10 g,酵母抽提物5 g,溶于1 L雙蒸水中,固體培養基加入瓊脂粉15 g,1×105Pa滅菌20 min。篩選培養基(g/L):胰蛋白胨2.0,NaCl 2.0,酵母抽提物1.0,pH 7.0,瓊脂粉15.0,羧甲基纖維素鈉 10.0,1×105Pa滅菌20 min。
1.2 方法
1.2.1 產纖維素酶菌的篩選 選取10只小龍蝦,用70%酒精、無菌水依次清洗體表。拉出整個腸道,放于無菌離心管中。用滅菌的勻漿棒冰上勻漿,充分勻漿后的液體即為小龍蝦全腸菌懸液。將小龍蝦全腸菌懸液稀釋涂平板,梯度從10-2-10-7,每個梯度涂兩個平行。在28℃的恒溫箱中進行倒置培養2 d。將LB培養基上長出的菌分類標記后,用牙簽點在添加1%羧甲基纖維素鈉的篩選培養基上,28℃的恒溫箱中倒置培養24 h。用沾了酒精的紙板輕輕刮去培養基表面的菌體,剛果紅染色15 min,NaCl脫色30 min,觀察水解圈的形成。將有水解圈的菌落在篩選培養基的平板上進行分離純化。記錄水解圈直徑和菌落直徑大小,并將純化的菌種-80℃甘油保藏。
1.2.2 菌株的形態學鑒定 對所篩選的菌株13和菌株33分別進行菌落形態觀察和顯微觀察,進行革蘭氏染色和芽孢染色。參照《伯杰細菌鑒定手冊》和《常見細菌系統鑒定手冊》初步判斷所篩選菌株的科屬。
1.2.3 菌株的分子生物學鑒定 采用細菌通用引物27F和1492R進行16S rRNA基因 PCR擴增[14]。PCR結束后,進行瓊脂糖凝膠電泳檢測PCR擴增結果,送至上海桑尼生物科技有限公司測序。
1.2.4 菌株33基因組掃描測序 提取菌株33基因組DNA,采用 Illumina Hiseq 4000 測序技術完成菌株的基因組掃描測序,構建 Illumina PE 文庫(300 bp-500 bp文庫),對獲得的測序數據進行質控后利用生物信息學分析手段完成菌株碳水化合物相關酶基因掃描。
2 結果
2.1 小龍蝦腸道產纖維素酶細菌的分離與篩選
在篩選培養基平板中,菌株能夠利用培養基中的營養物質進行生長并產生纖維素酶,使培養基中的羧甲基纖維素水解并形成透明圈。水解圈直徑與菌落直徑之比較大的菌株產纖維素酶能力比較強,反之較弱。從表1中可以看出菌株33產酶能力最大,其次是菌株13、27、22、25、31,菌株29產酶能力最小。
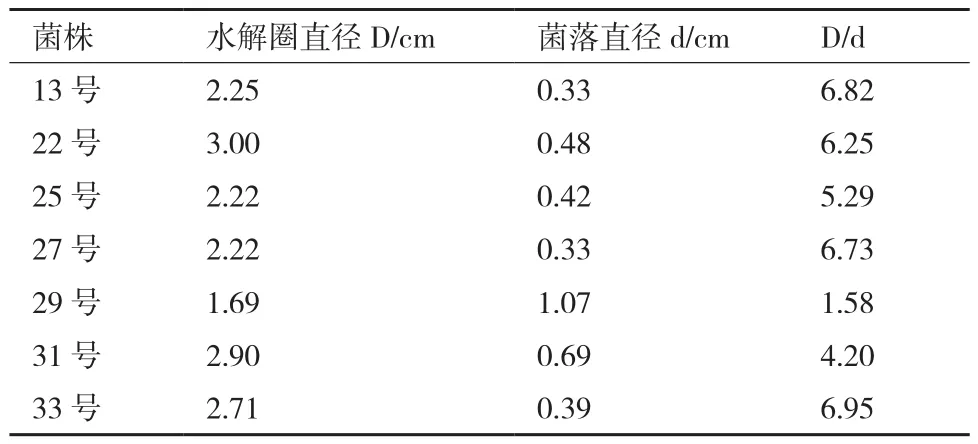
表1 篩選菌株水解圈大小
2.2 分離菌株的鑒定結果與分析
2.2.1 形態學鑒定 選取產酶能力較強的2個菌株13和33號,進行革蘭氏染色以及芽孢染色,結果如圖1,13和33號菌株均能產芽孢。菌株13號菌落表面濕潤、菌落乳白色,屬革蘭氏陽性菌,產芽孢;菌株33菌落形態呈現白色、圓形、扁平狀態,菌落均勻不透明且邊緣整齊,屬革蘭氏陽性菌,產芽孢。
2.2.2 分子生物學鑒定 將篩選菌株進行16S rRNA基因擴增,得到約1 500 bp的PCR產物(圖2)。根據NCBI的BLAST比對以及系統發育樹(圖3)可知,菌株13為貝萊斯芽孢桿菌,菌株33屬于枯草芽孢桿菌,皆與形態學鑒定結果相吻合。
節點左邊的數值是基于鄰接法1 000次重復取樣數據集的Bootstrap支持率;比例尺0.01表示1 000個核苷酸中有10個被替換;括號內的序號表示相應序列在GenBank的登錄號。
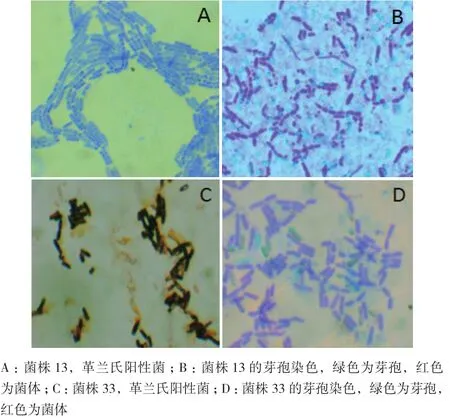
圖1 形態學鑒定結果(×1 000)
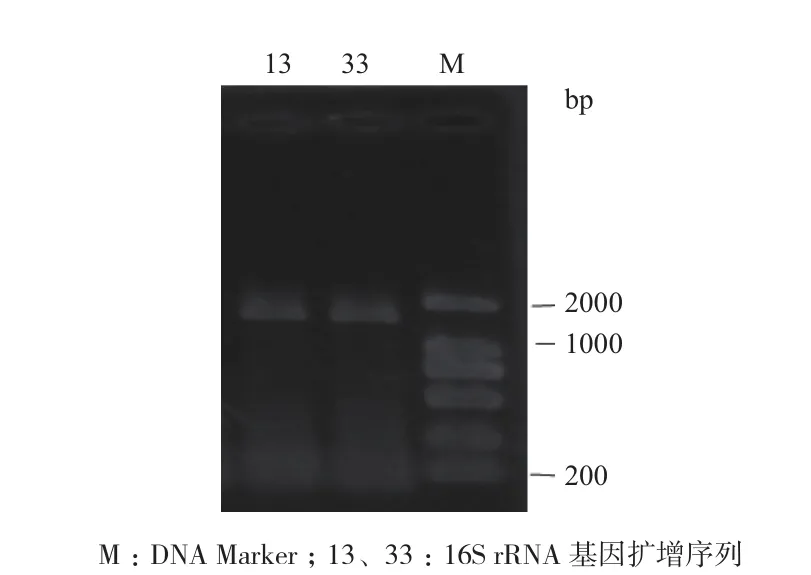
圖2 PCR產物擴增結果
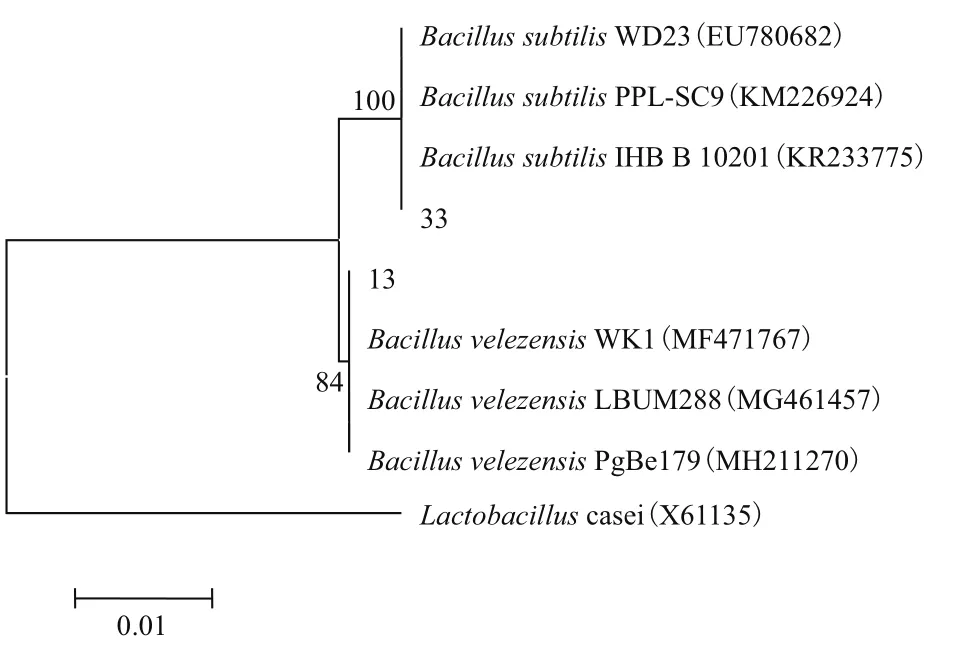
圖3 菌株13、33的16S rRNA基因系統發育樹
2.3 菌株33基因組掃描測序
2.3.1 菌株33基因組概況 采用 Illumina Hiseq4000測序技術對樣品的 DNA 進行 paired-end(PE)測序,構建300 bp-500 bp 文庫,利用 SOAPdenovo v2.04和velvet 拼接軟件對優化序列進行組裝,通過 Glimmer 3.02軟件進行細菌的基因預測,測序數據和基因預測結果見表2。

表2 菌株33測序數據和基因信息
2.3.2 菌株33基因組碳水化合物相關酶(CAZy)的基因注釋 CAZy 數據庫專業收集各種碳水化合物酶類,目前,數據庫包含糖苷水解酶類(GHs)、糖苷轉移酶類(GTs)、多糖裂解酶類(PLs)、糖水化合物酯酶類(CEs)、碳水化合物結合模塊(CBMs)和輔助模塊酶類(AAs)6大類家族,其同源家族數目分別達到了 149、105、27、16、83 和 14 個。使用 HMMs 方法在所獲得的蛋白質序列中鑒定 CAZy數據庫中含有的各種酶類的結構信息,從而鑒定菌株33基因組中碳水化合物相關酶基因,并將這些按照種類分為 6 大類,結果見表3。菌株33基因組含有較多的碳水化合物相關酶基因,分屬于6大類家族,其中糖苷水解酶類包含GH1、GH4、GH23、GH26等32個家族,同源家族數目達69個;碳水化合物結合模塊包含CBM16、CBM16、CBM50等12個家族,同源家族數目達47個;糖苷轉移酶類包含GT2、GT4、GT26等12個家族,同源家族數目達43個;糖水化合物酯酶類包含CE1、CE7、CE12等9個家族,同源家族數目達30個;輔助模塊酶類包含AA4、AA6和AA7三個家族,同源家族數目達8個;多糖裂解酶類包含PL1-6、PL3-1、PL26等6個家族,同源家族數目達7個。菌株33含有豐富的碳水化合物相關酶基因資源,通過研究這些基因的表達調控,可以揭開菌株33降解纖維素的機制,也有望獲得新的高效表達的纖維素酶基因資源。
3 討論
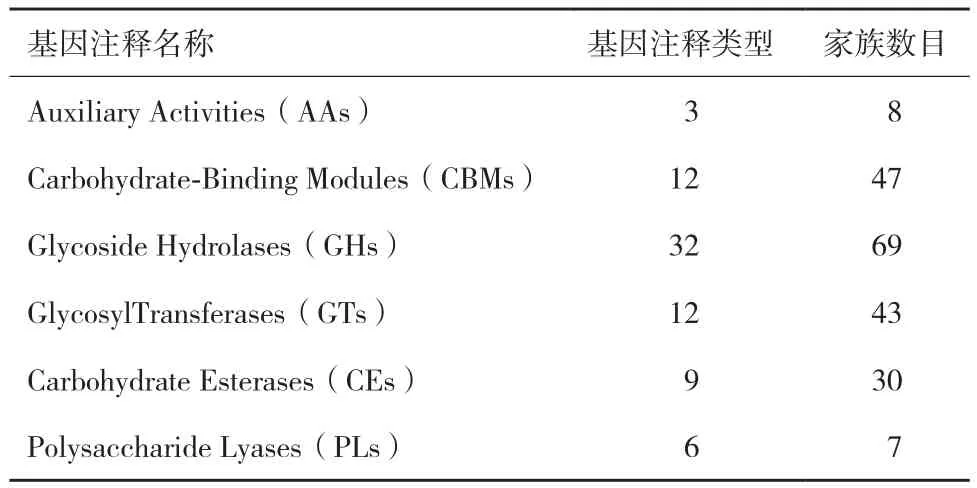
表3 菌株33碳水化合物相關酶的基因
纖維素由數百至數千個葡萄糖分子聚合而成,是地球上存在最豐富的有機大分子[15]。纖維素酶能夠水解纖維素為葡萄糖并應用于工業生產,具有十分廣闊的應用前景。隨著生物技術在工業中的發展,纖維素酶被廣泛應用于飼料生產、食品醫藥、制漿造紙、能源工業等行業,創造了巨大的經濟價值[16]。然而,目前工業應用的一些纖維素酶產品,受到酶的特性限制,如酶產量、酶穩定性、酶系組成和酶的催化效率等因素,阻礙了這些纖維素酶產品在一些行業中的推廣;一些產纖維素酶菌株也由于其自身的生理特性而在某些行業得不到應用。因此,根據行業發展,篩選新的適合行業需求的高效纖維素降解菌和纖維素酶基因資源,仍然具有十分重要的意義,也有望解決纖維素酶產量和活性不高,纖維素酶降解菌不能定植等問題。以小龍蝦行業為例,小龍蝦飼料的產業發展制約著小龍蝦行業的革新。目前,小龍蝦養殖大都采用野雜魚、玉米、小麥等天然餌料或其他蝦蟹飼料替代進行飼喂[17],隨著養殖規模的不斷擴大,小龍蝦人工配合飼料的開發也越來越受到人們的關注。但是,迄今為止,有關小龍蝦飼料方面的研究,主要集中在蛋白質和脂肪需求等方面,但未見有小龍蝦功能性飼料的相關報道。許多研究也表明,土著微生物對固有環境具有更好的適應性,土著腸道微生物更容易在宿主腸道中定植,從而起到和宿主的互利共生作用[18]。從小龍蝦腸道中分離高產消化酶的土著細菌,制備小龍蝦腸道微生物源微生物制劑,開發小龍蝦專屬功能飼料已迫在眉睫。
腸道不僅是生命體吸收、消化和進行營養物質交換的重要場所,也是機體與外界環境聯系最緊密的器官之一[19]。腸道微生物棲居于腸道內,與宿主形成共生關系,在宿主營養吸收、生長代謝和免疫抗病等方面都發揮著重要作用[20-21]。隨著人們對腸道微生物的重視程度日益提高,關于腸道微生物的研究也逐漸增多。關于腸道微生物的功能研究,主要有兩個方面:一是腸道菌群的研究,可以了解腸道微生物的結構與組成,為研究微生物的功能以及在腸道中發揮的作用提供指導,筆者在先前的研究中,通過高通量測序技術分析了小龍蝦腸道細菌菌群的結構發現,在屬水平上,小龍蝦腸道細菌主要是Candidatus Bacilloplasma、擬桿菌屬、弧菌屬、不動桿菌屬、Dysgonomonas、Tyzzerella 3、氣單胞菌屬細菌,為小龍蝦腸道微生物的功能研究提供了一定參考[22];另一方面是腸道功能微生物的研究,本研究中從小龍蝦腸道中篩選出7株產纖維素酶菌株,對產酶活性較高的2株菌株13、33進行形態學和分子生物學鑒定,其中菌株13為貝萊斯芽孢桿菌(Bacillus velezensis),菌株33為枯草芽孢桿菌(Bacillus subtilis)。芽孢桿菌屬(Bacillus)是一類產芽孢的革蘭氏陽性細菌,好氧或兼性厭氧生活。芽孢桿菌屬不是小龍蝦腸道核心菌群,但是芽孢桿菌屬細菌在小龍蝦腸道降解纖維素過程中發揮著一定功能。小龍蝦以植物根、葉為食,腸道中生存著大量的纖維素降解細菌,從小龍蝦腸道中篩選產纖維素酶細菌,有望獲得全新的纖維素酶菌株資源和基因資源,它們對于小龍蝦腸道微生物源專屬飼料的開發和應用也具有十分重要的意義。菌株33具有多種水解酶活性,并有較高的纖維素降解能力,高通量測序結果表明該菌基因組含有許多碳水化合物相關酶基因。通過研究這些基因的表達調控,可以弄清菌株33降解纖維素的機理,探明其在小龍蝦腸道內降解纖維素過程中發揮的作用。同時,對這些纖維素酶基因進行克隆和外源表達,也有望獲得可以工業應用的纖維素酶產品。結果也表明該菌基因組中含有許多碳水化合物相關酶基因,后續可以對菌株33的纖維素酶基因進行體外分子改良及高產纖維素酶活性內源性益生菌的構建,以期提高飼料利用率。
4 結論
本研究從小龍蝦腸道中篩選到7株產纖維素酶菌株,對產酶活性較高的2株菌株13、33進行形態學和分子生物學鑒定,其中菌株13為貝萊斯芽孢桿菌,菌株33為枯草芽孢桿菌,菌株33具有多種水解酶活性,并有較高的纖維素降解能力,表明小龍蝦腸道中含有豐富的纖維素降解菌,芽孢桿菌屬細菌占據著一定比重,從小龍蝦腸道中有望篩選到可以應用于飼料工業的優良菌株。菌株33高通量測序

