miR-199a-5p對鵝顆粒細胞凋亡的影響及其機制
劉雅麗 榮玉靜 胡深強 李亮 劉賀賀 何樺 夏露 胡繼偉 胡博 王繼文

摘要:為了揭示miR-199a-5p在鵝卵泡顆粒細胞凋亡中的作用及調控機制,本研究分離培養鵝等級卵泡顆粒細胞并轉染miR-199a-5p相似物(mimic)和抑制物(inhibitor),采用qPCR法檢測細胞凋亡相關基因的mRNA表達量;為進一步探究其作用機制,結合RNAhybrid和Targetscan 7.0預測miR-199a-5p靶基因,然后在中國倉鼠卵巢細胞系(CHO)中采用雙熒光素酶報告系統檢測miR-199a-5p對血管生成因子A(vascular endothelial growth factor A,VEGFA)3′UTR熒光素酶活性的影響,最后采用qPCR檢測miR-199a-5p對鵝顆粒細胞VEGFA表達量的影響。結果顯示,過表達miR-199a-5p能顯著升高BCL2/BAX比值(P<0.05),顯著下調Caspase3 mRNA表達量(P<0.05);抑制miR-199a-5p則顯著下調BCL2/BAX值(P<0.05),對Caspase3 mRNA表達量無影響(P>0.05)。雙熒光素酶報告載體系統發現,miR-199a-5p能極顯著抑制VEGFA-WT報告載體熒光素酶活性(P<0.01),但對VEGFA mRNA表達量無顯著性影響(P>0.05)。上述試驗結果表明,miR-199a-5p可能通過抑制BAX和Caspase3表達量來抑制鵝顆粒細胞凋亡,但在鵝顆粒細胞中miR-199a-5p是否通過VEGFA調控細胞凋亡需要進一步研究。
關鍵詞:miR-199a-5p;VEGFA;顆粒細胞凋亡;鵝;mimic;inhibitor
中圖分類號:S858.33 ?文獻標志碼: A ?文章編號:1002-1302(2020)23-0060-06
卵巢卵泡發育狀況影響家禽繁殖性能和產蛋率,而影響卵泡正常發育的因素眾多,其中顆粒細胞增殖分化或凋亡對卵泡發育具有重要作用[1]。顆粒細胞能合成多種活性肽,不僅可以調節垂體釋放促卵泡素(FSH)影響卵泡發育,還能作為局部調節因子調控類固醇激素生成和細胞增殖,為卵泡生長發育所必需。禽類卵泡發育過程中大量發生閉鎖,這個過程主要受顆粒細胞凋亡率調控。Johnson等發現,雞卵泡閉鎖起始于顆粒層并受顆粒細胞凋亡過程的調節[2-3]。
miRNA是一類長約18~25 nt具有調控功能的內源性非編碼蛋白RNA[4]。目前在顆粒細胞中已經發現許多miRNA參與調控細胞增殖凋亡。對豬健康卵泡和閉鎖卵泡測序后發現,miR-26b在閉鎖卵泡中表達量顯著升高,進一步研究發現其通過靶向ATM(共濟失凋突變基因)促進顆粒細胞凋亡[5]。對水牛健康卵泡、早期閉鎖卵泡和晚期閉鎖卵泡測序后發現,包括 miR-21-5p 在內多個miRNA表達量隨著卵泡閉鎖程度增加先升高后下降,表明miR-21-5p可能參與了調控顆粒細胞凋亡[6]。FSH處理雞顆粒細胞后能抑制細胞凋亡,對處理樣品測序后發現包括let-7家族和miR-130/301家族在內的miRNA差異表達,表明它們可能在細胞凋亡中發揮了作用[7]。表皮生長因子(EGF)處理鵝等級前顆粒細胞后,能促進細胞增殖,miRNA測序后發現包括miR-26b、miR-27a、miR-27b等多個miRNA表達量顯著上調[8]。筆者所在課題組通過對不同發育階段卵泡顆粒層測序得到許多差異表達的miRNA,包括miR-199a-5p[9]。Donadeu等測序發現,miR-199a-5p在牛閉鎖卵泡顆粒細胞中的表達量顯著高于在健康卵泡顆粒細胞中[10]。對牛發情期第3天次級卵泡和優勢卵泡的顆粒層測序后發現,miR-199a-5p在次級卵泡顆粒層中表達量顯著高于在優勢卵泡中,但在發情期第7天miR-199a-5p表達量趨勢與之相反,說明miR-199a-5p在顆粒細胞中的作用可能與卵泡發育階段有關[11]。目前miR-199a-5p在顆粒細胞中的研究只停留在測序水平,關于其在顆粒細胞中的功能及作用機制尚未報道。
目前,miR-199a-5p在禽類顆粒細胞中的作用尚未有報道,而顆粒細胞的凋亡率影響卵泡正常發育,因此本試驗通過在鵝顆粒細胞中轉染miR-199a-5p相似物(mimic)或抑制物(inhibitor)來過表達或抑制內源性miR-199a-5p表達。qPCR法檢測細胞凋亡關鍵基因表達量,使用生物信息學預測 miR-199a-5p靶基因并通過雙熒光素酶報告系統驗證,最后qPCR法檢測miR-199a-5p對靶基因表達量的影響。本研究結論旨在為進一步闡明miR-199a-5p在禽類顆粒細胞中的作用奠定基礎。
1 材料與方法
1.1 試驗材料和細胞系
本試驗動物材料選用在相同條件下飼養的健康、開產時間和體質量基本一致并處于產蛋高峰期的天府肉鵝母系母鵝。試驗動物來自四川農業大學家禽育種場,使用程序按照四川農業大學動物護理與使用指南進行;中國倉鼠卵巢細胞系(CHO)購自中國科學院昆明動物研究所。試驗于2018—2019年在四川農業大學畜禽遺傳資源發掘與創新利用四川省重點實驗室完成。
1.2 鵝顆粒細胞分離培養
將鵝頸部放血處死后取出卵泡,按照Gilbert等的方法分離F2~F4等級階段卵泡顆粒層:在超凈臺中剪碎后加入0.05% Ⅱ型膠原酶(美國MPbio公司),在37 ℃水浴鍋中消化,無明顯塊狀物后終止消化[12]。離心后棄去上清,加入含10% FBS(胎牛血清,美國Gibco公司)和1%青鏈霉素混合液的DMEM/F12(杜爾貝科改良伊格爾培養基,美國HyClone公司)培養基重懸細胞,接種于12孔板,放入37 ℃、5% CO2培養箱中培養。
1.3 顆粒細胞轉染
顆粒細胞培養48 h后,按照 Lipofectamine3000(美國英杰生命技術有限公司)說明書操作轉染不同濃度的miR-199a-5p的相似物(mimic)和抑制物(inhibitor)。筆者所在課題組前期對鵝顆粒細胞miRNA進行測序,得到miR-199a-5p序列(5′-CCCAGUGUUCAGACUACCUGUUC-3′),根據其序列由上海吉瑪制藥技術有限公司設計合成鵝miR-199a-5p的mimic和inhibitor,詳見表1。每個試驗組共設3個重復孔,24 h后使用RNAiso Plus[寶生物工程(大連)有限公司]收集RNA樣品。
1.4 熒光定量PCR檢測基因表達量
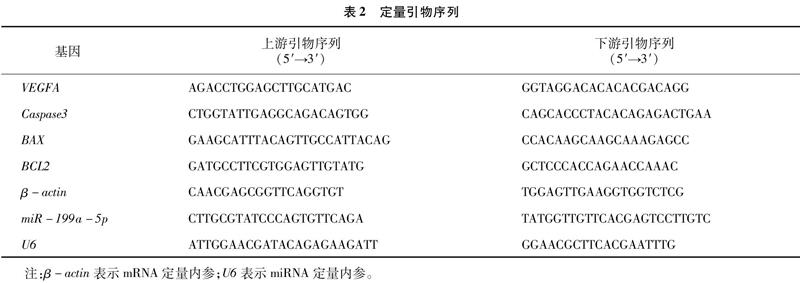
用RNAiso Plus提取細胞總RNA后,使用上海吉瑪制藥技術有限公司設計合成的miRNA&U6反轉錄與定量試劑盒檢測miR-199a-5p的表達量。使用PrimeScriptTM RT reagent Kit和SYBR Premix Ex TaqTM Ⅱ[寶生物工程(大連)有限公司]檢測mRNA表達量。每個樣本重復3次,miRNA和mRNA表達量計算分別以U6和β-actin為內參,本試驗所用定量引物序列見表2。
1.5 靶基因預測與載體構建
根據靶基因預測網站Targetscan 7.0(http://www.targetscan.org/vert_71/)和RNAHybrid(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid)預測到鵝VEGFA(XM_013200060.1)可能是miR-199a-5p的靶基因,在3′UTR處存在潛在結合位點。根據鵝VEGFA 3′UTR設計如下引物擴增包括潛在結合位點在內的片段:F:5′-cgagctcTCAGTACGGACGA-3′;R:5′-ctctagaGGCGAAGGTTGG-3′,引物5′端小寫字母分別代表SacⅠ、XbaⅠ 酶切位點和保護堿基。將擴增產物膠回收后和pmirGLO質粒[普洛麥格(北京)生物技術有限公司]使用SacⅠ、XbaⅠ內切酶(英國New England Biolabs公司)進行雙酶切,再次膠回收后將擴增片段連接到pmirGLO質粒上得到野生型重組載體即VEGFA-WT。將野生型載體的潛在結合位點突變為其互補序列,得到突變型重組載體即VEGFA-MUT,點突變由北京擎科新業生物技術有限公司完成。
1.6 雙熒光素酶報告載體試驗
CHO細胞系復蘇后接種于培養皿中,待細胞長滿后用胰酶消化,然后用含10% FBS的DMEM/F12培養基重懸細胞,以1×106~4×106個/mL的密度接種于96孔板。待細胞密度達到約70%~80%時,按照Lipofectamine 3000(美國英杰生命技術有限公司)說明書將miR-199a-5p mimic/NC分別與VEGFA-WT/MUT兩兩共轉染,試驗共設4個試驗組,每組3孔重復值。
1.7 雙熒光素酶活性檢測
使用Dual-Luciferase Reporter試劑盒(Promega)檢測熒光活性,檢測前先將luciferase底物按要求溶解分裝,-80 ℃備用。按試驗需要量稀釋1×裂解液,并按stop & Glo buffer ∶ stop & Glo底物=50 ∶ 1的比例現配stop & Glo底物備用。CHO細胞轉染24 h后棄去培養基,PBS清洗1次,加入裂解液充分裂解細胞后將其轉移到小EP管中。檢測時先加入20 μL細胞裂解液和100 μL luciferase底物反應并讀取A值,繼續加入100 μL stop & Glo底物反應讀取B值,A/B比值即為最終檢測結果。
1.8 數據分析
使用2-ΔΔCT法計算基因相對表達量[13],使用GraphPad Prism 7.0軟件的t-test檢驗分析數據并作圖。
2 結果與分析
2.1 miR-199a-5p過表達和抑制效果檢測
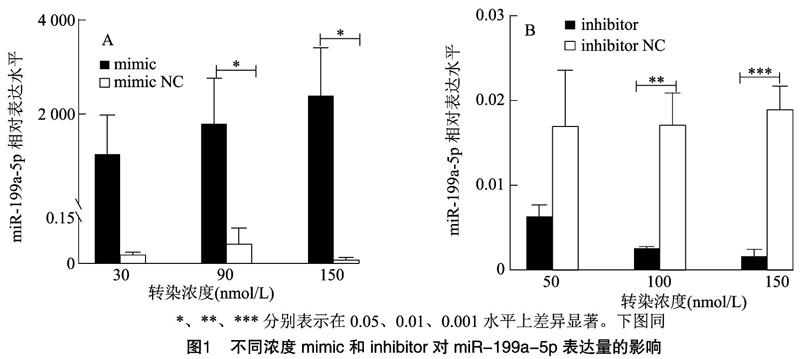
本試驗中miR-199a-5p mimic設置30、90、150 nmol/L 3個轉染濃度,檢測miR-199a-5p過表達效果,結果見圖1-A。miR-199a-5p mimic轉染顆粒細胞24 h后,與各自對照組相比,90、150 nmol/L 濃度時miR-199a-5p表達量顯著增加(P<0.05)。miR-199a-5p inhibitor設置50、100、150 nmol/L 3個轉染濃度,結果見圖1-B,100、150 nmol/L時,miR-199a-5p表達量均極顯著減少(P<0.01或P<0.001),因此后續試驗過表達組和抑制組定量樣品轉染濃度均選擇150 nmol/L。
2.2 miR-199a-5p對顆粒細胞凋亡關鍵基因表達量的影響
由圖2可知,過表達miR-199a-5p后,抗凋亡基因B-Cell CLL/Lymphoma 2(BCL2)與促凋亡因子BCL2 Associated X Protein(BAX)的比值(BCL2/BAX)上升,促凋亡基因Caspase3 mRNA表達量均下
降,與對照組相比差異顯著(P<0.05)。抑制miR-199a-5p后,BCL2/BAX比值顯著下降,但Caspase3表達量沒有顯著差異(P>0.05)。
2.3 miR-199a-5p靶基因預測與載體構建
通過Targetscan網站預測miR-199a-5p靶基因,從中挑選與顆粒細胞增殖凋亡相關的基因,最終選擇VEGFA作為候選靶基因。將鵝VEGFA 3′UTR序列和鵝miR-199a-5p序列導入RNAhybrid網站中尋找二者的結合位點,結果見圖3。設計引物擴增得到677 bp的VEGFA 3′UTR片段,包含潛在的結合位點。最終構建得到的野生型和突變型載體序列見圖4。
2.4 miR-199a-5p靶基因鑒定
CHO細胞轉染24 h后檢測熒光活性,結果見圖5。當過表達miR-199a-5p時,和對照組相比VEGFA-WT熒光活性被極顯著抑制(P<0.01),說明二者之間存在結合位點;過表達miR-199a-5p對VEGFA-MUT熒光活性沒有顯著變化(P>0.05),說明二者不存在結合位點,即預測的結合位點正確,鵝VEGFA是 miR-199a-5p的靶基因。進一步在鵝顆粒細胞中檢測VEGFA mRNA表達量(圖6)發現,無論是過表達還是抑制miR-199a-5p表達,VEGFA mRNA表達量均沒有顯著差異(P>0.05)。
3 討論與結論
已知BCL2和BAX是通過形成同源或異源二聚體來調節細胞凋亡的,二者比值降低促進凋亡,反之則抗凋亡[14]。本研究中過表達miR-199a-5p后BCL2/BAX比值顯著升高,而抑制后比值顯著下降,促凋亡基因Caspase3表達量也在過表達 miR-199a-5p 后顯著下降,說明miR-199a-5p在鵝顆粒細胞中可能起到抑制細胞凋亡的作用。miR-199a-5p在顆粒細胞中的功能研究尚未有報道。Zhu等發現miR-199a-5p可以誘導心肌細胞和結直腸癌細胞凋亡[15-16]。在小鼠肝細胞中刺激內質網應激發生后,抑制miR-199a-5p表達可以促進細胞凋亡,表明 miR-199a-5p在肝細胞中起到抗凋亡的作用,抑制內質網應激引起的細胞凋亡[17]。此外miR-199a-5p還可以調控細胞增殖。在肝癌細胞中,miR-199a-5p調節缺氧誘導因子1α(HIF1A)和VEGFA抑制細胞增殖[18]。Ye等發現在結直腸癌細胞中,miR-199a-5p通過HIF1A/VEGFA 途徑抑制細胞增殖,但不影響細胞凋亡和細胞周期[19]。
miRNAs的經典作用方式是通過與靶基因mRNA 3′UTR結合抑制靶基因表達,繼而發揮不同功能。本研究使用Targetscan網站共預測到621個miR-199a-5p靶基因,從中篩選與顆粒細胞凋亡相關的基因,最終選擇VEGFA基因作為候選基因。VEGFA基因編碼肝素結合蛋白,誘導血管內皮細胞的增殖和遷移,對于血管生成必不可少[20]。在小鼠顆粒細胞中慢病毒介導過表達VEGFA后,BAX和Caspase3表達量顯著下降,抑制顆粒細胞凋亡[21]。在綿羊顆粒細胞中直接添加VEGFA可促進細胞增殖[22-23]。卵泡發育需要血管提供氧氣,因此VEGFA還影響卵泡正常發育,直接向小鼠卵巢中注射VEGFA后,可促進卵泡數量增加和血管生成[24]。Hsu等發現上調miR-199a-5p可以通過靶向VEGFA的3′UTR抑制子宮內膜間充質干細胞增殖,驗證了二者之間的靶向關系[25]。
由于Targetscan網站中預測靶基因與miRNA結合位點時不包含鵝,為了確定miR-199a-5p與鵝VEGFA基因潛在的結合位點,使用RNAHybrid網站導入鵝VEGFA 3′UTR與miR-199a-5p序列,預測二者可能的結合位點并構建野生型和突變型載體。本研究發現過表達miR-199a-5p后,VEGFA-WT報告載體熒光素酶活性顯著下降,說明VEGFA是miR-199a-5p的靶基因。當突變二者的潛在結合位點后過表達miR-199a-5p對VEGFA-MUT報告載體熒光素酶活性無影響,證明預測的結合位點正確。本研究進一步檢測miR-199a-5p對VEGFA表達量的影響時發現,無論是過表達還是抑制miR-199a-5p表達,都不影響顆粒細胞中VEGFA mRNA的表達量,表明miR-199a-5p是在翻譯水平調控VEGFA蛋白表達。在人子宮內膜基質細胞中,miR-199a-5p通過與VEGFA 3′UTR結合抑制其蛋白表達量,但不影響mRNA表達量[26]。
miRNA靶基因眾多,在不同發育階段或組織細胞中起主效作用的靶基因可能存在差異,而單個靶基因又會同時受到多個miRNA調控,共同構成復雜的調控網絡[27-28]。目前眾多研究表明,VEGFA在顆粒細胞中行使促進細胞增殖和抗凋亡的作用,而本研究發現miR-199a-5p在鵝顆粒細胞中可能發揮抑制細胞凋亡的作用,因此推測miR-199a-5p在鵝顆粒細胞中抗凋亡功能可能不是通過靶基因VEGFA實現的,或者說VEGFA在此過程中作用很小,不是主效靶基因,仍需要進一步試驗探究。
本研究發現miR-199a-5p可能抑制鵝顆粒細胞凋亡,并通過雙熒光素酶報告系統驗證了VEGFA是miR-199a-5p的靶基因,但是 miR-199a-5p抑制鵝顆粒細胞凋亡的功能是否通過VEGFA通路實現需要進一步研究。本研究初步探討miR-199a-5p在禽類顆粒細胞中的功能及可能機制,為深入探究miRNA在禽類卵巢顆粒細胞中的功能提供理論依據。
參考文獻:
[1]Matsuda F,Inoue N,Manabe N,et al. Follicular growth and atresia in mammalian ovaries:regulation by survival and death of granulosa cells[J]. The Journal of Reproduction and Development,2012,58(1):44-50.
[2]Johnson A L,Bridgham J T,Witty J P,et al. Expression of bcl-2 and nr-13 in hen ovarian follicles during development[J]. Biology of Reproduction,1997,57(5):1096-1103.
[3]Manabe N,Matsuda-Minehata F,Goto Y,et al. Role of cell death ligand and receptor system on regulation of follicular atresia in pig ovaries[J]. Reproduction in Domestic Animals,2008,43(S2):268-272.
[4]Vrijens K B V,Nawrot T S. MicroRNAs as potential signatures of environmental exposure or effect:a systematic review[J]. Environmental Health Perspectives,2015,123(5):399-411.
[5]Lin F,Li R,Pan Z X,et al. miR-26b promotes granulosa cell apoptosis by targeting ATM during follicular atresia in porcine ovary[J]. PLoS One,2012,7(6):e38640.
[6]李 潤.水牛顆粒細胞凋亡相關基因和miRNA表達及雌二醇對其表達調控的研究[D]. 南寧:廣西大學,2014.
[7]侯英萍.FSH處理對雞卵泡顆粒細胞凋亡的影響及差異表達miRNAs的研究[D]. 南京:南京農業大學,2014.
[8]黃正洋.表皮生長因子參與鵝卵泡顆粒細胞增殖調控機理的研究[D]. 揚州:揚州大學,2016.
[9]Li Q,Hu S Q,Wang Y S,et al. mRNA and miRNA transcriptome profiling of granulosa and theca layers from geese ovarian follicles reveals the crucial pathways and interaction networks for regulation of follicle selection[J]. Frontiers in Genetics,2019,10:988.
[10]Donadeu F X,Mohammed B T,Ioannidis J. A miRNA target network putatively involved in follicular atresia[J]. Domestic Animal Endocrinology,2017,58:76-83.
[11]Salilew-Wondim D,Ahmad I,Gebremedhn S,et al. The expression pattern of microRNAs in granulosa cells of subordinate and dominant follicles during the early luteal phase of the bovine estrous cycle[J]. PLoS One,2014,9(9):e106795.
[12]Gilbert A B,Evans A J,Perry M M,et al. A method for separating the granulosa cells,the basal lamina and the theca of the preovulatory ovarian follicle of the domestic fowl(Gallus domesticus)[J]. Journal of Reproduction and Fertility,1977,50(1):179-181.
[13]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[14]Renault T T,Dejean L M,Manon S. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2[J]. Mechanisms of Ageing and Development,2017,161:201-210.
[15]Zhu Q D,Zhou Q Q,Dong L,et al. MiR-199a-5p inhibits the growth and metastasis of colorectal cancer cells by targeting ROCK1[J]. Technology in Cancer Research & Treatment,2018,17:1-10.
[16]Yan M J,Yang S B,Meng F B,et al. MicroRNA 199a-5p induces apoptosis by targeting JunB[J]. Scientific Reports,2018,8(1):1-10.
[17]Dai B H,Geng L,Wang Y,et al. microRNA-199a-5p protects hepatocytes from bile acid-induced sustained endoplasmic reticulum stress[J]. Cell Death & Disease,2013,4(4):e604.
[18]Morita K,Shirabe K,Taketomi A,et al. Relevance of microRNA-18a and microRNA-199a-5p to hepatocellular carcinoma recurrence after living donor liver transplantation[J]. Liver Transplantation,2016,22(5):665-676.
[19]Ye H,Pang L P,Wu Q,et al. A critical role of mir-199a in the cell biological behaviors of colorectal cancer[J]. Diagnostic Pathology,2015,10:65.
[20]Nichols J A,Perego M C,Schütz L F,et al. Hormonal regulation of vascular endothelial growth factor A (VEGFA) gene expression in granulosa and theca cells of cattle1[J]. Journal of Animal Science,2019,97(7):3034-3045.
[21]秦 嶺. 慢病毒載體介導小鼠卵巢顆粒細胞內特異性超表達VEGF基因的研究[D]. 南京:南京農業大學,2012:65-71.
[22]楊永梅. VEGF對綿羊卵泡顆粒細胞增殖作用機制的研究[D]. 長春:吉林農業大學,2011:31-33.
[23]曹穎楠,劉松財,郝林琳,等. ERK1/2通路在VEGF促進綿羊卵泡顆粒細胞增殖中的作用[J]. 中國獸醫學報,2012,32(10):1532-1535,1559.
[24]Quintana R,Kopcow L,Sueldo C,et al. Direct injection of vascular endothelial growth factor into the ovary of mice promotes follicular development[J]. Fertility and Sterility,2004,82(S3):1101-1105.
[25]Hsu C Y,Hsieh T H,Tsai C F,et al. miRNA-199a-5p regulates VEGFA in endometrial mesenchymal stem cells and contributes to the pathogenesis of endometriosis[J]. The Journal of Pathology,2014,232(3):330-343.
[26]Dai L,Lou W H,Zhu J,et al. MiR-199a inhibits the angiogenic potential of endometrial stromal cells under hypoxia by targeting HIF-1α/VEGF pathway[J]. International Journal of Clinical and Experimental Pathology,2015,8(5):4735-4744.
[27]Huang J C,Babak T,Corson T W,et al. Using expression profiling data to identify human microRNA targets[J]. Nature Methods,2007,4(12):1045-1049.
[28]Bartel D P. MicroRNAs:target recognition and regulatory functions[J]. Cell,2009,136(2):215-233.施天元,程玉祥. 楊樹PtBBE9a基因異源過表達功能分析[J]. 江蘇農業科學,2020,48(23):66-70.

