香蕉枯萎病菌分子檢測研究進展
楊迪 杜嬋娟 葉云峰 彭軍 張欣 付崗


摘? 要:香蕉枯萎病是全世界香蕉產業共同面臨的毀滅性病害,但目前生產上仍缺乏適宜的抗病品種和有效的治療措施。因此,借助快速準確的枯萎病菌檢測技術及時明確病原菌以控制該病的傳播和蔓延顯得尤為重要。本文回顧了近年來國內外香蕉枯萎病菌分子檢測技術的發展歷程,歸納和總結了DNA指紋圖譜、普通PCR、多重PCR、熒光定量PCR及等溫擴增技術在該病菌檢測中的研究進展,分析了不同檢測技術的優缺點,并指出可能存在的問題和研究發展方向,為該病的分子檢測技術優化和防控策略制定提供參考。
關鍵詞:香蕉枯萎病;尖孢鐮刀菌古巴專化型;分子檢測
中圖分類號:S436.68+1? ? ? 文獻標識碼:A
Abstract: Banana Fusarium wilt is a devastating disease in global banana industry. At present, there is still no available measures can be used for curing this disease, and lack of suitable resistant varieties. So, it is very important that developing the rapid and accurate detection technology in order to slow down the spread speed of banana Fusarium wilt in the field. In this paper, the development of molecular detection techniques on Fusarium oxysporum f. sp. cubense was reviewed. The detection technology based on DNA fingerprinting, general PCR, multiplex PCR, fluorescence quantitative PCR and isothermal amplification were summarized. The advantages and disadvantages of different detection technologies were analyzed. Futhermore, the problems lied in detection of this pathogen and possible research directions in the future were pointed out.
Keywords: banana Fusarium wilt; Fusarium oxysporum f. sp. cubense; molecular detection
DOI: 10.3969/j.issn.1000-2561.2020.12.029
香蕉枯萎病是由尖孢鐮刀菌古巴專化型(Fusarium oxysporum f. sp. cubense, Foc)侵染引起的檢疫性土傳病害[1]。該病于1874年首次在澳大利亞發現,1910年在巴拿馬大爆發,直接導致巴拿馬乃至整個中南美洲香蕉產業的衰退。隨后,抗病品種‘香芽蕉(Cavendish, AAA)的種植和推廣使世界香蕉產業重新煥發生機;但20世紀后期香蕉枯萎病菌4號生理小種的出現,使香蕉產業再次面臨巨大威脅[2-4]。
香蕉枯萎病菌依據寄主致病性分為1號(Race 1, R1)、2號(Race 2, R2)和4號生理小種(Race 4, R4)。根據不同侵染條件,4號小種又分為熱帶4號(Tropical Race 4, TR4)和亞熱帶4號(Subtropical Race 4, STR4)。其中R1和R2侵染粉蕉,R4可侵染幾乎所有栽培蕉[5-8]。因缺乏有效藥劑和抗病品種,該病在生產上極難控制[9-11];因此,快速準確地檢測該病的病原菌以便及時采取銷毀、隔離措施阻止該病的傳播和蔓延至關重要。
依靠傳統方式分離、接種、鑒定病原菌耗時耗力,且需要經驗豐富的研究人員才能完成[12-17]。隨著PCR技術與高通量測序技術的發展,各種基于基因序列特征的分子快速檢測技術逐漸應用于香蕉枯萎病菌的檢測[18-19]。與傳統檢測方法相比,分子檢測技術更加高效便捷,在生產上更具實用價值[20-21]。本文對國內外近年來香蕉枯萎病菌分子檢測技術的研究進展進行分析和梳理,并提出存在的問題和將來可能的研究方向,以期為香蕉枯萎病菌的快速檢測研究提供借鑒。
1? 基于DNA指紋圖譜的香蕉枯萎病菌檢測
1990年John等[22]首先提出了AP-PCR技術,利用隨機引物擴增獲得多態性DNA指紋圖譜,為菌株的分子鑒定提供了一種有效方法。Bentley等[23-24]首次將該技術應用于香蕉枯萎病菌檢測,通過分析11株澳大利亞Foc菌株的DNA多態性圖譜,發現根據基因組特異性帶型對菌株進行分組的結果與之前基于寄主范圍、營養親和群(vegetative compatibility groups, VCGs)、電泳核型分析和揮發性化合物色譜圖的分組結果一致。隨后該研究組擴大測試菌株的樣本量和來源范圍,進一步驗證了DNA指紋圖譜與生理小種和VCGs的相關性,建立了香蕉枯萎病菌的DNA指紋圖譜檢測方法[25-27]。Gerlach等[28]采用DNA指紋圖譜技術對澳大利亞分屬于4個生理小種和8個VCGs的94株Foc菌株進行測試,發現DNA指紋圖譜具有VCG特異性,并且利用不同電泳帶型可以區分出與3個生理小種相對應的VCG群。劉景梅等[29]使用2個隨機引物對廣東18個Foc菌株進行分析,也證實了Foc R1和Foc R4的DNA圖譜存在差異,而同一小種內菌株的RAPD電泳譜帶差異較小,說明DNA指紋圖譜可用于Foc生理小種的檢測。謝藝賢等[30]對分離自海南、廣東的18個Foc菌株進行RAPD圖譜分析,結果表明RAPD圖譜可區分Foc R1和Foc R4以及菌株地理來源和致病力。同年該研究組分別篩選到2個生理小種的RAPD圖譜特征條帶,可用于Foc生理小種的檢測[31]。
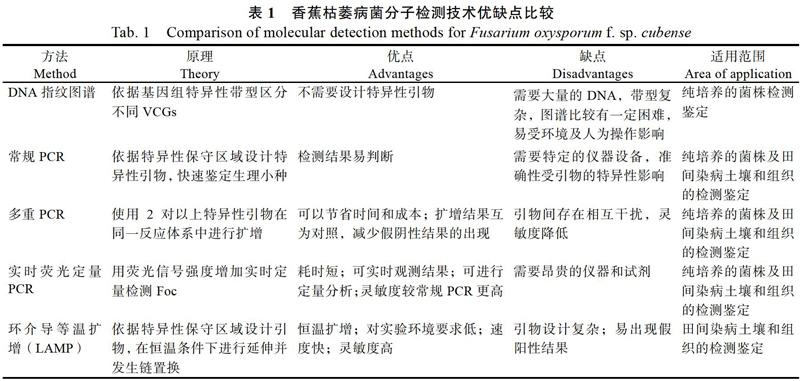
盡管許多研究表明,DNA指紋圖譜可以區分Foc R1和Foc R4[29-31],但該方法仍存在擴增條帶多、帶型難以重復、易受環境及人為操作影響等問題。因此,該技術在檢測實用性上仍有局限性。
2? 基于香蕉枯萎病菌特定DNA區段的PCR定性檢測
隨著測序技術和PCR技術的不斷發展,利用特異性引物對Foc進行定性檢測的技術應運而生。該技術利用不同Foc生理小種的特定DNA區段設計特異性引物進行PCR擴增,通過是否產生特異性條帶判斷目標菌的有無,檢測結果更易判定。
2.1? 香蕉枯萎病菌的普通PCR檢測
早期的香蕉枯萎病菌PCR檢測通常依據不同生理小種或VCG群的RAPD特異性條帶的SCAR分子標記來設計引物進行鑒定。劉景梅等[32]利用RAPD技術對廣東的18個Foc菌株進行分析,成功將4個RAPD標記簡化為SCAR標記,準確鑒定出廣東蕉區的Foc R1和Foc R4。葉建軍等[33]利用SCAR標記與ITS序列分析相結合的方法對Foc R4菌株進行擴增,進一步提高了檢測的準確性。Lin等[34]通過隨機引物OP-A02對臺灣地區的Foc R4菌株進行RAPD擴增,根據擴增產生的特異性DNA片段設計引物Foc-1/Foc-2,檢測下限可達10 pg基因組DNA。廖林鳳等[35]采用RAPD技術對廣東、廣西的30個Foc菌株和3個尖孢鐮刀菌不同專化型菌株進行比較及聚類分析,將1個RAPD標記轉化為SCAR標記,建立了Foc R4號生理小種快速檢測技術,檢測靈敏度為2 ng新鮮菌絲,并可對染病植株的不同部位進行檢測。
利用SCAR標記設計引物進行檢測和DNA指紋圖譜相比,結果更易于判定,但SCAR標記在基因組上的定位不確定,因此許多學者選擇利用菌株的保守區段設計特異性引物,以提高檢測結果的穩定性。王國芬等[36]依據Foc的ITS序列設計合成2對引物A(Fus F1/R1)和B(Fus F1/R2),其對目標菌株的檢測下限分別達100 fg和10 pg;其中引物A對Foc菌絲體基因組檢測能力較強,而引物B對感病組織有較好的檢測能力,可應用于病原菌的檢測和田間香蕉枯萎病的早期鑒定。Dita等[37-38]基于IGS區域存在的2個單核苷酸多態性位點開發了用于檢測Foc TR4(VCG01213)的PCR引物。采用該引物對土壤和染病香蕉組織進行檢測,可以檢出所有感染樣品中的Foc TR4。Li等[39]同樣依據該區段的差異設計了可檢測Foc TR4的特異性引物。
基于Foc基因組的保守區段設計引物,雖然能對Foc進行區分,但是對不同生理小種的區分有一定局限,往往還需要借助其他特征標記作為輔助。因致病性相關基因位點只存在于某種特定致病性菌株中,因此,利用與致病性相關位點設計引物,理論上可以更精準地區分不同致病性的生理小種。2013年Li等[40]通過鑒定Foc TR4突變株W2987的突變位點,發現1個假定毒力基因位點,并依據該基因區段設計引物用于檢測Foc TR4。該引物在香蕉染病組織和被病原菌污染的土壤樣品中均可檢出Foc TR4,檢出限為0.001 ng/?L基因組DNA和40個孢子/g土壤。這是毒力相關基因位點首次應用于Foc生理小種的檢測。2014年Fraser-Smith研究組[41]對Foc不同生理小種的致病相關基因SIX8進行了鑒定,檢測出2個SIX8基因同系物(Foc-SIX8a和Foc-SIX8b),并依據此基因位點設計引物用于檢測Foc R4和Foc STR4。此后,該研究組以SIX效應基因為靶點,開發出一組引物,分別可擴增Foc R1中的SIX6基因、Foc TR4中的SIX1基因、Foc STR4中的SIX8基因、Foc VCG 0121中的SIX9/SIX10基因和Foc VCG 0122中的SIX13基因,并通過限制性酶切的方法區分SIX1和SIX13基因擴增產物,從而構建了一套可以準確檢測Foc R1、Foc STR4和Foc TR4以及Foc VCG 0121和Foc VCG 0122的方法[42]。2016年楊臘英等[43]分析了來自不同地區的Foc菌株的SIX2基因序列,并依據該區段設計檢測Foc R4的特異性引物,檢測靈敏度可達5 pg/25 ?L,并可用于感病球莖組織的檢測。
2.2? 香蕉枯萎病菌的多重PCR檢測
多重PCR是在同一PCR反應中添加多對引物,同時檢測不同靶標序列的方法[44]。呂成偉等[45]基于Foc的ITS序列及不同生理小種的SCAR標記設計特異引物PR1/PR2和ST1/ST2,建立了香蕉枯萎病菌生理小種的雙重PCR檢測方法,可同時檢測Foc R1和Foc R4,檢測靈敏度可達200 pg。Dita等[37]利用引物組EF-1/EF-2、Foc TR4特異性引物組及香蕉肌動蛋白引物組分別構建了真菌和植物組織樣品中Foc TR4的多重PCR體系,以TEF-1α引物組和香蕉肌動蛋白引物組作為內陽性對照,前者用來排除真菌樣品中的假陰性現象,后者用來排除香蕉組織樣品中的假陰性現象。李敏慧等[46]基于Foc R4疑似致病基因序列分別設計了可檢測Foc R1和Foc R4的特異性引物以及尖孢鐮刀菌的通用引物,建立了三重PCR方法,可同步檢測Foc R1和Foc R4,并用于香蕉組織及土壤中香蕉枯萎病菌的檢測。
相對于DNA指紋圖譜檢測,基于病菌特定DNA區段進行定性檢測需要的模板量較少,擴增出的條帶單一,提高了檢測結果的準確性,同時降低了檢測結果的判定難度,在生產實踐中得到廣泛應用。多重PCR可在同一體系中同時擴增多個目標基因,擴增結果可作為內部對照互相參考驗證,一定程度上能避免假陰性結果的出現,還可以節約時間及成本[37, 46]。但同一體系中存在多對引物,易相互干擾而出現多條帶或引物二聚體,影響結果的判斷;同時由于引物間競爭靶標序列,靈敏度降低。這2種PCR方法在擴增后均需通過凝膠電泳對產物進行檢測,不能實時查看結果,也無法對病原菌進行定量。
目前已報道的分子檢測方法均為基于病菌DNA序列的檢測,均需從香蕉植株中取一部分組織提取DNA,并且需要操作者具備一定程度的分子生物學或植物病理學研究背景。隨著多學科交叉研究的發展,基于物理圖譜的無損檢測技術將會是未來檢測技術開發的一個重要方向。2020年初,Lin等[67]將拉曼光譜應用于田間感病香蕉的檢測,在無癥狀的Foc感染樣本中檢測到香蕉枯萎病菌的比率為76.2%,與其他分子檢測方法檢出率相當。這一研究為田間香蕉枯萎病菌的檢測鑒定提供了新思路。隨著交叉學科研究的不斷深入,未來香蕉枯萎病的診斷將向更簡便智能的方向發展。同時,適用于一線農技人員的便攜式物理無損檢測儀器和自動化檢測方法的開發,也將有助于進一步擴大香蕉枯萎病菌檢測的適用場景和范圍。
參考文獻
王振中. 香蕉枯萎病及其防治研究進展[J]. 植物檢疫, 2006(3): 198-200.
麥明曉, 黃惠琴, 鮑時翔. 香蕉鐮刀菌枯萎病4號生理小種研究進展[J]. 中國生物防治, 2009, 25(S1): 71-75.
Ploetz R C. Fusarium wilt of banana[J]. Phytopathology, 2015, 105(12): 1512-1521.
付? 崗, 葉云峰, 杜嬋娟, 等. 香蕉枯萎病菌群體多樣性研究進展[J]. 植物檢疫, 2016, 30(2): 1-6.
Waite B H, Stover R H. Studies on Fusarium wilt of bananas: VI. Variability and the cultivar concept in Fusarium oxysporum f. sp. cubense[J]. Canadian Journal of Botany, 1960, 38(6): 985-994.
Stover R H, Waite B H. Studies on Fusarium wilt of bananas: V. Pathogenicity and distribution of Fusarium oxysporum f. sp. cubense races 1 and 2[J]. Canadian Journal of Botany, 1960, 38(1): 51-61.
Page O T. Variation in the banana-wilt pathogen, Fusarium oxysporum f. sp. cubense[J]. Canadian Journal of Botany, 1961, 39(3): 545-557.
Ploetz R C, Correll J C. Vegetative compatibility among races of Fusarium oxysporum f. sp. cubense[J]. Plant Disease, 1988, 72(4): 325-328.
李? 斌, 盛? 鷗, 李春雨, 等. 香蕉枯萎病病原菌的研究進展[J]. 分子植物育種, 2013, 11(5): 638-646.
曾? 莉, 郭志祥, 番華彩, 等.云南香蕉枯萎病及防治研究進展[J]. 熱帶農業科技, 2016, 39(4): 19-22, 24.
李華平, 李云鋒, 聶燕芳. 香蕉枯萎病的發生及防控研究現狀[J]. 華南農業大學學報, 2019(5): 128-136.
Stover R H. Studies on Fusarium wilt of bananas: VIII. Differentiation of clones by cultural interaction and volatile substances[J]. Canadian Journal of Botany, 1962, 40(11): 1467-1471.
Komada H. A new selective medium for isolating Fusarium from natural soil[J]. Review of Plant Protection Research, 1975, 8: 114-124
Sun E J. Identification of Fusarium oxysporum f. sp. cubense race 4 from soil or host tissue by cultural characters[J]. Phytopathology, 1978, 68(11): 1672-1673.
Moore N Y, Hargreaves P A, Pegg K G, et al. Characterisation of strains of Fusarium oxysporum f. sp. cubense by production of volatiles[J]. Australian Journal of Botany, 1991, 39(2): 161-166.
Puhalla J E. Classification of strains of Fusarium oxysporum on the basis of vegetative compatibility[J]. Canadian Journal of Botany, 2011, 63(2): 179-183.
張紹升, 肖? 順, 劉國坤. 香蕉枯萎病早期診斷和病原菌快速檢測[J]. 中國熱帶農業, 2011(6): 55-56.
彭埃天, 宋曉兵, 凌金鋒, 等. 香蕉枯萎病菌4號生理小種分子檢測與枯萎病生物防治研究進展[J]. 果樹學報, 2009, 26(1): 77-81.
曾莉莎, 呂? 順, 劉文清, 等. 基于多基因序列分析對尖孢鐮孢菌古巴專化型(香蕉枯萎病菌)生理小種的鑒定[J]. 菌物學報, 2014, 33(4): 867-882.
Badali H, Nabili M. Molecular tools in medical mycology; Where we are![J]. Jundishapur Journal of Microbiology, 2012, 6(1): 1-3.
彭丹丹, 張源明, 舒燦偉, 等. 植物病原真菌分子檢測技術的研究進展[J]. 基因組學與應用生物學, 2017, 36(5): 2015-2022.
John W, Michael M C. Fingerprinting genomes using PCR with arbitrary primers[J]. Nucleic Acids Research, 1990, 18(24): 7213-7218.
Boehm E W A. Statistical analysis of electrophoretic karyotype variation among vegetative compatibility groups of Fusarium oxysporum f. sp. cubense[J]. Molecular Plant Microbe Interactions, 1994, 7(2): 196-207.
Bentley S, Pegg K G, Dale J L. Optimization of RAPD-PCR fingerprinting to analyse genetic variation within populations of Fusarium oxysporum f. sp. cubense[J]. Journal of Phytopathology, 1994, 142(1): 64-78.
Bentley S, Pegg K G, Dale J L. Genetic variation among a world-wide collection of isolates of Fusarium oxysporum f. sp. cubense analysed by RAPD-PCR fingerprinting[J]. Mycological Research, 1995, 99(11): 1378-1384.
Bentley S, Bassam B J. A robust DNA amplification fingerprinting system applied to analysis of genetic variation within Fusarium oxysporum f. sp. cubense[J]. Journal of Phytopathology, 1996, 144(4): 207-213.
Bentley S, Pegg K G, Moore N Y, et al. Genetic variation among vegetative compatibility groups of Fusarium oxysporum f. sp. cubense analyzed by DNA fingerprinting[J]. Phytopathology, 1998, 88(12): 1283-1293.
Gerlach K S, Bentley S, Moore N Y, et al. Characterisation of Australian isolates of Fusarium oxysporum f. sp. cubense by DNA fingerprinting analysis[J]. Australian Journal of Agricultural Research, 2000, 51(8): 945-953.
劉景梅, 王璧生, 陳? 霞, 等. 廣東香蕉枯萎病菌生理小種RAPD技術的建立[J]. 廣東農業科學, 2004(4): 43-45, 55.
謝藝賢, 張? 欣, 漆艷香, 等. 香蕉枯萎病菌的致病性測定及其RAPD分析[J]. 熱帶作物學報, 2005, 26(2): 68-71.
漆艷香, 謝藝賢, 張? 欣, 等. 海南省香蕉枯萎菌生理小種的RAPD分析[J]. 菌物學報, 2005, 24(3): 394-399.
劉景梅, 陳? 霞, 王璧生, 等. 香蕉枯萎病菌生理小種鑒定及其SCAR標記[J]. 植物病理學報, 2006(1): 28-34.
葉建軍, 朱? 軍, 黃惠琴, 等. 一種快速、有效的香蕉枯萎病病原菌FOC4的分子檢測方法[J]. 中國生物防治學報, 2008, 24(S1): 102-105.
Lin Y H, Chang J Y, Liu E T, et al. Development of a molecular marker for specific detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2009, 123(3): 353-365.
廖林鳳, 董章勇, 王振中, 等. 香蕉枯萎病菌RAPD分析及4號生理小種的快速檢測[J]. 植物病理學報, 2009, 39(4): 353-361.
王國芬, 彭? 軍, 代? 鵬, 等. 香蕉枯萎病鐮刀菌ITS序列的PCR擴增及其分子檢測[J]. 華南熱帶農業大學學報, 2007, 13(3): 1-5.
Dita M A, Waalwijk C, Buddenhagen I W, et al. A molecular diagnostic for tropical race 4 of the banana Fusarium wilt pathogen[J]. Plant Pathology, 2010, 59(2): 348-357.
Dita M A, Waalwijk C, Mutua P, et al. Detecting Fusarium oxysporum f. sp. cubense tropical race 4 in soil and symptomless banana tissues[J]. Acta Horticulturae, 2013(986): 127-130.
Li C Y, Mostert G, Zuo C W, et al. Diversity and distribution of the banana wilt pathoge Fusarium oxysporum f. sp. cubense in China[J]. Fungal Genomics Biology, 2013, 3(2): 111.
Li M H, Shi J, Xie X, et al. Identification and application of a unique genetic locus in diagnosis of Fusarium oxysporum f. sp. cubense tropical race 4[J]. Canadian Journal of Plant Pathology, 2013, 35(4): 482-493.
Fraser-Smith S, Czislowski E, Meldrum R A, et al. Sequence variation in the putative effector gene SIX8 facilitates molecular differentiation of Fusarium oxysporum f. sp. cubense[J]. Plant Pathology, 2014, 63(5): 1044-1052.
Carvalhais L C, Henderson J, Rincon-Florez V A, et al. Molecular diagnostics of banana Fusarium wilt targeting Secreted-in-Xylem genes [J]. Frontiers in Plant Science, 2019, 10: 547.
楊臘英, 郭立佳, 汪? 軍, 等. 香蕉枯萎病菌SIX2基因序列及特異性分析[J]. 植物保護, 2016, 42(5): 118-124.
Henegariu O, Heerema N A, Dlouhy S R, et al. Multiplex PCR: Critical parameters and step-by-step protocol[J]. Biotechniques, 1997, 23(3): 504-511.
呂偉成, 張紹升, 林志遠. 一步雙重PCR檢測香蕉枯萎病菌生理小種[J]. 中國農學通報, 2009, 25(1): 237-240.
李敏慧, 余雄濤, 王鴻飛, 等. 香蕉枯萎病菌1號和4號生理小種的快速檢測與鑒定[J]. 中國農業科學, 2012, 45(19): 3971-3979.
Heid C A, Stevens J, Livak K J, et al. Real time quantitative PCR[J]. Genome Research, 1996, 6(10): 986-994.
Lin Y H, Su C C, Chao C P, et al. A molecular diagnosis method using real-time PCR for quantification and detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2013, 135(2): 395-405.
魏? 森, 陳漢清, 曾? 濤, 等. 土壤中香蕉枯萎病菌FOC4的實時熒光定量PCR檢測[J]. 基因組學與應用生物學, 2019, 38(8): 3548- 3553.
Yang L L, Sun L X, Ruan X L, et al. Development of a single-tube duplex real-time fluorescence method for the rapid quantitative detection of Fusarium oxysporum f. sp. cubense race 1 (FOC1) and race 4 (FOC4) using TaqMan probes[J]. Crop Protection, 2015, 68: 27-35.
Aguayo J, Mostert D, Fourrier-Jeandel C, et al. Development of a hydrolysis probe-based real-time assay for the detection of tropical strains of Fusarium oxysporum f. sp. cubense race 4[J]. PLoS One, 2017, 12(2): e0171767.
馬月萍, 戴思蘭, 馬艷蓉. 熒光定量PCR技術在植物研究中的應用[J]. 生物技術通報, 2011(7): 37-45.
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63.
Li B J, Du J L, Lan C Z, et al. Development of a loop-mediated isothermal amplification assay for rapid and sensitive detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2013, 135(4): 903-911.
Zhang X, He Z, Pu J J, et al. Development of a real-time fluorescence loop-mediated isothermal amplification assay for rapid and quantitative detection of Fusarium oxysporum f. sp. cubense tropical race 4 in soil[J]. PLoS One, 2013, 8(12): e82841.
Peng J, Zhang H, Chen F P, et al. Rapid and quantitative detection of Fusarium oxysporum f. sp. cubense race 4 in soil by real-time fluorescence loop-mediated isothermal amplification[J]. Journal of Applied Microbiology, 2014, 117(6): 1740-1749.
胡宗悅, 須周恒, 盧亦愚. 環介導等溫擴增技術的常見問題分析與研究進展[J]. 病毒學報, 2016, 32(5): 659-665.
Lin Y H, Lin Y J, Chang T D, et al. Development of a TaqMan probe-based insulated isothermal polymerase chain reaction (iiPCR) assay for detection of Fusarium oxysporum f. sp. cubense race 4[J]. PLoS One, 2016, 11(7): e0159681.
張吉祥, 凌? 鍵, 謝丙炎, 等. 尖孢鐮刀菌專化型及生理小種分子檢測研究進展[J]. 中國農學通報, 2013, 29(36): 338-342.
孫? 勇, 曾會才, 彭? 明, 等. 香蕉枯萎病致病分子機理與防治研究進展[J]. 熱帶作物學報, 2012, 33(4): 759-766.
李敏慧, 苑曼琳, 姜子德, 等. 香蕉枯萎病菌致病機理研究進展[J]. 果樹學報, 2019, 36(6): 803-811.
Aslam S, Tahir A, Aslam M F, et al. Recent advances in molecular techniques for the identification of phytopathogenic fungi - a mini review[J]. Journal of Plant Interactions, 2017, 12(1): 493-504.
Koenig R L, Ploetz R C, Kistler H C. Fusarium oxysporum f. sp. cubense consists of a small number of divergent and globally distributed clonal lineages[J]. Phytopathology, 1997, 87(9): 915-923.
Katan T. Current status of vegetative compatibility groups in Fusarium oxysporum[J]. Phytoparasitica, 1999, 27(1): 51-64.
Fourie G, Steenkamp E T, Gordon T R, et al. Evolutionary relationships among the Fusarium oxysporum f. sp. cubense vegetative compatibility groups[J]. Applied and Environmental Microbiology, 2009, 75(14): 4770-4781
Li M H, Yang B, Leng Y, et al. Molecular characterization of Fusarium oxysporum f. sp. cubense race 1 and 4 isolates from Taiwan and Southern China[J]. Canadian Journal of Plant Pathology, 2011, 33(2): 168-178.
Lin Y J, Lin H K, Lin Y H. Construction of raman spectroscopic fingerprints for the detection of Fusarium wilt of banana in Taiwan[J]. PLoS One, 2020, 15(3): e0230330.

